Cos’è l’elettronegatività?
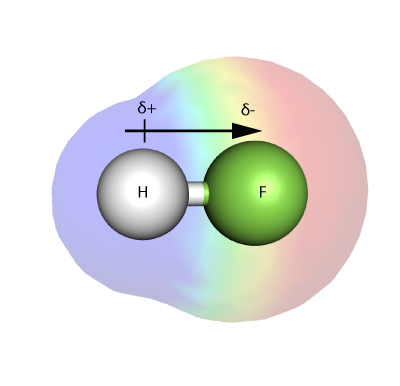
ELETTRONEGATIVITÀ
L’elettronegatività è una misura di quanto fortemente un atomo – in una molecola – è capace di attrarre elettroni in un legame con se stesso.
Fattori che influenzano l’elettronegatività:
1) Il numero atomico
Il numero atomico è il numero di protoni nel nucleo di un atomo.
Determina le proprietà chimiche di un elemento e il suo posto nella tavola periodica.
Più alto è il numero atomico, più forte è l’elettronegatività.
2) Il raggio atomico
Il raggio atomico di un elemento chimico è solitamente misurato dalla distanza dal centro del nucleo al confine dello strato più esterno di elettroni.
Più grande è il raggio atomico, più debole è l’elettronegatività.
Esempio di raggio atomico di un atomo di ossigeno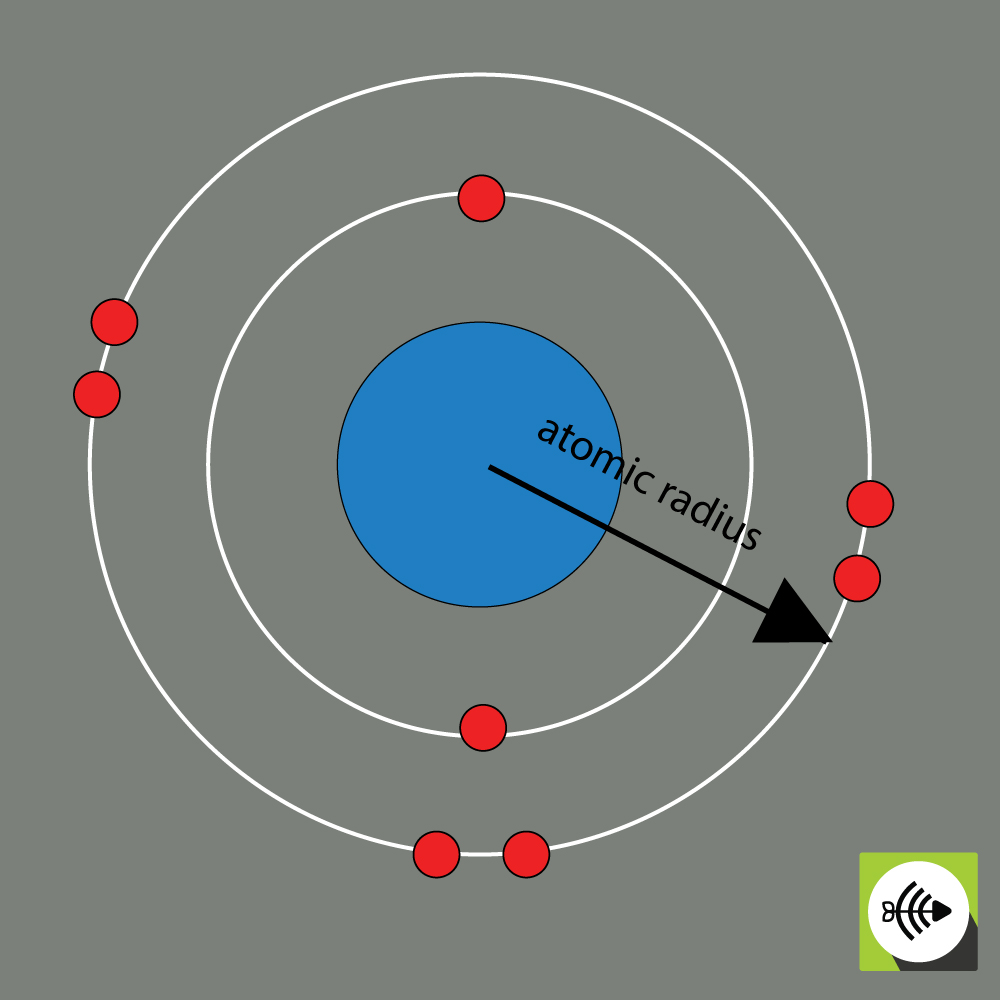
In cosa si misura l’elettronegatività?
La misura più comune per l’elettronegatività è la scala Pauling, progettata dal due volte premio Nobel Linus Pauling. La scala di elettronegatività per gli elementi dice quanto forte ogni elemento (rispetto ad ogni altro) può attrarre gli elettroni di legame a se stesso. Più alto è il numero di elettronegatività, più l’atomo tenterà di attirare gli elettroni verso di sé.
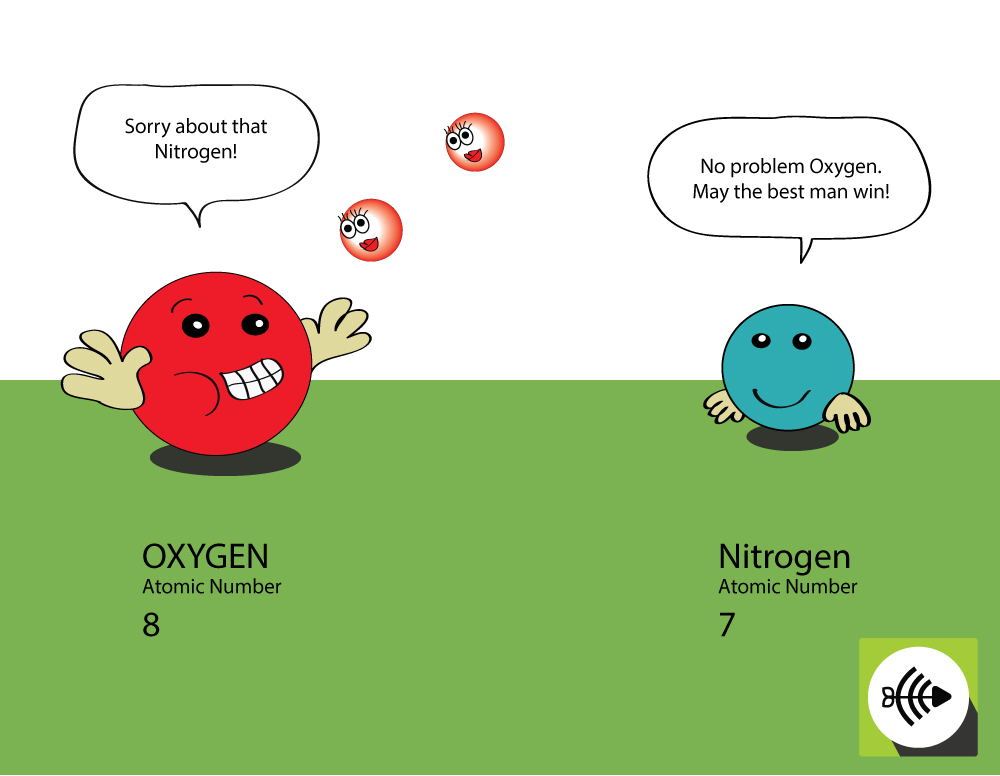
Perché l’ossigeno è più elettronegativo dell’azoto?
L’ossigeno ha un numero atomico superiore
- L’ossigeno ha 8 protoni nel nucleo mentre l’azoto ne ha solo 7.
- Una coppia di elettroni di legame subirà più attrazione dal nucleo dell’ossigeno che da quello dell’azoto, quindi l’elettronegatività dell’ossigeno è maggiore.
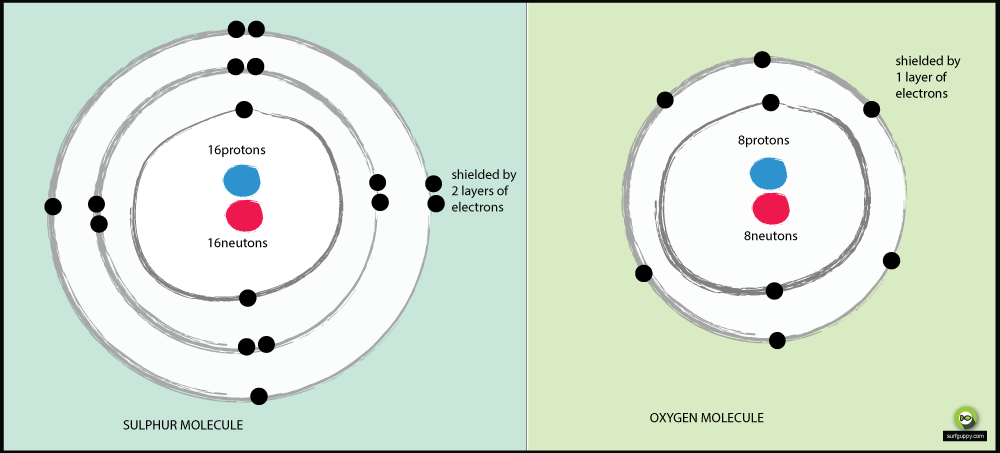
Perché lo zolfo è meno elettronegativo dell’ossigeno?
Perché l’ossigeno è più elettronegativo dello zolfo:
- L’ossigeno ha 2 livelli di energia, lo zolfo ne ha 3
- Gli elettroni di legame nello zolfo sono più lontani dal nucleo dell’atomo
- Quando gli elettroni di legame sono più lontani dal nucleo dell’atomo, c’è meno attrazione dal nucleo
- La coppia di elettroni di legame nell’ossigeno subirà più attrazione dal suo nucleo rispetto agli elettroni di legame dello zolfo
- Quindi l’ossigeno è un atomo più elettronegativo
Per favore, leggi gli elettroni di valenza prima di procedere. Elettroni di valenza

L’atomo più piccolo ha una maggiore elettronegatività
Tendenze di elettronegatività presenti nella tavola periodica
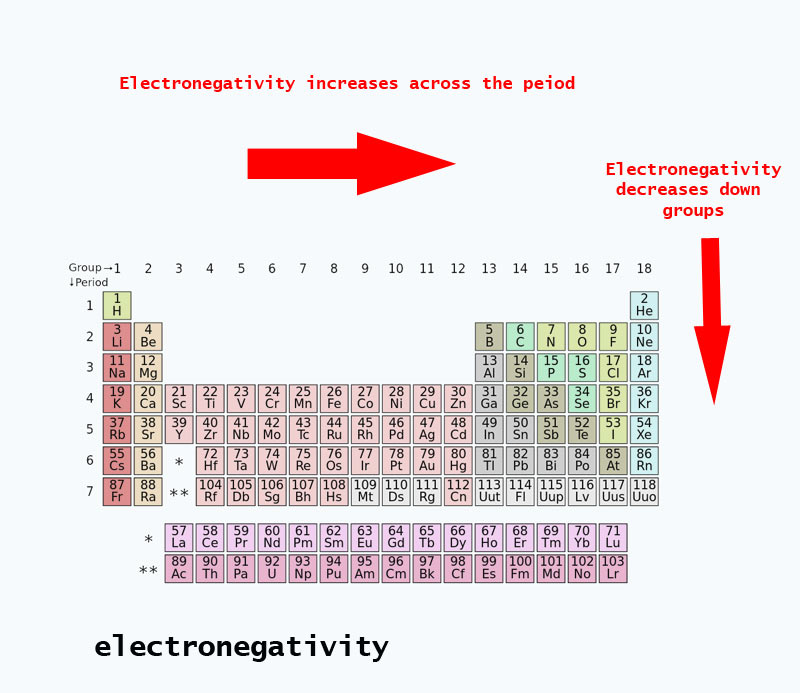
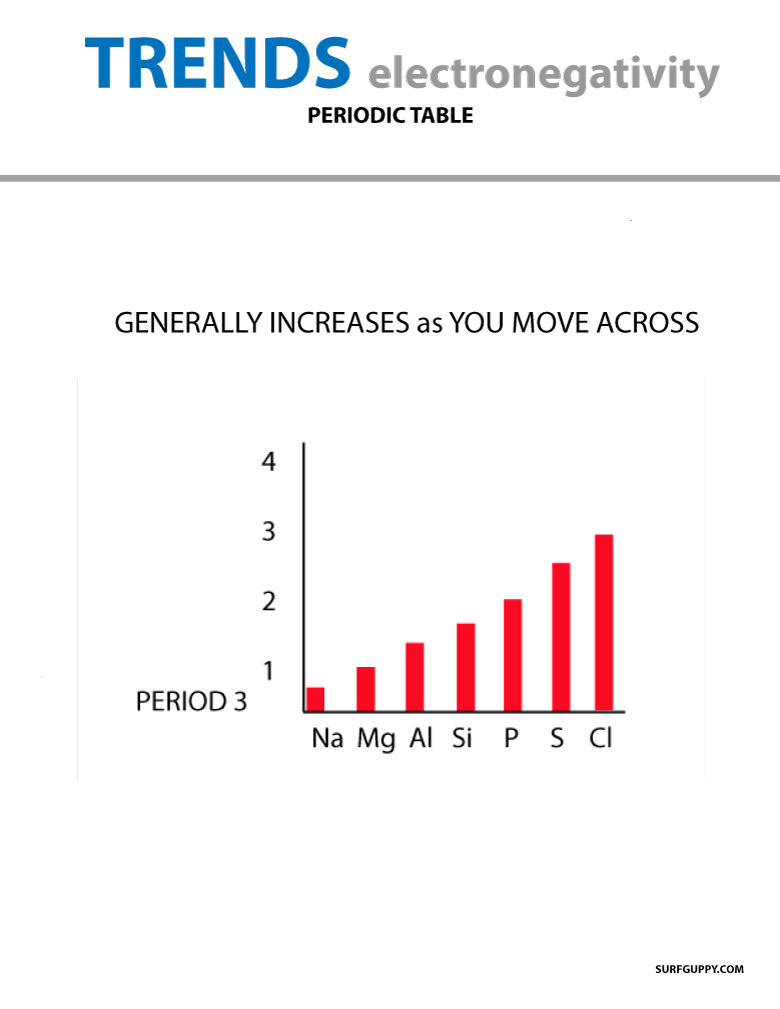
Quando ci si sposta nella tavola periodica, il numero di protoni nel nucleo aumenta (senza aumento di livello energetico), quindi l’elettronegatività aumenta.
Quando il numero atomico aumenta lungo un gruppo, c’è anche un aumento dei livelli di energia. Il raggio atomico è maggiore quindi l’elettronegatività diminuisce.
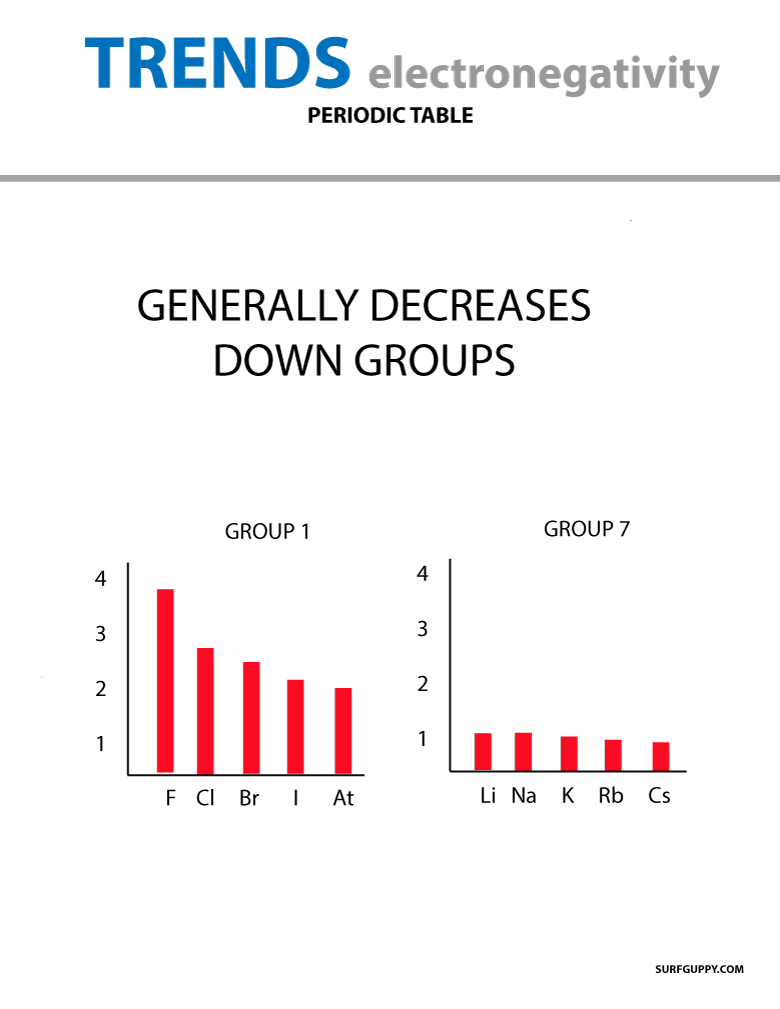
TAVOLA PERIODICA DELL’ELETTRONEGATIVITÀ
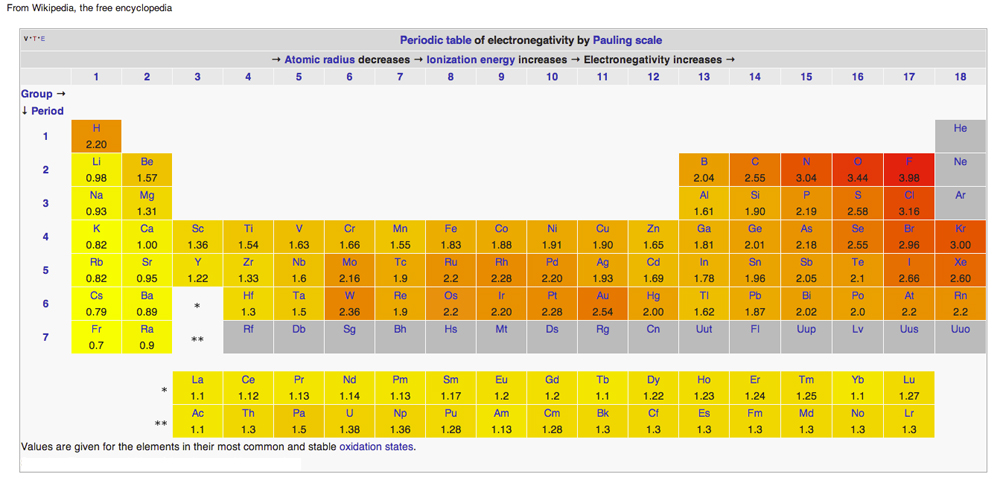 Diagramma da Wikipedia rilasciato sotto Creative Common Licenses
Diagramma da Wikipedia rilasciato sotto Creative Common Licenses
Leave a Reply