Anatomia dei nodi cardiaci e del sistema di conduzione specializzato atrioventricolare | Revista Española de Cardiología
INTRODUZIONE
Gli studi classici di Stannius1 nel 1852 furono i primi a proporre che la conduzione cardiaca fosse miogenica. Circa un secolo fa fu dimostrato che il tessuto muscolare specializzato era responsabile dell’inizio e della diffusione del battito cardiaco. Nel 1906, Sunao Tawara2 confermò l’esistenza di un fascio muscolare descritto da His3 già nel 1893. Sempre nel 1906, Keith e Flack4 confermarono l’esistenza del sistema His-Tawara. Un anno dopo descrissero la struttura del nodo senoatriale (SA).5
Anche se Purkinje6 fu il primo a descrivere le fibre ventricolari specializzate, non era consapevole della loro importanza nella struttura del cuore, e fu Tawara2 a dimostrare che il fascio muscolare descritto da His era continuo con le fibre ventricolari di Purkinje.6 Gli studi di Tawara sono stati recentemente tradotti in inglese,7 anche se la prima traduzione di parte del suo lavoro in questa lingua fu fatta da Robb8 nel suo libro di testo del 1965. Questi lavori sono una lettura fondamentale per tutti i ricercatori che vogliono studiare il sistema di conduzione cardiaca (CS).
COMPONENTI DEL SISTEMA DI CONDUZIONE ATRIOVENTRICOLARE SPECIFICO
Il fascio muscolare che collega gli atri ai ventricoli fu descritto da His3 come un “fascio penetrante”. Tuttavia, His non ha osservato la continuazione istologica di questo fascio nell’atrio destro con il nodo atrioventricolare (AV), i ventricoli o le cellule di Purkinje ventricolari. Fu Tawara2 a riconoscere questa connessione mentre lavorava per il suo dottorato sotto la direzione di Aschoff. In precedenza, nel 1893, sia Kent9 che His3 avevano descritto delle connessioni AV muscolari che furono causa di molta confusione per molti anni.10 Più tardi, fu osservato che queste connessioni non si trovavano nei cuori sani, ma in quelli malati.
In seguito alle scoperte di Kent e His, sia i cardiologi clinici che i fisiologi cercarono la struttura responsabile della generazione dell’impulso cardiaco. Si sospettava che questa fosse situata nella zona in cui la vena cava superiore e l’atrio destro si uniscono; in condizioni sperimentali questa è l’ultima parte del cuore a smettere di battere (il cosiddetto ultimum moriens). Nel 1907, Keith e Flack5 distinsero il nodo SA o nodo del seno in tutti i mammiferi che avevano studiato, compreso l’uomo. Si credeva che le sue cellule costituenti fossero il luogo di origine dell’impulso cardiaco.
Il CS nasce nel nodo SA, che si trova nell’atrio superiore anteriore destro (Figura 1). Il nodo AV si trova in una posizione più bassa e posteriore nell’atrio. Il CS si estende dal nodo AV al fascio penetrante di His e poi si divide nei rami del fascio destro e sinistro che scendono attraverso il setto interventricolare, avvolti in una guaina di tessuto connettivo che li isola dal tessuto muscolare circostante. All’interno del miocardio sono continui con la rete di Purkinje (Figura 1).
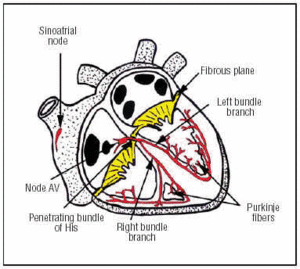
Fig. 1. Rappresentazione schematica del sistema di conduzione cardiaca (rosso). Il fascio di His penetrante perfora il piano fibroso atrioventricolare (AV).
Aree di interesse morfologico-macroscopiche
Diverse aree di interesse macroscopico aiutano a localizzare il CS cardiaco. Il nodo SA, che è sub-epicardico (Figura 2a), è incuneato nella giuntura tra la muscolatura della vena cava superiore e quella dell’appendice atriale. La sua base è opposta alla cresta terminale. La distanza tra il nodo SA e l’epicardio è di 0,3±0,1 mm.11 In circa il 10% delle persone, il nodo non si estende verso la vena cava inferiore ma si trova a ferro di cavallo intorno alla parte inferiore dell’orifizio della vena cava superiore.12 Il nodo AV si trova alla base del setto atriale all’apice di un’area triangolare illustrata per la prima volta da Koch.13 Questo triangolo è situato sulla superficie endocardica dell’atrio destro (Figure 2b e c), è delimitato anteriormente dall’inserzione del foglietto settale della valvola tricuspide e posteriormente da un tendine fibroso noto come tendine di Todaro. Questo tendine è la continuazione fibrosa subendocardica della valvola di Eustachio, e si inserisce nella muscolatura atriale che separa l’orifizio del seno coronarico dalla fossa ovale. L’apice di questo triangolo è formato superiormente dalla giunzione dei bordi anteriore e posteriore di cui sopra, corrispondente al corpo fibroso centrale (CFB) del cuore. La base del triangolo è formata dall’orifizio del seno coronarico insieme al vestibolo dell’atrio destro che sostiene il foglietto settale della valvola tricuspide. Questa base è nota agli elettrofisiologi come istmo settale, ed è qui che viene eseguita l’ablazione a radiofrequenza della via lenta nei pazienti con tachicardia da rientro del nodo AV.14
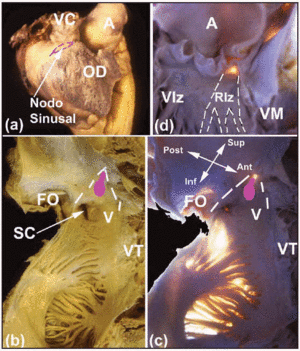
Fig. 2. A: vista epicardica laterale dell’atrio destro con il sito del nodo SA mostrato dalla linea rosa tratteggiata. B e C: viste endocardiche (normali e con transilluminazione) delle pareti posteriori e settali dell’atrio destro per mostrare la fossa ovale (OF) e i limiti del triangolo di Koch (linee bianche tratteggiate), il tendine di Todazo (TT) e l’inserimento della cuspide settale della valvola tricuspide (TV). Il vestibolo (V) dell’atrio destro e l’orifizio del seno coronarico (CS) formano il limite inferiore. La posizione del nodo AV è indicata da un nodulo ovale (rosa). D: vista ventricolare sinistra per mostrare il setto membranoso (transilluminazione). Questo è il punto di emergenza del fascio di His e la sua continuità con i rami del fascio destro e sinistro. La branca sinistra del fascio (LBB) è contrassegnata da linee bianche tratteggiate. A indica l’aorta; AA, appendice atriale; VC, vena cava superiore; RV, ventricolo destro; LV, ventricolo sinistro; MV, valvola mitrale.
La continuazione della conduzione AV avviene attraverso il fascio penetrante di His, l’unica parte dell’asse conduttivo che perfora il CFB. Il CFB è formato dall’unione del tessuto connettivo dei foglietti della valvola aortica e mitrale con il foglietto settale della valvola tricuspide – il cosiddetto trigono fibroso destro – e la parte membranosa del setto interventricolare. In molti cuori di mammiferi, il trigono è fibroso, ma i cuori bovini hanno una massa centrale di osso o cartilagine (l’os cordis). Al contrario, il tessuto fibroso del CFB di capodoglio è molto sciolto. La porzione membranosa o setto, che può variare in lunghezza, è una buona guida per individuare il fascio AV di His. Questo appare sopra questa porzione membranosa dopo aver attraversato il trigono fibroso destro (Figura 2d), e poi si divide in rami del fascio sinistro e destro. Il ramo destro passa attraverso la muscolatura del setto alla base del muscolo papillare mediale del ventricolo destro. Diventa poi un cordone sottile che penetra in profondità nella trabecola settomarginale o banda moderatrice che collega i muscoli papillari mediale e anteriore. L’origine del ramo sinistro si trova sotto la commissura tra la cuspide destra e quella non coronarica della valvola aortica; poi scende attraverso il subendocardio del setto interventricolare (Figura 2d). Il suo percorso è talvolta visibile grazie alla lucida lamina fibrosa che lo riveste. La parte prossimale del ramo sinistro è molto più lunga di quella del destro. Occasionalmente nei cuori fetali o infantili si vede un terzo ramo chiamato “dead-end tract “15 , che continua il fascio di His in direzione anterio-superiore verso la radice dell’aorta.
Struttura dei nodi e del sistema di conduzione atrioventricolare
Studi in cui le tecniche istologiche impiegate erano simili a quelle utilizzate da Tawara2 e da lavoratori successivi come Davies16 e Truex et al17 (per citarne solo alcuni) hanno dimostrato che il CS dell’uomo è organizzato in modo del tutto simile a quello di altri mammiferi (con leggere variazioni tra le specie e tra i cuori). Tawara2 ha riportato la separazione dei miociti specializzati dai miociti normali o funzionanti da un sottile foglio di tessuto connettivo visibile al microscopio ottico, e su questo si basano i criteri proposti da Aschoff18 e Mönckeberg19 per l’identificazione istologica del miocardio specializzato. In poche parole, i miociti specializzati si distinguono dai miociti funzionanti quando sono visti al microscopio ottico, e possono essere “seguiti” da una sezione istologica all’altra. Nella sua monografia, Robb8 ha preferito definire il tessuto conduttivo con il termine “collegamento” piuttosto che “sistema conduttivo”, perché i preparati istologici definiscono meglio la morfologia delle cellule rispetto alla funzione. Ha anche osservato differenze nella consistenza del miocardio specializzato a seconda della freschezza del materiale autoptico e dei metodi di fissaggio e colorazione utilizzati. Tawara2 era consapevole di questo e sottolineò l’eterogeneità della morfologia dei miociti specializzati anche nelle sezioni istologiche del cuore. All’interno di una data specie, le differenze più evidenti sono legate all’età degli individui esaminati.20 Negli ultimi anni sono stati utilizzati diversi marcatori molecolari e immunoistochimici per localizzare il tessuto conduttore nei cuori embrionali dell’uomo e di altri mammiferi. Tuttavia, non è stato trovato alcun marcatore specifico che possa evidenziare questo tessuto negli esseri umani adulti.
Nel cuore umano normale, i nodi SA e AV non soddisfano i criteri di Aschoff e Mönckeberg18,19 perché non sono elettricamente isolati dal miocardio circostante da tessuto connettivo o grasso. Piuttosto, entrano in contatto con le fibre di lavoro atriali dopo una piccola area composta da cellule di transizione. Nel nodo SA, Keith e Flack5 hanno distinto tra il seno e le cellule di lavoro. Tawara2, tuttavia, ha indicato le difficoltà incontrate nel differenziare le cellule del nodo AV da quelle del fascio di His. Egli propose quindi che la differenza tra loro fosse puramente anatomica. Sulla base di questa definizione, la porzione del CS completamente inguainato dal CFB è chiamato il fascio penetrante o fascio di His (Figura 3a). La porzione atriale dal sistema di conduzione prossimale al fascio di His è chiamata nodo AV (Figura 3b). Questa distinzione anatomica è logica perché l’isolamento del fascio di His penetrante gli impedisce di entrare in contatto diretto con l’attività elettrica dell’atrio afferente. Qualsiasi attività atriale deve quindi essere precedentemente diretta attraverso il nodo AV.
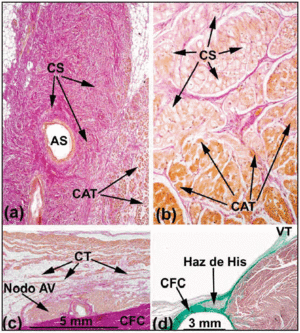
Fig. 3. Sezioni istologiche sagittali del nodo senoatriale (SA) del cuore umano (a;x10) e suino (b;x40) colorate con il metodo van Gieson. Si noti il contatto tra le cellule del seno (SC) e le cellule atriali funzionanti (WAC). Le cellule del seno sono caratterizzate da essere più chiaro e incorporato in una maggiore quantità di tessuto connettivo (rosso). c: van Gieson colorato sezione della zona centrale del triangolo di Koch. Si noti la forma del nodo AV compatto e le cellule di transizione (TC) in contatto con la superficie convessa del nodo compatto. d: Sezione colorata con tricromia di Masson che mostra il fascio penetrante di His circondato da tessuto fibroso (verde) del CFB. SNA indica l’arteria del nodo del seno; CFB, corpo fibroso centrale; TV, valvola tricuspide.
La funzione intrinseca del nodo SA è di essere la fonte dell’impulso cardiaco. Il nodo SA nell’uomo è una struttura arcuata o fusiforme. Istologicamente è composto da cellule leggermente più piccole delle normali cellule di lavoro che sono disposte in fasci. Queste si mescolano senza ordine spaziale, si colorano debolmente e sono incorporate in una densa matrice di tessuto connettivo (Figura 3 a e b). Con l’età, la quantità di tessuto connettivo aumenta rispetto all’area occupata dalle cellule nodali.21 Alla periferia del nodo, le cellule specializzate si mescolano con quelle del miocardio funzionante (Figure 3a e b). Inoltre, sono state descritte radiazioni multiple o estensioni interdigitanti con il miocardio atriale di lavoro. Queste penetrano intramiocardicamente nella cresta terminale e nella vena cava superiore e inferiore. Il nodo SA è disposto intorno a un’arteria nota come arteria del nodo del seno, che può correre centralmente o eccentricamente all’interno del nodo. Nel 29% dei cuori umani questa arteria si ramifica all’interno del nodo.11 Il nodo SA è anche intimamente associato al sistema nervoso autonomo. È stato suggerito che la maggior parte di queste fibre nervose sono parasimpatiche, mentre le fibre simpatiche sono concentrate intorno ai vasi sanguigni del nodo.23
La funzione intrinseca del nodo AV è di ritardare l’impulso cardiaco. Nell’uomo, questo nodo ha una porzione compatta e una zona di cellule di transizione. La prima è semi-ovale e si trova sopra il CFB (Figura 3c). Nelle sezioni vicine alla base del triangolo di Koch, la parte compatta del nodo si divide in due estensioni o prolungamenti. L’arteria che vascolarizza il nodo AV si trova solitamente tra queste. La lunghezza di questi prolungamenti varia da un cuore all’altro.24 Le dimensioni delle cellule di transizione sono intermedie tra quelle del nodo AV e le cellule di lavoro atriali. Sono circondate da una quantità di cellule connettive maggiore di quella che copre le cellule di lavoro, ma non sono isolate dal miocardio adiacente. Piuttosto, formano una sorta di ponte tra il miocardio di lavoro e quello nodale, e raccolgono informazioni elettriche dalle pareti atriali, trasmettendole al nodo AV.
La controversia riguarda il modo in cui l’impulso dal nodo SA raggiunge il nodo AV. Alcuni autori hanno suggerito l’esistenza di tratti specializzati tra di loro.25 I nostri studi non sostengono questa idea, ma favorire l’ipotesi che le fibre muscolari di lavoro stessi (e la loro disposizione geometrica nelle pareti atriali) sono responsabili per la conduzione di essere più rapido in alcune aree dell’atrio che in altri.26
Il nodo AV continua distalmente con il fascio penetrante di His (Figura 3d), anche se ci sono leggere differenze in termini di disposizione cellulare tra queste due strutture, compresa la disposizione del fascio di His cellule in modo più parallelo. La spiegazione di ciò potrebbe essere morfologica: il fascio di His inizia ad essere circondato dal tessuto connettivo del CFB, diventando così un tratto conduttore che porta informazioni ai ventricoli.
Il nodo AV del cane è più piccolo di quello umano, ma ha un fascio di His penetrante più lungo.27 Alcuni autori28 interpretano ciò nel senso che una parte del nodo AV del cane si trova all’interno del CFB. Nel coniglio, altri autori29 descrivono parte del fascio di His come se facesse parte del nodo AV, ma questo è un errore (Figure 4a-d). La differenza morfologica più rilevante tra il nodo AV del cane e quelli del coniglio e dell’uomo è che il primo non è coperto da cellule di transizione. Nei ratti (con una frequenza cardiaca a riposo 10 volte più veloce di quella dei cani o degli esseri umani), il nodo AV è proporzionalmente comparabile a quello del cane, ma il CFB è più piccolo.
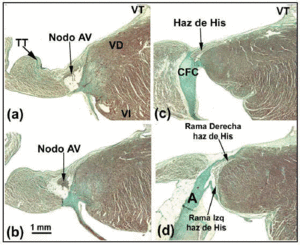
Fig. 4. Questa figura composita mostra il nodo atrioventricolare (AV) più il fascio di His e i suoi rami di destra e sinistra fascio nel coniglio. La barra orizzontale in b rappresenta 1 mm (lo stesso per tutte le immagini). Colorazione tricromica di Masson. A indica l’aorta; TT, tendine di Todaro; RV, ventricolo destro; LV, ventricolo sinistro; TV, valvola tricuspide.
Quando la traiettoria istologica del sistema di conduzione è seguita verso il fascio penetrante di His, quest’ultimo è visto girare verso sinistra in molti cuori umani, ed emergere sulla cresta muscolare del setto interventricolare. Circondato dal tessuto connettivo del CFB, la lunghezza del fascio di His può variare prima di dividersi nei rami sinistro e destro del fascio. Il primo ramo si estende a cascata sul lato sinistro del setto interventricolare (Figura 5a e c). La divisione del fascio di His assomiglia a un fantino accovacciato sopra la cresta muscolare del setto interventricolare (Figura 5a). Tuttavia, a volte è deviata verso sinistra (Figura 5c). Quando questo accade, il ramo destro entra all’interno della muscolatura del setto (Figura 5b), comparendo nel ventricolo destro in associazione con l’inserzione del muscolo papillare mediale.
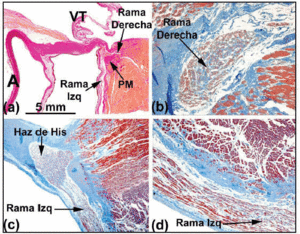
Fig. 5. a: sezione colorata da van Gieson che mostra il fascio di His (cuore umano) sopra la porzione membranosa (MP) del setto interventricolare. b: alla sua origine, il ramo destro in questo cuore è intramiocardico ed è circondato da tessuto connettivo (blu) (colorazione tricromica di Jones, x20). c: la divisione del fascio di His in questo cuore è spostata sul lato sinistro della cresta muscolare del setto interventricolare, e scende longitudinalmente sotto l’endocardio del ventricolo sinistro (tricromia di Jones, x5). d: si noti la guaina connettivale di copertura (blu) della branca sinistra (tricromia di Jones, x10). A indica l’aorta; E, endocardio; TV, valvola tricuspide.
Lungo i loro corsi prossimali, i rami del fascio destro e sinistro sono coperti da una lamina fibrosa (Figure 5b e d). Come ha mostrato Tawara2 (Figura 6a), nell’uomo il ramo sinistro è tipicamente diviso in tre fascicoli con ampia intercomunicazione. Questi fascicoli si ramificano nell’apice ventricolare e si estendono all’interno dei due muscoli papillari della valvola mitrale, ma anche indietro lungo le pareti ventricolari verso la base cardiaca. Più distalmente, nell’apice dei ventricoli del cuore umano, diventa quasi impossibile rintracciare le ramificazioni delle fibre di Purkinje poiché queste perdono il loro mantello fibroso e assomigliano molto al miocardio funzionante.
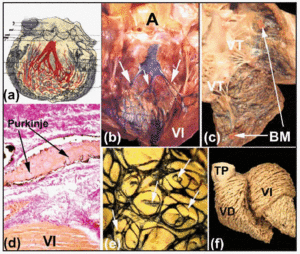
Fig. 6. a: schema di Tawara che mostra la disposizione trifascicolare del ramo bundle sinistro nell’uomo. b e c: un cuore fresco di vitello in cui i ventricoli destro e sinistro sono stati aperti. Iniezioni subendocardiche di inchiostro di china rivelano i rami del fascio destro e sinistro e la rete di Purkinje. Si notino in B i tre fascicoli della branca sinistra del fascio (frecce), e in C la banda moderatrice (MB). d: sezione di un cuore di vitello (colorazione di van Gieson, x100) ottenuta dopo aver iniettato inchiostro di china nella rete del Purkinje), che è avvolta alla sua origine da tessuto connettivo (rosso). e: disposizione subendocardica della rete del Purkinje nel ventricolo sinistro di un vitello. Si noti la disposizione ellittica della rete e le propaggini dai bordi che penetrano nel miocardio (frecce). f: dissezione delle fibre muscolari ventricolari di un cuore umano adulto. Si noti la differenza di disposizione tra gli strati mediale e profondo del ventricolo sinistro. A indica l’aorta; PT, tronco polmonare; LV, ventricolo sinistro; LV, ventricolo sinistro; TV, valvola tricuspide.
L’iniezione subendoteliale di inchiostro di china è uno dei metodi usati per osservare questi fogli fibrosi e per dimostrare il corso subendocardico dei rami del fascio destro e sinistro e le loro ramificazioni nei cuori degli ungulati (Figure 6b e d). I nostri studi sui cuori di pecora e di vitello mostrano che questi variano un po’ dai cuori umani. I cuori di vitello sono più simili a quelli umani in quanto i fascicoli del ramo sinistro del fascio sono di solito tre e hanno origine nella parte superiore del setto interventricolare (Figura 6b). Tuttavia, i cuori di pecora mostrano solo due fascicoli, e questi appaiono a metà della lunghezza della parete del setto. In entrambi i cuori di pecora e di vitello, piccole trabecole muscolari attraversano la cavità ventricolare – il cosiddetto “falso tendine” – che al loro interno portano le ramificazioni distali dei rami di His verso i muscoli papillari e le pareti ventricolari adiacenti. Sul lato destro del cuore, la fascia moderatrice sia del cuore di pecora che di vitello è più snella di quella dell’uomo, ma al suo interno contiene sempre una propaggine del ramo destro del fascio (Figura 6c).
Nei cuori degli ungulati la rete subendocardica di Purkinje ha una disposizione ellittica, sia nel ventricolo sinistro che in quello destro (Figura 6e). Inoltre, dal suo contorno sorgono rami che penetrano le pareti ventricolari, portando a nuovi rami o anastami con altri rami (Figura 6e). Tuttavia, rami intramurali della rete di Purkinje non sono stati dimostrati nel cuore umano.30
Un punto controverso riguardante la rete di Purkinje è l’esistenza di cellule di transizione tra il miocardio ventricolare funzionante e le fibre di Purkinje.31 Gli studi anatomici e immunoistochimici di Oosthoek et al,30 mostrano che, nei cuori bovini, c’è una zona molto piccola di cellule di transizione dove le fibre di Purkinje perdono la loro copertura di tessuto connettivo. Tuttavia, tali cellule non sono state osservate nel cuore di pecora.32 Quando le fibre di Purkinje perdono la loro copertura di tessuto connettivo, gli impulsi elettrici passano dal CS ai miociti di lavoro dei ventricoli. L’orientamento spaziale delle miofibrille di lavoro nelle pareti del ventricolo determina la natura anisotropa della conduzione ventricolare (Figura 6f).
CONCLUSIONI
Anche se esistono differenze tra le specie, la struttura dei nodi, così come quella del resto del sistema di conduzione AV umano, è simile a quella degli animali da laboratorio comunemente usati. Il nodo SA, la struttura che genera l’impulso cardiaco, è situato ad un estremo dell’atrio destro. Gli impulsi da esso viaggiano posteriormente nelle pareti atriali attraverso un’intricata ma precisa disposizione spaziale di fibre atriali funzionanti fino a raggiungere la fine dell’atrio. A questa estremità, le cellule di transizione del nodo AV ricevono l’impulso e lo ritardano prima della sua trasmissione attraverso il fascio di His. Quest’ultimo attraversa il piano fibroso isolante tra gli atri e i ventricoli, e trasmette l’impulso attraverso due rami (i rami del fascio destro e sinistro) verso i ventricoli corrispondenti. Ognuno di questi rami è isolato da una guaina connettiva di miociti ventricolari funzionanti. Questa disposizione permette il contatto tra i miociti specializzati e funzionanti solo alle ramificazioni distali del fascio di His. In questo modo, il sistema di conduzione AV, ampiamente descritto da Tawara2 quasi 100 anni fa, è strutturato per dare ordine alla trasmissione degli impulsi cardiaci. Conoscere la struttura e la posizione del tessuto conduttivo specifico all’interno del cuore potrebbe aiutare a fornire soluzioni a diversi disturbi del ritmo cardiaco.
Leave a Reply