8.3: Gas e pressione
Obiettivi di apprendimento
- Descrivere la fase gassosa.
La fase gassosa è unica tra i tre stati della materia in quanto ci sono alcuni semplici modelli che possiamo usare per prevedere il comportamento fisico di tutti i gas, indipendentemente dalla loro identità. Non possiamo farlo per gli stati solido e liquido. Infatti, lo sviluppo di questa comprensione del comportamento dei gas rappresenta il punto di divisione storico tra l’alchimia e la chimica moderna. I primi progressi nella comprensione del comportamento dei gas furono fatti a metà del 1600 da Robert Boyle, uno scienziato inglese che fondò la Royal Society (una delle organizzazioni scientifiche più antiche del mondo).
Come è possibile modellare tutti i gas indipendentemente dalla loro identità chimica? La risposta è in un gruppo di affermazioni chiamate teoria cinetica dei gas:
- I gas sono composti da minuscole particelle separate da grandi distanze.
- Le particelle di gas sono costantemente in movimento, subendo collisioni con altre particelle di gas e le pareti del loro contenitore.
- La velocità delle particelle di gas è legata alla temperatura di un gas.
- Le particelle di gas non sperimentano alcuna forza di attrazione o repulsione tra di loro.
Hai notato che nessuna di queste affermazioni riguarda l’identità del gas? Questo significa che tutti i gas dovrebbero comportarsi in modo simile. Un gas che segue perfettamente queste affermazioni è chiamato gas ideale. La maggior parte dei gas mostrano leggere deviazioni da queste affermazioni e sono chiamati gas reali. Tuttavia, l’esistenza dei gas reali non diminuisce l’importanza della teoria cinetica dei gas.
Una delle affermazioni della teoria cinetica menziona le collisioni. Poiché le particelle di gas sono costantemente in movimento, sono anche costantemente in collisione tra loro e con le pareti del loro contenitore. Ci sono forze coinvolte quando le particelle di gas rimbalzano sulle pareti del contenitore (Figura \(\PageIndex{1}\)). La forza generata dalle particelle di gas divisa per l’area delle pareti del contenitore produce la pressione. La pressione è una proprietà che possiamo misurare per un gas, ma tipicamente non consideriamo la pressione per solidi o liquidi.
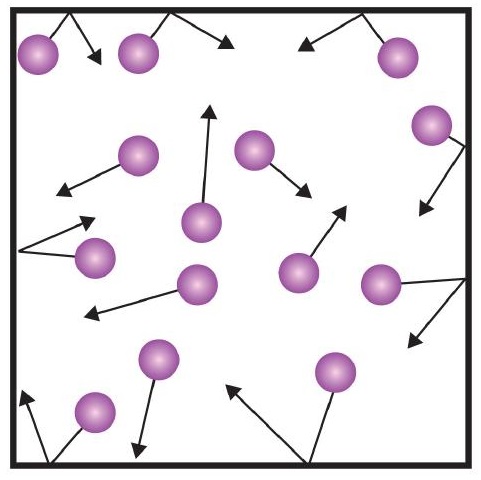
L’unità di base della pressione è il newton per metro quadro (N/m2). Questa unità combinata è ridefinita come pascal (Pa). Un pascal non è una grande quantità di pressione. Un’unità di pressione più utile è il bar, che è 100.000 Pa (1 bar = 100.000 Pa). Altre unità di pressione comuni sono l’atmosfera (atm), che è stata originariamente definita come la pressione media dell’atmosfera terrestre al livello del mare; e mmHg (millimetri di mercurio), che è la pressione generata da una colonna di mercurio alta 1 mm. L’unità millimetri di mercurio è anche chiamata torr, dal nome dello scienziato italiano Evangelista Torricelli, che inventò il barometro a metà del 1600. Una definizione più precisa di atmosfera, in termini di torr, è che ci sono esattamente 760 torr in 1 atm. Un bar equivale a 1,01325 atm. Date tutte le relazioni tra queste unità di pressione, la capacità di convertire da un’unità di pressione all’altra è un’abilità utile.
Esempio \(\PageIndex{1}): Conversione di pressioni
Scrivere un fattore di conversione per determinare quante atmosfere ci sono in 1.547 mmHg.
Soluzione
Perché 1 mmHg è uguale a 1 torr, la pressione data è anche uguale a 1.547 torr. Poiché ci sono 760 torr in 1 atm, possiamo usare questo fattore di conversione per fare la conversione matematica:
(\mathrm{1,547\: torr\times \dfrac{1\: atm}{760\: torr}=2.04\: atm})
Nota come le unità torr si annullano algebricamente.
Esercitazione \(\PageIndex{1}}): Conversione delle pressioni
Scrivi un fattore di conversione per determinare quanti millimetri di mercurio ci sono in 9,65 atm.
Risposta
\(\mathrm{9,65\: atm\times \dfrac{760\: mm Hg}{1\: atm}=7,334 \: mm Hg}\).
La teoria cinetica afferma anche che non c’è interazione tra le singole particelle di gas. Anche se sappiamo che ci sono, infatti, interazioni intermolecolari nei gas reali, la teoria cinetica assume che le particelle di gas sono così lontane tra loro che le singole particelle non si “sentono”. Quindi, possiamo trattare le particelle di gas come minuscoli pezzi di materia la cui identità non è importante per certe proprietà fisiche.
Esercizio di ripasso dei concetti
-
Cos’è la pressione, e quali unità usiamo per esprimerla?
Risposta
-
La pressione è la forza per unità di superficie; le sue unità possono essere pascal, torr, millimetri di mercurio o atmosfere.
Presa di coscienza
- La fase gassosa ha certe proprietà generali caratteristiche di quella fase.
Esercizi
-
Qual è la teoria cinetica dei gas?
-
Secondo la teoria cinetica dei gas, le singole particelle di gas sono (sempre, spesso, mai) in movimento.
-
Perché un gas esercita pressione?
-
Perché la teoria cinetica dei gas ci permette di presumere che tutti i gas abbiano un comportamento simile? 1 mmHg, 1 Pa, e 1 atm.
-
Quale unità di pressione è più grande – il torr o l’atmosfera?
-
Quanti torr ci sono in 1.56 atm?
-
Convertire 760 torr in pascal.
-
La pressione del sangue è espressa in millimetri di mercurio. Quale sarebbe la pressione sanguigna in atmosfere se la pressione sistolica di un paziente è 120 mmHg e la pressione diastolica è 82 mmHg? (In medicina, tale pressione sanguigna sarebbe riportata come “120/82”, parlato come “centoventi su ottantadue.”)
-
Nelle previsioni del tempo, la pressione barometrica è espressa in pollici di mercurio (in. Hg), dove ci sono esattamente 25,4 mmHg in ogni 1 in. Hg. Qual è la pressione barometrica in millimetri di mercurio se la pressione barometrica è riportata come 30,21 in. Hg?
Risposte
-
I gas sono composti da piccole particelle separate da grandi distanze. Le particelle di gas sono costantemente in movimento, subendo collisioni con altre particelle di gas e con le pareti del loro contenitore. La velocità delle particelle di gas è legata alla temperatura di un gas. Le particelle di gas non sperimentano alcuna forza di attrazione o repulsione tra di loro.
-
Un gas esercita pressione quando le sue particelle rimbalzano sulle pareti del suo contenitore.
-
1 Pa, 1 mmHg, e 1 atm
-
1.190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
Leave a Reply