Infektion mit Burkholderia cepacia complex in einer Abteilung für Erwachsene mit zystischer Fibrose in Madrid | Enfermedades Infecciosas y Microbiología Clínica
Einführung
Burkholderia cepacia complex (BCC) hat sich aufgrund des Risikos des Cepacia-Syndroms (einer tödlichen nekrotisierenden Lungenentzündung mit Bakteriämie) als bedeutender Krankheitserreger bei Patienten mit zystischer Fibrose (CF) herausgestellt, der angeborenen Multiresistenz des Organismus gegenüber Antibiotika und der Übertragbarkeit von Bakterienstämmen zwischen Patienten durch soziale Kontakte.1 Enger und längerer Kontakt zwischen Mukoviszidose-Patienten und die gemeinsame Nutzung von Verneblern erleichtern den Erwerb und die Übertragung von BCC-Bakterien.2,3 Es ist erwiesen, dass der Erwerb von BCC-Bakterien mit einem Krankenhausaufenthalt und einer Kreuzinfektion durch sozialen Kontakt mit Mukoviszidose verbunden ist.
Die Taxonomie der Gattung Burkholderia wurde in den letzten Jahrzehnten mehrfach überarbeitet. Mitte der 1990er Jahre wurde nachgewiesen, dass „B. cepacia“-Stämme zu mindestens fünf verschiedenen Arten gehören, die zusammen als B. cepacia-Komplex bezeichnet wurden.4 Weitere taxonomische Analysen ergaben, dass innerhalb des BCC sogar noch mehr Arten vorhanden waren, und derzeit sind 17 Arten des B. cepacia-Komplexes beschrieben4-7: B. cepacia, B. multivorans, B. cenocepacia, B. stabilis, B. vietanmiensis, B. dolosa, B. ambifaria, B. anthina, B. pyrrocinia, B. ubonensis, B. latens, B. diffusa, B. arboris, B. seminalis, B. metallica, B. lata und B. contaminans.8
Abgesehen von B. ubonensis wurden alle diese Arten aus dem Sputum von Mukoviszidose-Patienten isoliert,6,7 wobei B. cenocepacia und B. multivorans vorherrschend sind.9
B. cenocepacia wird in vier Subtypen unterteilt (IIIa, IIIb, IIIc und IIId), die durch vier Allele des Gens recA kodiert werden, und es gibt Unterschiede in der Häufigkeit und Virulenz der Stämme. Darüber hinaus gilt B. cenocepacia als einer der schwerwiegendsten Krankheitserreger, da er häufig mit einer reduzierten Überlebensrate und dem höchsten Risiko für die Entwicklung eines tödlichen Cepacia-Syndroms verbunden ist.10 BCC-Spezies sind von Natur aus gegen viele Antibiotika wie Aminoglykoside und Polymyxin B resistent und erfordern häufig eine Kombinationstherapie zur Unterdrückung der Infektion bei CF.11
Infektionen mit BCC-Bakterien bei Mukoviszidose-Patienten sind häufig mit einer erhöhten Morbidität und Mortalität verbunden, und die angeborene Resistenz dieser Organismen gegen ein breites Spektrum von Antibiotika erschwert die Behandlung infizierter Patienten.12,13 Diese Resistenz wird durch verschiedene Mechanismen verursacht, darunter eine eingeschränkte Permeabilität, Veränderungen der Lipopolysaccharidstruktur und das Vorhandensein mehrerer Multidrug-Efflux-Pumpen, induzierbarer chromosomaler Beta-Lactamasen und veränderter Penicillin-bindender Proteine. Darüber hinaus wurde für mehrere B. cepacia-Komplex-Stämme eine In-vitro-Biofilmbildung beschrieben, die möglicherweise zu ihrer Fähigkeit beiträgt, in der Mukoviszidose-Lungenumgebung zu überleben, indem sie einen zusätzlichen Schutz gegen Antibiotika bietet.14-16
Die Behandlung von BCC-infizierten Patienten sollte vorzugsweise auf den Ergebnissen von Empfindlichkeitstests basieren und umfasst häufig eine Kombinationstherapie mit zwei oder drei Antibiotika, die eine synergistische Wirkung zeigen.12,17,18In-vitro-Empfindlichkeitsstudien an BCC-Stämmen zeigen, dass Breakpoint-Konzentrationen von Ceftazidim, Ciprofloxacin, Meropenem, Tetracyclinen oder hohen Tobramycin-Dosen eine bakteriostatische Wirkung gegen einen beträchtlichen Teil dieser Stämme haben.19-21 Daher werden diese Antibiotika häufig zur Behandlung von BCC-infizierten Mukoviszidose-Patienten eingesetzt. Darüber hinaus wird Cotrimoxazol immer noch häufig zur Behandlung chronischer BCC-Infektionen eingesetzt, obwohl Empfindlichkeitstests dieser ergänzenden Antibiotika eine geringe Aktivität gegen viele BCC-Stämme ergaben.18,22
Ziel dieser Studie war es, die isolierten BCC-Stämme und ihre Empfindlichkeit zu untersuchen und die Auswirkungen auf die Klinik zu analysieren.
Methoden
Das Sputum von Mukoviszidose-Patienten wurde auf endgültige BCC-Isolate untersucht, und zwar in der Mukoviszidose-Abteilung für Erwachsene im Krankenhaus La Princesa, die seit März 1997 besteht. Diese Proben wurden in der mikrobiologischen Abteilung nach dem Standardverfahren23 aufbereitet; wir verwendeten ein spezifisches Selektivmedium und einen quantitativen Streifen, wobei wir das herkömmliche Verfahren der seriellen Verdünnung für die Probe verwendeten. Das Sputum wurde vor der Kultivierung mit N-Acetylcystein homogenisiert. In unserem Labor wurden folgende Nährböden verwendet: Blutagar, Bacitracin-Schokoladen-Agar, Manitol-Salz-Agar, MacConkey-Agar, Sabouraud-Cloranfenicol-Agar und ein selektiver Nährboden für B. cepacia namens BCSA (Biomèrieux). Die Inkubationszeit der Platten betrug 3 bis 5 Tage bei 35°C. Bacitracin-Schokoladen-Agar wurde in CO2-Atmosphäre bebrütet.
Die vorläufige Identifizierung der BCC-Stämme wurde mit MicroScan (Siemens) und Api 20 NE (Biomerieux) durchgeführt. Diese Verfahren wurden gemäß den Empfehlungen des Herstellers durchgeführt.24
Die Stämme wurden anschließend an das Centro Nacional de Microbiología (Majadahonda, Madrid) zur Bestätigung und Bestimmung der Spezies und Genospezies geschickt. Für diese Studie wurden die folgenden Methoden angewandt: Api 20 NE (biomerieux, Marcy l’Etoile) und GN2 Microplate (BIOLOG, Hayward, CA) sowie molekulare Methoden. Alle Verfahren wurden gemäß den Empfehlungen des Herstellers durchgeführt.
Chromosomale DNA-Extraktion
Die DNA-Extraktion wurde mit dem kommerziellen Kit QIAamp DNA Mini Kit (QIAGEN, GmbH, Hilden, Deutschland) gemäß den Anweisungen des Herstellers durchgeführt.
PCR-Analyse
Die Amplifikation der Gene erfolgte in einem Endvolumen von 25 μl unter Verwendung des Kits PuReTaq Ready-To-Go PCR Beads (Amersham Biosciences, Buckinghamshire, UK), das 5 μl der extrahierten DNA und 10 pmol jedes Primers enthielt: fD1 und rP225 für 16S rDNA sowie BCR1 und BCR426 für recA. Die thermischen Zyklen wurden in einem TaKaRa PCR Thermal Cycler v. III mod TP600 (TAKARA BIO Inc., Otsu, Shiga) unter den folgenden Bedingungen für 16S rDNA durchgeführt: 94°C für 5min für den ersten Zyklus, 35 Zyklen von 15s bei 94°C, Annealing für 15s bei 55°C und Verlängerung bei 72°C für 1min und 50s. Die Bedingungen für die Amplifikation von recA waren wie folgt: 94°C für 5min, 30 Zyklen von 30s bei 94°C, Annealing für 45s bei 55°C und Verlängerung bei 72°C für 10min.
Wir visualisierten 2μl jedes PCR-Produkts durch Agarosegel-Elektrophorese mit einer auf 1,5% eingestellten Agarosekonzentration und unter Verwendung von 1× TAE-Puffer. Auf allen Gelen wurden Molekülgrößenmarker angebracht: Marker X 0.07-12.2kbp (Roche Applied Sciences, Mannheim, Deutschland) und GeneRuler 100bp DNA Ladder (Fermentas GmbH, St. Leon-Rot, Deutschland) für 16s rDNA bzw. recA Produkte.
Stämme, die als B. cenocepacia identifiziert wurden, wurden einer PCR-Methode mit spezifischen Primern für die RecA-IIIA-Gruppe (BCRG3A1 und BCRG3A2) und RecA-IIIB (BCRG3B1 und BCRG3B2) unter zuvor beschriebenen Bedingungen unterzogen.24
Zehn μl der PCR-Produkte wurden durch Agarosegel-Elektrophorese unter den gleichen Bedingungen wie oben beschrieben sichtbar gemacht.
Nukleotidsequenzanalyse
16s rDNA- und recA-PCR-Produkte wurden unter Verwendung von fD1 und rP2 bzw. BCR1 als Primer sequenziert. Die Sequenzierungsreaktionen wurden mit Big Dye Terminator v 3.1 (Applied Biosystem, USA) in einem Endvolumen von 10 µl gemäß den Anweisungen des Herstellers vorbereitet und mit dem Kapillarelektrophorese-System ABI PRISM 3100 genetic analyzer (Applied Biosystem, USA) analysiert. Die Sequenzen wurden mit der Software SeqMan 3.61 (DNA Star, Inc, Madison, WI, USA) zusammengesetzt. Die Analyse umfasste auch die Verwendung des Basic Local Alignment Search Tool (BLAST: www.ncbi.nlm.nih.gov), um die korrekte Genidentität festzustellen.
PFGE-Analyse
Die Verwandtschaft der Stämme wurde durch Pulsed-Field-Gel-Elektrophorese (PFGE) analysiert. Die Vorbereitung der Plugs, die Lyse, das Waschen der Zellen und der Restriktionsverdau wurden wie zuvor beschrieben25,26 mit leichten Unterschieden durchgeführt. Es wurde das Restriktionsenzym XbaI (40U, Fermentas GmbH, St. Leon-Rot, Deutschland) verwendet. PFGE wurde nach dem für Stenotrophomonas maltophilia von Valdezate et al.27 beschriebenen Protokoll und unter Verwendung des DRIII Chef Systems (Bio-Rad Laboratories, Hercules, USA) und Lambda-Phagen-Konkatemeren (Biolabs, New England, UK) als Molekulargewichtsmarker durchgeführt. Die Bilder wurden mit der Software Quantity One v. 4.6.1 (BioRad) erstellt. Die Analyse der Bilder erfolgte visuell, und Isolate wurden als genotypisch nicht unterscheidbar betrachtet, wenn sie ein identisches Bandenmuster aufwiesen.
Die Antibiotika-Empfindlichkeit wurde durch Mikrodilution mit MicroScan und gleichzeitige Scheibendiffusion bestimmt. Beide Methoden galten als CLSI-Bruchpunkte.28 Für Ciprofloxacin und Imipenem wurden die Bruchpunkte von Levofloxacin bzw. Meropenem verwendet. Die folgenden Antibiotika wurden untersucht: Ceftazidim, Ciprofloxacin, Levofloxacin, Cotrimoxazol, Minocyclin, Imipenem und Meropenem.
Patienten mit BCC wurden mit folgenden Variablen untersucht: Alter (zu Beginn und gegenwärtig), Geschlecht, Gewicht (zu Beginn und gegenwärtig), Genmutation Cystic Fibrosis Transmembrana Regulator, Entwicklung der Atmungsfunktion, die durch den Prozentsatz gemäß dem theoretischen Wert des Volumens, das in der ersten Sekunde ausgeatmet wird (FEV1), seit ihrer ersten Isolierung bestimmt wurde, sowie die radiologischen Punktierungen von Brasfield und Kliniken von Shawchman zu Beginn der BCC Isolierung und gegenwärtig.
Der Brasfield-Score wurde mit 0-5 (von niedrig bis hoch) entsprechend den radiologischen Zeichen bewertet: Lufteinschlüsse, lineare Schatten, knotige zystische Läsionen, segmentale oder lobäre Konsolidierung und der Gesamteindruck des Schweregrads. Die ermittelte Gesamtpunktzahl wurde auf 25 abgezogen. Der niedrigste erreichte Wert entsprach einem schwereren radiologischen Befund. Die Röntgenuntersuchung des Brustkorbs und der entsprechende Brasfield-Score wurden jedes Jahr durchgeführt.
Der klinische Score nach Shwachman bewertete 4 Punkte mit einer maximalen Punktzahl von jeweils 25: allgemeine Aktivität, körperliche Untersuchung, Wachstum und Ernährung sowie Röntgenaufnahmen des Brustkorbs. Die ideale Punktzahl war 100, und der Status der Patienten wurde entsprechend der Punktzahl klassifiziert: ausgezeichnet (86-100 Punkte), gut (71-85 Punkte), leicht (56-70 Punkte), mäßig (40-55 Punkte) oder schwerwiegend (weniger als oder gleich 40).
Ergebnisse
BCC wurde bei 12 von 70 erwachsenen Mukoviszidose-Patienten (17,1%) innerhalb von 10 Jahren isoliert. Zwei der Patienten hatten eine Lungentransplantation, einer von ihnen starb nach der Transplantation und bei dem anderen wurde BCC im Jahr 2005 vor der Transplantation im Jahr 2011 ausgerottet. Bei einem anderen Patienten wurde das BCC im Jahr 2009 ausgerottet. Diese Patienten wurden nur einige Monate lang untersucht, so dass die klinische Entwicklung nicht erfasst wurde. B. cenocepacia wurde bei 4 Patienten (33,3 %) isoliert, B. contaminans bei 3 Patienten (25 %), B. stabilis bei 2 Patienten (16,7 %), B. vietnamiensis bei 2 Patienten (16,7 %), B. cepacia bei einem Patienten (8,3 %), B. multivorans bei einem Patienten (8,3 %) und B. lata bei einem Patienten (8,3 %). Bei B. cenocepacia wurde der Subtyp IIIa bei zwei von vier Patienten (50 %) und der Subtyp IIIb bei den anderen beiden Patienten (50 %) festgestellt. Ein Patient hatte zunächst B. cenocepacia und dann B. lata. Ein anderer Patient hatte zunächst B. stabilis und dann B. contaminans. In unserer Studie hatten 50 % der Patienten mit BCC Staphylococcus aureus-Stämme (Tabelle 1).
Isolationen der verschiedenen Spezies des Burkholderia cepacia-Komplexes und Co-Besiedlung mit anderen CF-Erregern bei chronischen Patienten.
| Patient | Isolation 1 | Isolation 2 | Kokolonisation | Beobachtungen |
| 1 | B. contaminans | H. influenzae | ||
| 2 | B. cepacia | P. aeruginosa | ||
| 3 | B. cenocepacia (sub. IIIa) | – | ||
| 4 | B. multivorans | S. aureusH. influenzae | ||
| 5 | B. vietnamiensis | S. aureus | ||
| 6 | B. stabilis | S. aureus | ||
| 7 | B. cenocepacia (sub. IIIb) | S. aureus | ||
| 8 | B. cenocepacia (sub. IIIb) | B. lata | P. aeruginosa | Eradiziert |
| 9 | B. stabilis | B. contaminans | S. aureus | |
| 10 | B. cenocepacia (sub IIIa) | – | Transplantiert und gestorben | |
| 11 | B. vietnamiensis | S. aureus | Ausgetötet und transplantiert | |
| 12 | B. Kontaminanten | – |
Die PFGE-Analyse zeigt, dass bei jedem CF-Patienten derselbe Stamm isoliert wurde, der sich jedoch von Patient zu Patient unterschied, was bestätigt, dass es keine Kreuzübertragung gab.
90 % der BCC waren empfindlich gegenüber Meropenem, 80 % gegenüber Cotrimoxazol, 60 % gegenüber Minocyclin, 50 % gegenüber Ceftazidim und 40 % gegenüber Levofloxacin, 20 % gegenüber Ciprofloxacin und 10 % gegenüber Imipenem.
Die 50 % der Mukoviszidose-Patienten waren männlich, und das Durchschnittsalter dieser Patienten bei der ersten Isolierung von BCC betrug 24,4 Jahre (SD: 7,71). 41,7 % der Patienten hatten eine F508del/andere Mutation, 33,3 % eine F508del/F508-Mutation und 25 % eine andere/andere Mutation.
Zu Beginn wurde der Brasfield- und Shwachman-Score für alle in diese Studie einbezogenen Patienten berechnet, und die durchschnittliche Punktzahl betrug 18,6 und 82,3. Der aktuelle Brasfield- und Shwachman-Score wird jedoch mit kolonisierten Patienten durchgeführt. Die durchschnittliche Interpunktion lag bei 21,1 und 81. Nur 1 Patient hatte Diabetes und 6 Patienten hatten eine Pankreasinsuffizienz. Tabelle 2 zeigt die klinischen Merkmale der CF-Patienten, die BCC hatten.
Klinische Merkmale von Mukoviszidosepatienten.
| Geschlechtshäufigkeit (%) | |
| Männlich | 6 (50%) |
| Weiblich | 6 (50%) |
| Altersdurchschnitt (SD) | |
| Primärinfektion (n=12) | 24.4 Jahre (7,71) |
| Aktuell (n=9) | 29 Jahre (8,04) |
| Gewichtsdurchschnitt (SD) | |
| Primärinfektion (n=12) | 57.9kg (8.5) |
| Aktuell (n=9) | 58.7kg (8.6) |
| Mutationshäufigkeit (%) | |
| F508del/F508del (n=12) | 4 (33. 3%) |
| F508del/andere (n=12) | 5 (41.7%) |
| Andere/Sonstiges (n=12) | 3 (25%) |
| Brasfield-Satzdurchschnitt | |
| Primärinfektion (n=12) | 18.6 |
| Aktuell (n=9) | 21.1 |
| Shwachman Interpunktion Durchschnitt | |
| Primäre Infektion (n=12) | 82.3 |
| Aktuell (n=9) | 81 |
| Diabetesfrequenz (%) | |
| Aktuell (n=9) | 0 (0%) |
| Pankreasinsuf. Häufigkeit (%) | |
| Aktuell (n=9) | 6 (66.6%) |
Abb. 1 zeigt die Entwicklung der Lungenfunktion (%FEV1) der Patienten, die mehr als eine Isolation von BCC hatten.
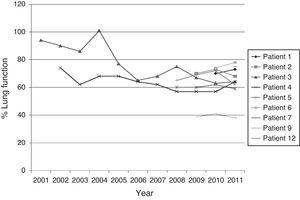
Entwicklung der Lungenfunktion der chronischen CF-Patienten ab der ersten Isolierung von BCC im Sputum.
Diskussion
Es gibt nur wenige Studien zur klinischen Entwicklung von Patienten mit einer isolierten BCC-Spezies, und es besteht die allgemeine Vorstellung, dass die B. cenocepacia-Spezies mit einer höheren Morbidität und Mortalität bei CF-Patienten verbunden ist.19 Daher gibt es nicht viele aktuelle Daten über Patienten mit BCC in Spanien. Eine Studie im Hospital Universitario de Cruces zeigt einen Anstieg der Besiedlungshäufigkeit mit BCC.29
Es ist wichtig, dass die Identifizierung von BCC-Spezies in spezialisierten Zentren durchgeführt wird, da fakultative Bakterien dazu beitragen, eine genaue Überwachung dieser Patienten, die mit diesen Spezies besiedelt sind, zu gewährleisten, da sie sich negativ entwickeln können.
Eine von Van Pelt et al.30 durchgeführte Studie zeigt, dass API 20 NE genauer war als MicroScan. 90 % der Isolate wurden mit API 20 NE korrekt identifiziert, gegenüber 68 % mit MicroScan. Sie empfehlen die Verwendung von BCSA-Platten für die erste Isolierung von B. cepacia direkt aus klinischem Material. Die Sensitivität dieser Wachstumsmedien schien ausgezeichnet zu sein (96 %); die Spezifität lag nicht bei 100 %. Auffallend war, dass die Genauigkeit der automatisierten Assays, wie z. B. MicroScan, unzureichend war. Das wichtigste Ergebnis der vorliegenden Analyse ist die Tatsache, dass die molekulare Identifizierung durch PCR-RFLP-Analyse den biochemischen und mikrobiologischen Verfahren zur Speziesidentifizierung überlegen ist, obwohl betont werden sollte, dass die mit API20 NE erzielten Ergebnisse zufriedenstellend waren.30
In unserer Studie wurden B. cenocepacia, B. contaminans, B. vietnamiensis, B. stabilis, B. multivorans, B. cepacia und B. lata aus den Atemwegssekreten von 12 untersuchten Mukoviszidose-Patienten isoliert, und B. cenocepacia war die häufigste Spezies, wie die meisten in der europäischen Literatur beschriebenen Daten von Mukoviszidose-Patienten.19 Diese Entdeckung stimmt jedoch nicht mit einer portugiesischen Studie (Susana Correia et cols) überein, in der die häufigsten Spezies B. cepacia 57 % und B. stabilis 13 % waren. Möglicherweise ist dies auf die Verwendung unsteriler Kochsalzlösungen zurückzuführen, die von Natur aus mit B. cepacia kontaminiert sind.19 Diese kontaminierten Lösungen wurden von Infarmed bei einer mikrobiologischen Routineuntersuchung entdeckt.19 In unserer Studie wurden B. cepacia und B. stabilis in einem geringeren Anteil isoliert als in anderen Studien in Europa und Amerika.19
Bei der Isolierung von B. cenocepacia war der Anteil der B. cenocepacia Subtypen IIIa und IIIb gleich groß.
Einer der Patienten hatte B. cenocepacia als erste Isolierung, B. lata als zweite Isolierung und wurde dann ausgemerzt. Ein anderer Patient hatte B. vietnamiensis im Jahr 2004, das ausgerottet wurde, und bei ihm wurde 2011 eine Lungentransplantation durchgeführt, und ein weiterer Patient wurde 2004 mit B. cenocepacia Subtyp IIIa isoliert, aber er starb im selben Jahr nach einer Lungentransplantation. Die Überlebenschancen einer Lungentransplantation sind bei Patienten, die mit B. cenocepacia kolonisiert sind, am schlechtesten, so dass einige Transplantationseinheiten die Transplantation in diesem Fall kontraindizieren. Es ist bekannt, dass B. cenocepacia im Vergleich zu B. multivorans eine schlechtere Prognose hat und die Überlebenszeit kürzer ist, wenn sie mit Pseudomonas aeruginosa-Kontrollen verglichen wird.31 Das Cepacia-Syndrom wurde bei beiden Spezies festgestellt.26 Die genaue Pathophysiologie dieses Syndroms ist kaum bekannt, und die genaue Sterblichkeitsrate ist nicht bekannt, obwohl man annimmt, dass sie sich 100 % nähert.32
Unsere Patienten haben niedrige FEV1-Werte. Bei vielen Patienten hatte sich der Zustand bereits vor der BCC-Isolierung durch die Besiedlung mit anderen Krankheitserregern und das Fortschreiten der Krankheit verschlechtert. Bei klinisch stabilen Patienten wurden keine signifikanten Veränderungen der FEV1-Werte und des Ernährungszustands festgestellt. Es gibt Hinweise darauf, dass eine Lungenbesiedlung durch Standardkulturen einige Zeit (bis zu 2 Jahre) nach dem Erwerb von BCC nicht nachgewiesen werden kann.33 Außerdem ist nicht klar, ob es bei intermittierender Isolierung zu einer Neuinfektion durch einen neuen Stamm oder zu einer Rekrudeszenz des ursprünglichen Stammes kommt.20 In den meisten Fällen unserer verschiedenen Isolationen wurde kein Austausch der ursprünglichen BCC-Stämme beobachtet.
Es wurden Fälle registriert, in denen derselbe Stamm (mit demselben Genotyp), der einen Patienten über mehrere Jahre hinweg hartnäckig infiziert hatte, durch eine Antibiotikatherapie ausgerottet wurde oder keinen offensichtlichen Einfluss auf das klinische Bild anderer Patienten hatte. Es ist nicht klar, warum sich die Stämme der verschiedenen BCC-Spezies in ihrer Persistenz, Epidemiologie und ihrem Erregerpotenzial bei Mukoviszidose unterscheiden und warum dieselben Stämme mit sehr unterschiedlichen klinischen Entwicklungen in Verbindung gebracht werden können.19 Es hängt von Faktoren ab, die jedem einzelnen Patienten eigen sind, von der Ko-Besiedlung durch andere Erreger und von anderen Faktoren, die noch identifiziert werden müssen, was die Bedeutung von Studien dieser Art unterstreicht.
Antibiotikaresistenz wird als wichtiger Virulenzfaktor von BCC-Organismen angesehen.14 Obwohl die Therapie in der Regel durch antimikrobielle Empfindlichkeitstests gesteuert wird, wird eine Eradikation von BCC-Organismen selten erreicht.21 Zur Erklärung dieses Misserfolgs wurden mehrere Hypothesen formuliert, darunter unzureichende Antibiotikakonzentrationen oder Inaktivierung des Antibiotikums im Sputum, beeinträchtigte Wirtsabwehr bei CF-Patienten, Biofilmbildung, „Inokulum“-Effekt und In-vivo-Wachstumsrate dieser Organismen.34
Elke et al. berichteten in einer belgischen Studie, dass Meropenem, Minocyclin und Ceftazidim die aktivsten Antibiotika gegen die Isolierung von BCC waren, während Ciprofloxazin und Trimethoprim/Sulfamethoxazol die geringste Aktivität aufwiesen.35 Unsere Studie ergab jedoch, dass Meropenem mit 90 % der Empfindlichkeit am aktivsten war, gefolgt von Trimethoprim/Sulfamethoxazol, Minocyclin und Ceftazidim mit 80 %, 60 % bzw. 50 %. Obwohl BCC-Organismen in der Regel gegen Aminoglykoside resistent sind, hemmten hohe Dosen von Tobramycin die meisten der getesteten Stämme. Vernebeltes Tobramycin, das hohe Spitzenkonzentrationen im Sputum aufweist, wird zunehmend zur Behandlung von Mukoviszidose-Patienten eingesetzt.36-38
Diese höheren Konzentrationen sollten daher bei der Bewertung des Nutzens dieses Antibiotikums berücksichtigt werden.35 Mehrere Berichte bestätigen, dass vernebeltes Tobramycin bei der Behandlung von BCC-infizierten Mukoviszidose-Patienten vielversprechend ist: So beschrieben Weidmann et al.39 kürzlich die vollständige Eradikation von BCC-Organismen aus den Lungen von Mukoviszidose-Patienten durch eine Kombination aus vernebeltem Tobramycin und Amilorid. Außerdem führte eine Kombinationstherapie mit vernebeltem und intravenösem Meropenem und Tobramycin zur erfolgreichen Behandlung einer CF-Patientin, die an einem Cepacia-Syndrom litt, obwohl die Sputumproben dieser Patientin weiterhin positiv für B. cenocepacia waren.39
BCC-Spezies sind von Natur aus gegen viele Antibiotika wie Aminoglykoside und Polymyxin B resistent und erfordern häufig eine Kombinationstherapie, um die Infektion bei CF zu unterdrücken.11 Die Antibiotika Polymyxin, Gentamicin und Vancomycin werden in hohen Konzentrationen in B. cepacia Selective Agar verwendet, einem hochwirksamen Medium für ihre Isolierung aus Mukoviszidose-Sputum.11 Nzula et al.13 verglichen die Antibiotika-Empfindlichkeit von sechs BCC-Arten und kamen zu dem Schluss, dass sie mit Ausnahme der angeborenen Polymyxin-Resistenz sehr variabel war und nicht mit dem taxonomischen Status der untersuchten Isolate zusammenhing. Efflux, die Sekretion von chromosomalen Beta-Laktamasen und die Undurchlässigkeit der äußeren Hülle von BCC-Bakterien wurden mit der Antibiotikaresistenz in Verbindung gebracht.14
Im Gegensatz dazu ist die molekulare Grundlage für die Biozidresistenz von BCC-Bakterien kaum untersucht worden, obwohl diese Organismen mit vielen Kontaminationen in Desinfektionsmitteln und anderen Antiinfektionslösungen in Verbindung gebracht werden.40
Die Aufgabe und damit die Herausforderung bei der Identifizierung von BCC-Spezies für klinische mikrobiologische Routinelaboratorien sind unterschiedlich. Stämme, die auf Selektivmedien isoliert und mit Hilfe kommerzieller Systeme vorläufig als zu den BCC gehörig identifiziert wurden, sollten mit den beschriebenen klassischen biochemischen Tests bestätigt werden.41
Die Früherkennung von BCC ist sowohl für den Mukoviszidose-Patienten als auch für die Mukoviszidose-Gemeinschaft äußerst wichtig. Eine kürzlich durchgeführte Studie5 hat jedoch gezeigt, dass weniger als die Hälfte der befragten US-amerikanischen Zentren „B. cepacia“-spezifische Selektivmedien verwenden oder Kulturen über längere Zeiträume bebrüten, was beides die Ausbeute dieses Organismus verbessert. Der Einsatz dieser modernen Kulturtechniken ist technisch nicht anspruchsvoll und sollte in jedem Mukoviszidose-Zentrum weltweit zum Standard gehören.
In dieser Studie haben wir B. cenocepacia nur bei einem Patienten ausgerottet; ein anderer Patient starb unmittelbar nach der Transplantation, und keiner der beiden Patienten hatte ein Cepacia-Syndrom und erlitt eine wesentliche klinische Verschlechterung, obwohl der Beobachtungszeitraum kurz war, weil sie erst kürzlich BCC erworben hatten.
Die verbesserte Diagnose von Infektionen, die durch Mitglieder der BCC und andere B. cepacia-ähnliche Organismen verursacht werden, wird bei der Interpretation der Ergebnisse klinischer Outcome-Studien helfen und dadurch entscheidende Informationen über die Pathogenität und/oder Übertragbarkeit der betreffenden Stämme liefern.5
Interessenkonflikt
Keiner der Autoren hat einen Interessenkonflikt zu deklarieren.
Leave a Reply