Mi az elektronegativitás?
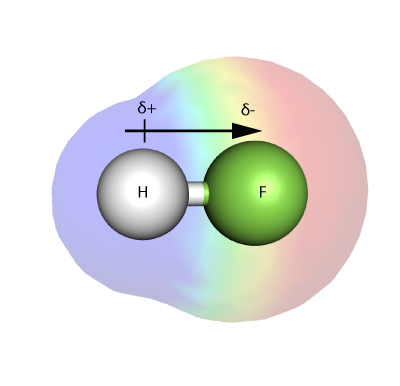
ELEKTRONEGATIVITÁS
Az elektronegativitás azt méri, hogy egy atom – egy molekulában – milyen erősen képes kötésben lévő elektronokat magához vonzani.
Az elektronegativitást befolyásoló tényezők:
1) Az atomszám
Az atomszám az atommagban lévő protonok száma.
Meghatározza az elem kémiai tulajdonságait és helyét a periódusos rendszerben.
Minél magasabb az atomszám, annál erősebb az elektronegativitás.
2) Az atomsugár
A kémiai elem atomsugarát általában az atommag középpontjától a legkülső elektronréteg határáig terjedő távolsággal mérik.
Mennél nagyobb az atomsugár, annál gyengébb az elektronegativitás.
Példa az oxigénatom atomsugarára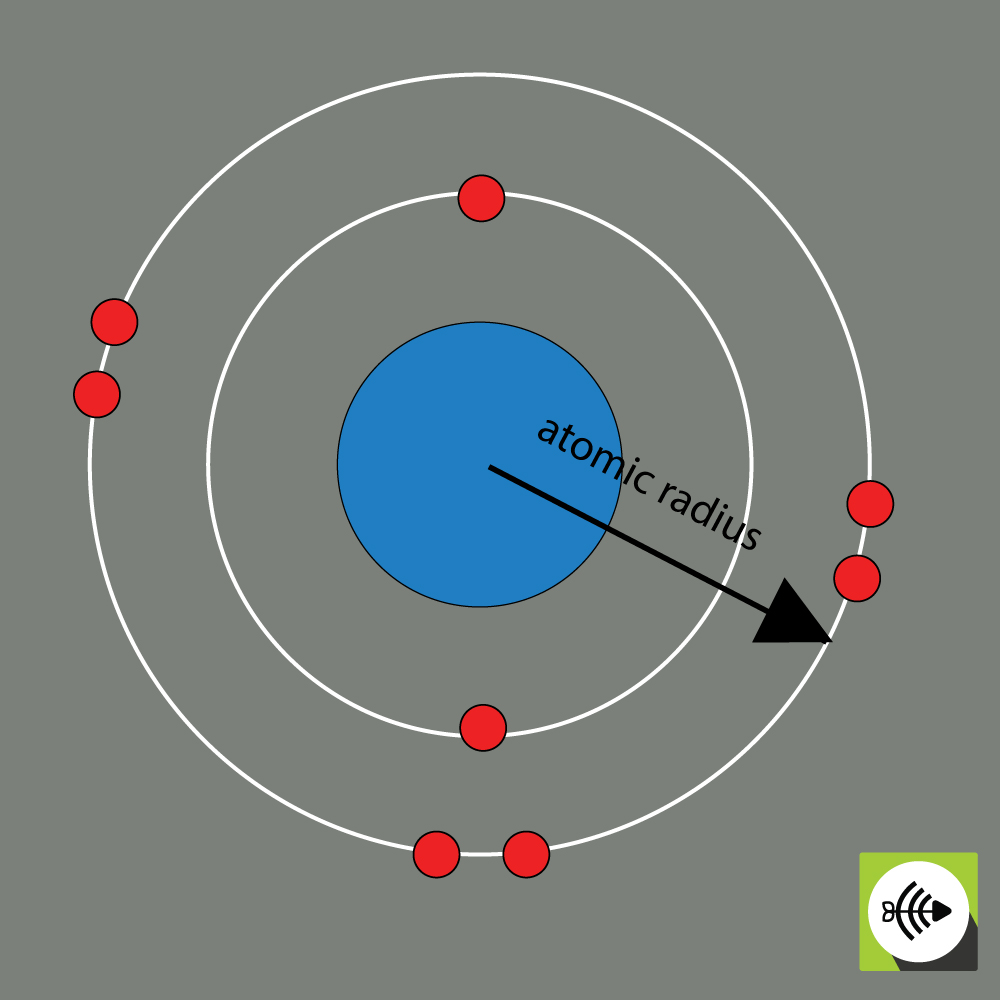
Mivel mérik az elektronegativitást?
Az elektronegativitás legelterjedtebb mérőszáma a Pauling-skála, amelyet a kétszeres Nobel-díjas Linus Pauling tervezett. Az elemek elektronegativitási skálája megmondja, hogy az egyes elemek (egymáshoz képest) milyen erősen képesek magukhoz vonzani a kötőelektronokat. Minél magasabb az elektronegativitási szám, annál inkább igyekszik az atom elektronokat magához vonzani.
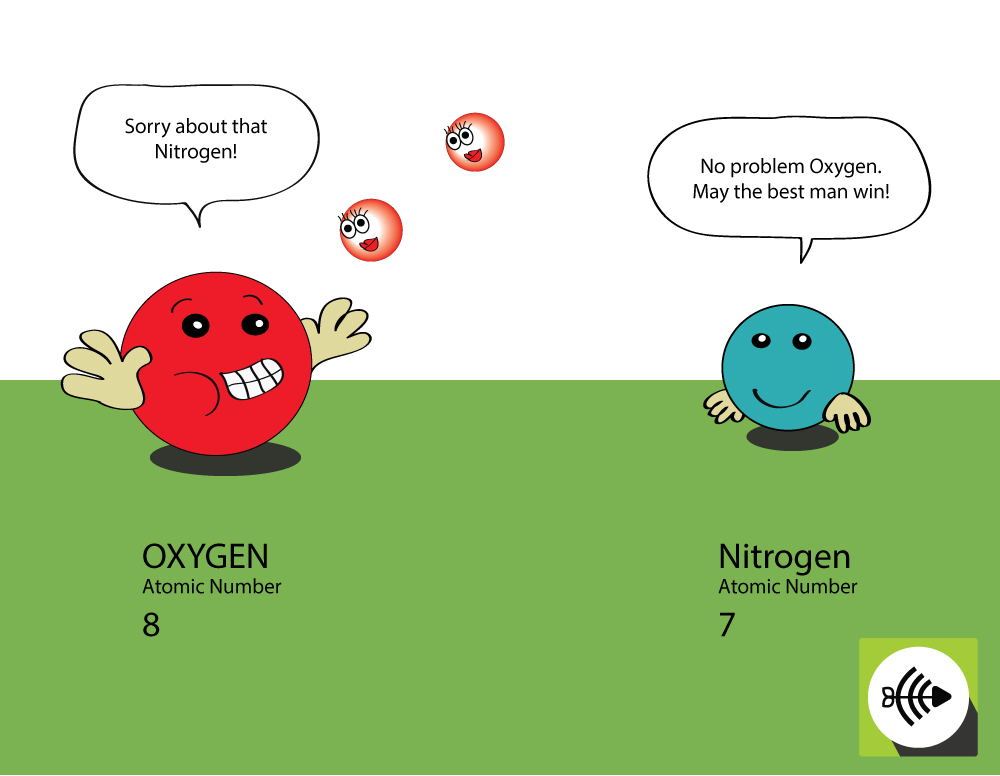
Miért elektronegatívabb az oxigén, mint a nitrogén?
Az oxigénnek magasabb az atomszáma
- Az oxigénnek 8 protonja van az atommagban, míg a nitrogénnek csak 7 van.
- Egy kötő elektronpár nagyobb vonzást érez az oxigén atommagja felől, mint a nitrogéné felől, ezért az oxigén elektronegativitása nagyobb.
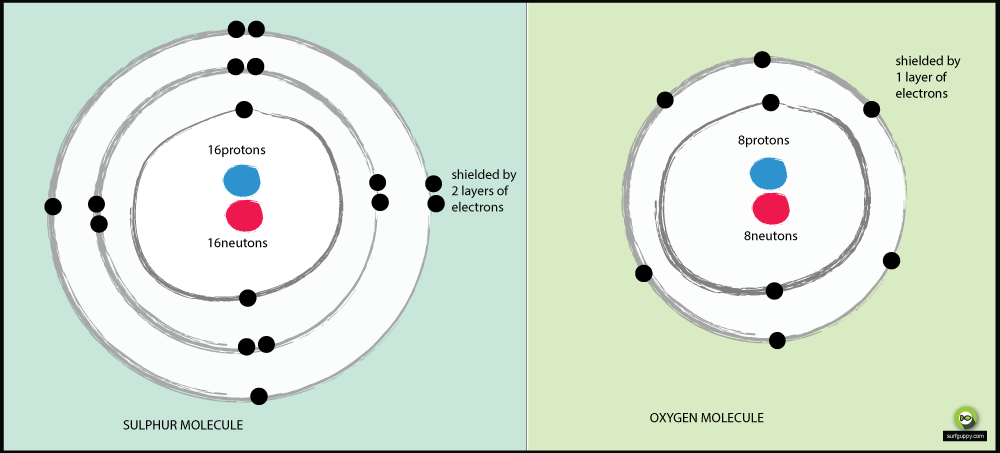
Miért kevésbé elektronegatív a kén, mint az oxigén?
Az okok, amiért az oxigén elektronegatívabb, mint a kén:
- Az oxigénnek 2 energiaszintje van, a kénnek 3
- A kén kötőelektronjai távolabb vannak az atommagtól
- Amikor a kötőelektronok távolabb vannak az atommagtól, kisebb a vonzás az atommag felől
- Az oxigén kötőelektron-párja nagyobb vonzást tapasztal az atommag felől, mint a kén kötőelektronjai
- Az oxigén tehát elektronegatívabb atom
Kérlek, mielőtt folytatnád, olvass utána a valenciaelektronoknak. Valenciaelektronok

A kisebb atomnak nagyobb az elektronegativitása
Elektronegativitási tendenciák a periódusos rendszerben
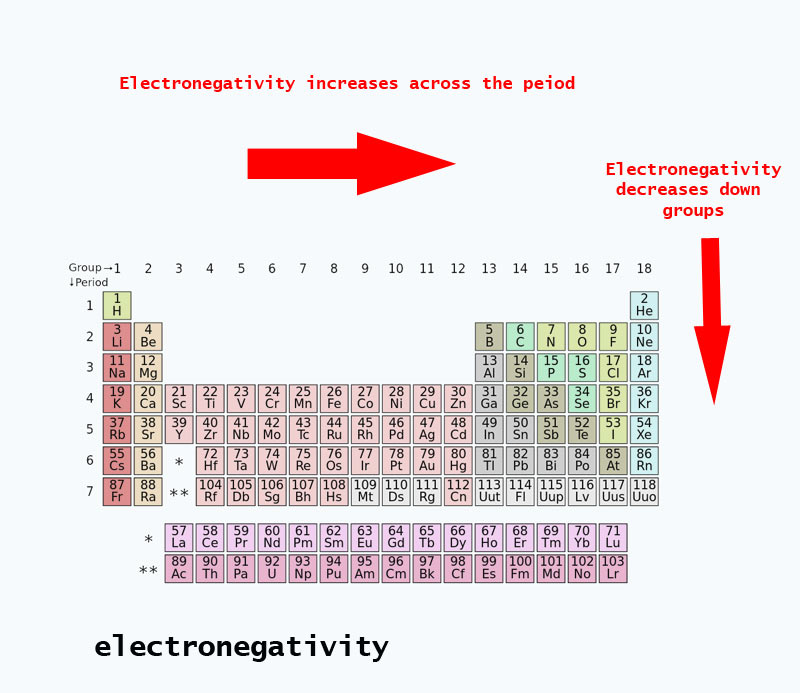
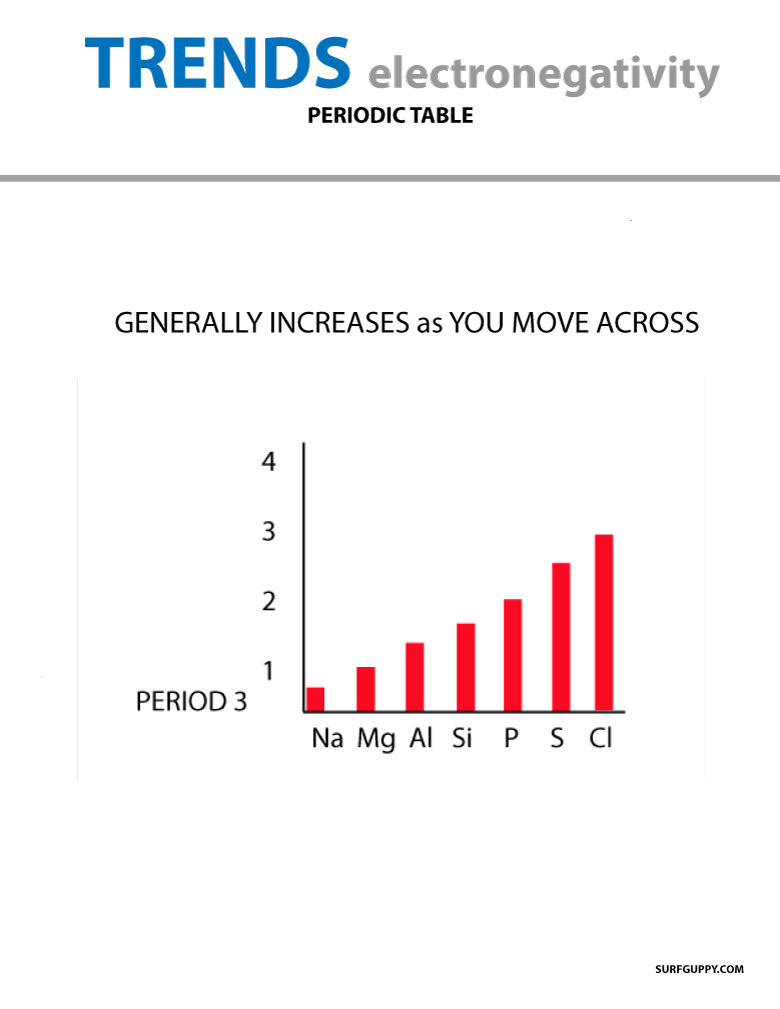
A periódusos rendszerben haladva a protonok száma az atommagban nő (energiaszint növekedés nélkül), ezért nő az elektronegativitás.
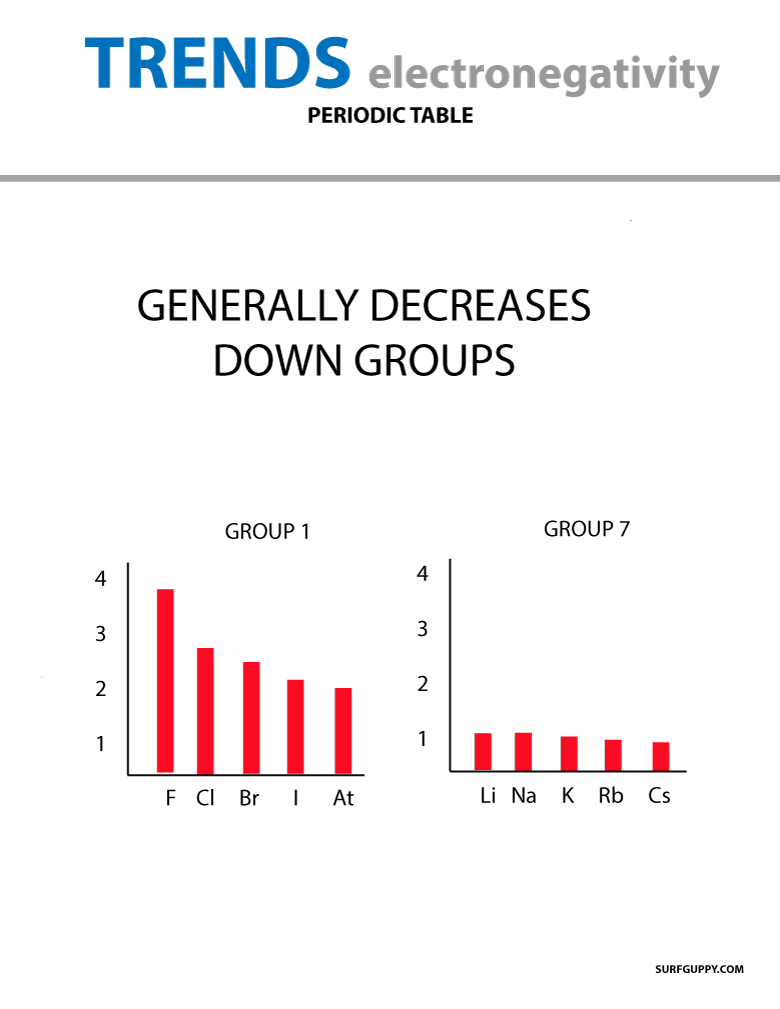
Amikor az atomszám egy csoportban lefelé növekszik, az energiaszintek is növekednek. Az atomsugár nagyobb, ezért az elektronegativitás csökken.
Elektronegativitás periódusos rendszerben
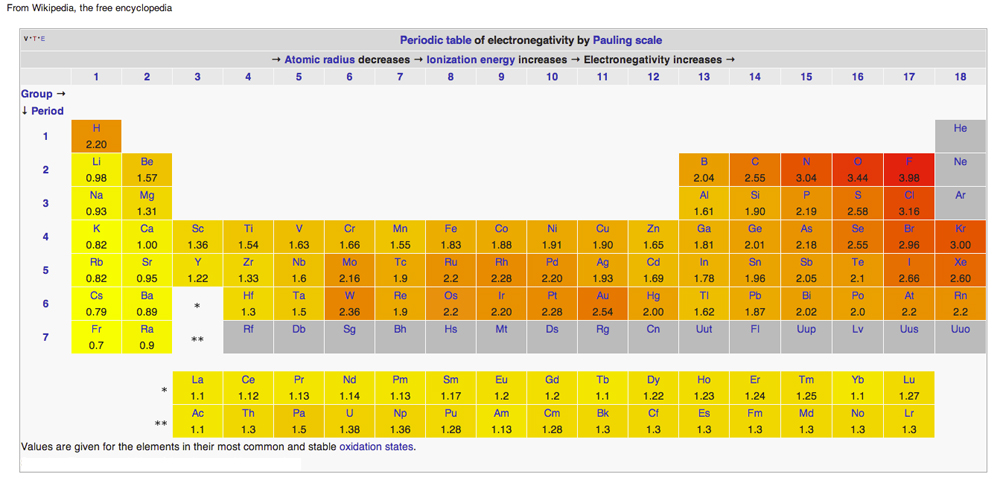 Diagram a Wikipédiából a Creative Common Licenses alatt
Diagram a Wikipédiából a Creative Common Licenses alatt
.
Leave a Reply