Miért van a #”HF “#-nek alacsonyabb forráspontja, mint a víznek, annak ellenére, hogy az #”F “# elektronegatívabb, mint az #”O “#?
Ez sok bonyolult tényezőből áll. Ezt találtam:
- A víz kiegyensúlyozottabb hidrogénkötés-hálózatot képes kialakítani (két akceptor és két donor, egy donor és három akceptor helyett), így az ömlesztett rendszer egyenletesebben kölcsönhatásba lép, és így egészében erősebbé válik.
- A víz kiterjedtebb hidrogénkötés-hálózatot képez (háromdimenziós tetraéderes helyi környezet, a kétdimenziós cikk-cakkos környezet helyett), így az ömlesztett rendszer nehezebben párolog.
- A víz általában optimálisabb kölcsönhatási szöggel rendelkezik, mivel jobban illeszkedik a molekula elektrongeometriájához, és a molekuláris dipólus mentén igazítja a kölcsönhatásokat, míg a #”HF “# erősebb hidrogénkötésekkel rendelkezne (nyers számokban kifejezve), ha a kölcsönhatások lineárisak lennének.
FELHÍVÁS: HOSSZÚ VÁLASZ! Szintén nagyon szemléletes.
A hidrogénkötés a legerősebb intermolekuláris erő mind a #”HF “#, mind a #”H”_2 “O “# esetében. A kölcsönhatás erőssége függ a kölcsönhatási távolságtól, a kölcsönhatási szögtől és a hálózat kiterjedésétől.
Ha kivonjuk az összes hidrogén-kötéses kölcsönhatást, és tiszta vizet és tiszta #”HF “#-t feltételezünk, akkor (egy végtelen mátrixból kiválasztott molekulacsoportot elkülönítve)#””^()##””^()#:
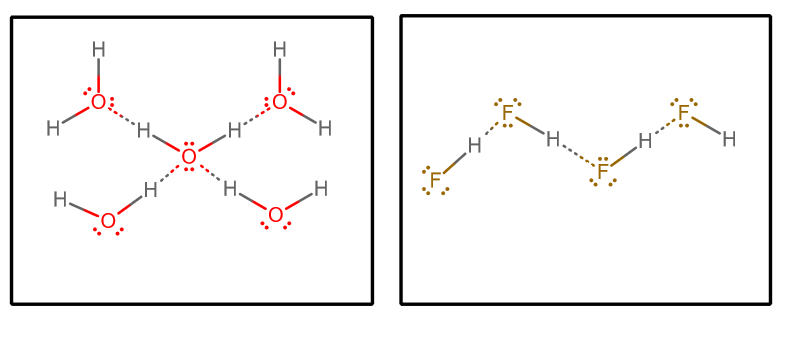
Aztán figyelembe vehetünk néhány tényezőt:
- A hidrogénkötés-donorok és -akceptorok száma
Minden vízmolekula két hidrogénkötési kölcsönhatást tud elfogadni (a magányos párokon keresztül) és két hidrogénkötési kölcsönhatást tud donálni (a hidrogeneken keresztül).
Másrészt minden #”HF “# molekula három hidrogén-kötési kölcsönhatást fogad el (a magányos párokon keresztül) és csak egyet ad (a hidrogénen keresztül).
Azzal érvelhetünk tehát, hogy a víz kiegyensúlyozottabb hidrogén-kötési hálózattal rendelkezik, ami összességében kevésbé teszi az ömlesztett rendszert gőzképessé. Ez alátámasztaná a víz magasabb forráspontját, mint a #”HF “#.
- A #bb(“F”)# és a #bb(“O”)# elektronegativitása
#”F “# elektronegatívabb, így könnyebben megtartja az elektronsűrűségét; így a magányos párok várhatóan gyengébb donorok lesznek a hidrogénkötéses kölcsönhatásokban, mint az #”O “# magányos párjai.
Ez azt jelezné előre, hogy minden egyes hidrogén-kötési kölcsönhatás gyengébb, ami alátámasztaná a víz magasabb forráspontját a #”HF “#-nál, DE ennek ellentmond a következő pont.
- Az átlagos nyers hidrogénkötési erősségek a #bb(“HF”)# vs. víz
#”O”-“H “cdotcdotcdot: “O”-#, #DeltaH_(“H”-“kötés”) ~~ “21 kJ/mol “#
#”F”-“H “cdotcdotcdot: “F”-#, #DeltaH_(“H”-“kötés”) ~~ “161.5 kJ/mol “#
Ez a Wikipédiából származó adat arra utal, hogy a #”HF “# molekulák között erősebb hidrogénkötéses kölcsönhatások vannak, mint a vízben.
Ez nem támasztaná alá azt a kísérleti bizonyítékot, hogy a #”HF “# forráspontja sokkal alacsonyabb, de ez is csak egy nyers szám, és nem veszi figyelembe például a kölcsönhatási szögeket az ömlesztett rendszerben.
- Megfigyelt hidrogénkötési szögek és a kölcsönhatás dimenziói
#”HF “#, mint lineáris molekula, két dimenzióban cikk-cakkos hidrogénkötési kölcsönhatásokat mutat, #116^@# szögekkel. Az optimálisabb szög #180^@# lenne, mivel ez közvetlenebb dipólus kölcsönhatásokat eredményezne. Ez korlátozza a #”HF “# hidrogénkötés erősségét.
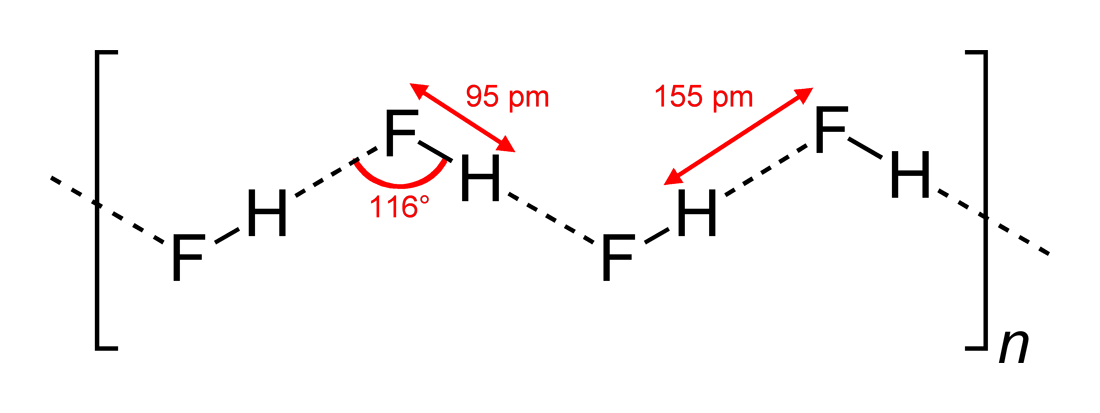
A víz, mivel hajlított molekula, tetraéderes elektrongeometriával, három dimenzióban is képes hidrogénkötésre.
Itt egy példa a víz hidrogénkötéses kölcsönhatásának helyi környezetében található tetraéderes klaszterre:
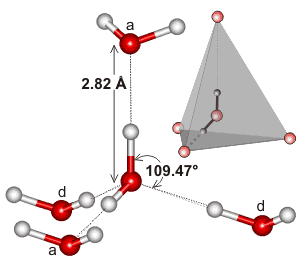
Ez lehet, hogy a hidrogénkötéses hálózat kiterjedése, és az, ahogyan az a víz elektrongeometriájának megfelelni hajlamos, teszi a víz forráspontját olyan magasra. Ez alátámasztaná a víz magasabb forráspontját, mint a #”HF “#.
Összességében ezek a legkevésbé megkérdőjelezhető tényezők, amikre gondolni tudtam:
- A víz kiegyensúlyozottabb hidrogénkötés-hálózatot tud kialakítani (két akceptor és két donor, egy donor és három akceptor helyett), így az ömlesztett rendszer egyenletesebb kölcsönhatásban van, és így összességében erősebb.
- A víz kiterjedtebb hidrogénkötés-hálózatot alakít ki (háromdimenziós tetraéderes helyi környezet a kétdimenziós cikk-cakkos környezet helyett), így az ömlesztett rendszer nehezebben párologtathatóvá válik.
- A víz általában optimálisabb kölcsönhatási szöggel rendelkezik, mivel jobban illeszkedik a molekula elektrongeometriájához, és a molekuláris dipólus mentén igazítja a kölcsönhatásokat, míg a #”HF “# erősebb hidrogénkötésekkel rendelkezne (nyers számokban kifejezve), ha a kölcsönhatások lineárisak lennének.
Leave a Reply