Frontiers in Oncology
Background
A sugárzás okozta csontritkulás és az ebből eredő elégtelenségi törések (IF) nagyon gyakoriak. Az irodalomban a hasi vagy kismedencei besugárzást követően jelentett IF-ek előfordulása 7 és 45% között változik (1-8). Bizonyos onkológiai helyzetekben, mint például az emlő- és prosztatarák hormonális kezelése, a klinikusok ismerik a kezeléssel összefüggő oszteoporózist és törési kockázatot (9-13). A kettős energiájú röntgenabszorpciót (DEXA) rutinszerűen elrendelik, és a betegek követése során profilaktikusan olyan csontritkulás elleni megelőző intézkedéseket alkalmaznak, mint a kalcium, a D-vitamin vagy a bifoszfonátok. A csontok egészségének rutinszerű értékelése azonban nem történik meg, és a sugárzással összefüggő csonttoxicitással és az IF-ekkel kapcsolatban nincs tudatosság a sugárterápiás onkológusok körében. Bár az IF-ek gyakran előfordulnak a hasi vagy kismedencei besugárzást követően a betegek követése során, és manapság igen nagy gyakorisággal figyelhetők meg sztereotaxiás besugárzások után, a sugáronkológiai gyakorlatban nem veszik figyelembe a DEXA vagy más alternatív csontsűrűség (BMD) mérést (1-8, 14-16). Mivel a sugáronkológusok nem ismerik az IF-eket, ezeket az IF-eket gyakran nem ismerik fel, vagy néha az elsődleges daganat csontmetasztázisainak tekintik, ami műhibához és felesleges vizsgálatokhoz, valamint a betegek pszichés megterheléséhez vezet.
Nemrégiben 9,6%-os csigolyatörési kockázatot mutattunk ki hasi besugárzással kezelt betegeknél (8). Úgy gondoljuk, hogy a sugárterápia tervezésénél a csontot kockázati szervnek kell tekinteni, és a BMD-t rendszeresen mérni és követni kell ezeknél a betegeknél a besugárzás előtt és után. A sugárterápiás onkológusok legfontosabb eszközükkel, a sugárkezelést tervező rendszerrel határozhatják meg betegeik és a fel nem ismert IF-ek csontegészségét.
A BMD a csont ásványianyag- és kalciumsűrűségének mérése, és DEXA-val határozzák meg (17, 18). A DEXA jelenleg a BMD számszerűsítésének arany standard módszerének tekinthető, és bizonyítottan korrelál a töréskockázattal és a kezelés hatékonyságával (17, 18). Számos tanulmány kimutatta, hogy a számítógépes tomográfiából (CT) származó Hounsfield-egységek (HU) szoros korrelációt mutatnak a DEXA által szolgáltatott BMD-vel (19-22). A HU-értékek megbízható becslést adhatnak a regionális csonterősségről és a BMD-ről, és nagy pontossággal felhasználhatók az osteoporosis kizárására (19-22). Továbbá a CT-vizsgálat a DEXA-val összehasonlítva lehetővé teszi a csigolyatörések pontosabb azonosítását (23). A diagnosztikai és sugártervezési CT-vizsgálatokat vagy a betegség stádiumának megállapítása, a sugárkezelés megtervezése vagy a betegek rutinszerű követése céljából rendelik. A CT-eredetű HU-kat ezeknél a betegeknél felhasználhatjuk a BMD meghatározására és nyomon követésére, és így elkerülhetjük a DEXA-mérésből származó többletköltségeket és a további sugárterhelést. Ezen előnyök mellett a CT-felvételekből könnyen rekonstruált szagittális csigolyanézetek felhasználhatók a fel nem ismert és tünetmentes csonttörések értékelésére.
A jelen tanulmány célja a csontsűrűség-csökkenés és a nem diagnosztizált csigolyatörések kimutatása a hasi sugárterápiával kezelt betegeknél a kezeléstervező rendszerbe importált CT-felvételekből mért HU-k és a csigolyák szagittális rekonstrukciója révén.
Módszerek
Ötvenhét egymást követő, gyomor adenokarcinóma miatt operált beteg került a vizsgálati csoportba, akik adjuváns hasi sugárterápiában részesültek. Harmincnégy egymást követő, korai stádiumú betegségben szenvedő beteg, akik a műtét után nem szorultak adjuváns kezelésre, alkotta a kontrollcsoportot.
A besugárzott betegeknél a besugárzást 6 vagy 15 MV fotonokkal végezték konformális, intenzitásmodulált vagy volumetrikusan modulált íves kezeléstervezéssel. Az előírt sugárdózis 46 Gy volt 23 frakcióban, napi 2 Gy-vel, vagy 45 Gy 25 frakcióban, napi 1, 8 Gy-vel, heti 5 napon át, 5 héten keresztül. Valamennyi beteg vagy bolus vagy infúziós 5-fluorouracilt kapott, egy ciklust a sugárkezelés előtt, két ciklust a sugárkezeléssel egyidejűleg és egy ciklust a sugárkezelés után. Minden betegtől tájékozott beleegyezést kaptunk, és a vizsgálatot a kórház helyi etikai bizottsága jóváhagyta.
A tervezési és diagnosztikai tomográfiákat többdetektoros CT-szkennerrel (LightSpeed 16 szelet vagy VCT 64 szelet; GE Healthcare, Waukesha, WI) készítettük 3 vagy 5 mm-es szeletvastagsággal. A hasi tomográfiákat a radiológiai képarchiváló és kommunikációs rendszerből importálták az Eclipse kezeléstervező rendszerbe (TPS) (Varian Medical Systems, Palo Alto, CA). A vizsgálati csoportban az első tomográfia már a kezeléstervező rendszerben volt a sugártervezéshez. A második tomográfiát 1 évvel a sugárterápia után készítették el, és importálták a kezeléstervező rendszerbe. A kontrollcsoportban a közvetlenül a műtét után és 1 évvel később készült hasi tomográfiákat importálták a tervezőrendszerbe. A T12-L1-L2 csigolyatesteket a besugárzott betegeknél egy sugáronkológus kontúrozta az egyes csigolyatestek átlagos sugárdózisának meghatározása érdekében. Ezt követően egy tapasztalt radiológus a TPS segítségével meghatározta ugyanazon csigolyák átlagos HU-értékeit az összes beteg esetében. A betegek mindkét csoportjának átlagos HU-értékeit 1 évvel később újra megmérték.
A vizsgálat kezdetén mért és az 1 évvel később kapott HU-értékeket minden egyes csigolyatestre vonatkozóan minden csoportnál kiszámították, és meghatározták a HU-k százalékos változását (Δ%HU). Bár a HU-mérések időtartamát a vizsgálat elején és 1 évvel későbbre terveztük, a kezelés után még legalább 5 évig rendszeresen követtük a betegeket az onkológiai kimenetel érdekében. A csigolyák kompressziós töréseit, ha kialakultak, a nyomon követés során a számítógépes tomográfiákról készült sagittális csigolyarekonstrukciókból határoztuk meg.
HU mérési technika
AHU-kat a T12, L1, L2 csigolyatestek trabecularis régióinak axiális keresztmetszeteinél mértük. Minden csigolyatestet három axiális szegmensre osztottunk, és a HU-kat úgy számoltuk ki, hogy téglalap alakú érdeklődési területet (ROI) helyeztünk el a csigolyatest trabecularis csontjának egy területe fölé. Igyekeztünk elkerülni a basivertebralis vénás plexust hátulról és a subchondralis szklerotikus csontot. A méréseket az 1. kiegészítő ábra részletezi. Az egyes csigolyák három axiális szegmensének átlagos HU-értékeit átlagoltuk, hogy meghatározzuk az egyes csigolyatestek végső HU-értékét. A HUpre a kezdeti CT-n mért HU-értéket jelenti mind a vizsgálati, mind a kontrollcsoport esetében, míg a HUpost az 1 év után mért HU-értéket határozza meg.
Statisztikai elemzések
A csonttompulás százalékos csökkenését (Δ%HU) minden egyes csigolya esetében a következő egyenlet segítségével számoltuk ki:
Chi-négyzet elemzéseket végeztünk a csoportok életkora, neme és tumorjellemzői közötti különbségek kimutatására. Students t-próbát alkalmaztunk az egyes csoportok pre és post HU-értékei közötti, valamint a két csoport közötti különbségek meghatározására, továbbá a vizsgált csoportban három sugárdózisszint (<20 Gy, 20-40 Gy és >40 Gy) esetében. A sugárdózisnak a Δ%HU változására gyakorolt hatásának közvetlen értékeléséhez Pearson-féle korrelációs elemzést végeztünk a Δ%HU és a sugárdózis között. A < 0,05 p-értéket szignifikánsnak tekintettük. A statisztikai elemzést a Statistical Package for Social Sciences (SPSS) 17.0 szoftverrel végeztük.
Eredmények
A beteg és a kezelés adatait az 1. táblázat tartalmazza. A csoportok között nem volt statisztikailag szignifikáns különbség az életkor, a nem, a műtéti reszekció típusa és a tumor elhelyezkedése tekintetében. A T12, L1 és L2 csigolyák átlagos HU-értékeit mindkét csoportban megmérték. A vizsgálat kezdetén nem volt statisztikailag szignifikáns különbség az összes csigolya esetében mért HU-értékekben a vizsgálati és a kontrollcsoportok között. Míg a T12, L1, L2 csigolyák átlagos HU-értékei szignifikánsan csökkentek a vizsgálati csoportban (p < 0,001 minden egyes csigolya esetében) 1 év elteltével, addig a kontrollcsoportban ugyanezen időszak alatt nem találtunk szignifikáns változást a HU-értékekben (p: 0,09-0,08-0,24, illetve). A 2. táblázat összefoglalja a HU-értékek változását a vizsgálati és a kontrollcsoportban.
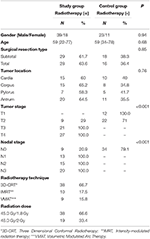
Táblázat. A betegek és a kezelés jellemzői.

Táblázat 2. táblázat. A HU-k összehasonlítása mindkét csoportban önmagukban és a két csoport között az egyes csigolyák esetében.
A T12, L1 és L2 csigolyák átlagos sugárdózisai a vizsgált csoportban 34,55 ± 11,1; 31,82 ± 12,4; 30,37 ± 13,6 Gy voltak. Negatív és szignifikáns korrelációt találtak a Δ%HU és az egyes csigolyák által kapott sugárdózis között. A sugárzási dózis növekedésével a HU-k csökkentek az egyes csigolyákban. Ezt az 1-3. ábrák foglalják össze.
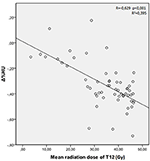
1. ábra. Korreláció a Δ%HU és a T12 csigolya által kapott sugárdózis között.
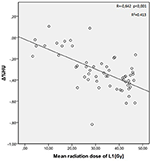
2. ábra. Korreláció a Δ%HU és az L1 csigolya által kapott sugárdózis között.
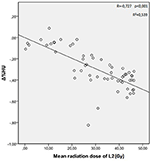
3. ábra. A Δ%HU és az L2 csigolya által kapott sugárdózis közötti összefüggés.
A csigolya által kapott sugárdózis és a HU-változás közötti összefüggést a 3. táblázatban foglaltuk össze. Bár a HU-értékek csökkenése statisztikailag szignifikáns volt a 20 Gy feletti sugárdózisoknál, a HU-értékek nem változtak szignifikánsan a 20 Gy alatti sugárdózisoknál, kivéve az L2 csigolyákat.

3. táblázat. A HU-értékek változása a besugárzási dóziscsoportok tekintetében.
Törések
Míg a kontrollcsoportban egyetlen betegnél sem volt törés, addig a besugárzott csoportban 57 betegből 4 betegnél (%7) csigolyatörés alakult ki a vizsgálat során. Míg a csigolyatörések közül kettőt nőknél, kettőt férfiaknál figyeltek meg. A töréseket a besugárzást követő 16., 18., 20. és 26. hónapban állapították meg, a medián követési idő 24 hónap volt (tartomány: 12-36 hónap). Három betegnél az L1 csigolyában, egy betegnél pedig az L2 csigolyában észleltek törést. Az egyes törött csigolyák által kapott átlagos sugárdózisok a következők voltak: 39, 28,5, 22,3, 31 Gy. A csigolyatörést szenvedett betegek jellemzőit az 1. kiegészítő táblázat és a 2. kiegészítő ábra foglalja össze.
Diszkusszió
A sugárterápia közvetlen és közvetett mechanizmusok révén csontritkuláshoz vezet, és a klinikai gyakorlatban gyakran alakulnak ki IF-ek kismedencei vagy hasi besugárzások után (1-8). A csigolya- és kismedencei IF-ek gyakoriak, és a sugárterápia fontos késői mellékhatását jelentik. A sugárterápiás onkológusok azonban nincsenek tisztában a sugárzás okozta csontritkulással és csonttoxicitással. A sugárzás okozta csonttoxicitás ismeretlensége miatt nem fordítanak különösebb figyelmet e fontos késői szövődmény megelőzésére. Mi korábbi tanulmányunkban (8) megpróbáltuk hangsúlyozni ennek a problémának a fontosságát, és beszámoltunk a csigolyatörések igen magas előfordulási gyakoriságáról a hasi besugárzások után, akárcsak a kismedencei daganatok miatt besugárzott betegeknél (1-7).
A sugárterápiás onkológusok a sugárkezelés tervezése során nagy figyelmet fordítanak az egyes veszélyeztetett szervek által kapott sugárdózisra. Bár a III/IV. fokozatú késői toxicitás aránya ezeknél a nagyon szorosan követett szövődményeknél nem haladja meg a bizonyos százalékos arányokat, a hasi, illetve kismedencei sugárterápiával összefüggő csonttoxicitás és az ebből eredő csonttörések valóban magasabbak, mint a jól ismert III/IV. fokozatú késői toxicitások. Míg a dóziskorlátok jól meghatározottak a közismerten veszélyeztetett szervek esetében, és meghatározóak a végleges terv jóváhagyásakor, addig a csontszövet esetében ez nem így van.
Még a Common Terminology Criteria for Adverse Events (CTCAE) legújabb, 5.0-s verziójában sincs külön definíció a besugárzásból eredő csonttoxicitásra (24). A sugáronkológiai gyakorlatban nincsenek a csontra vonatkozó toxicitásértékelési kritériumok. Sem a LENT-SOMA késői toxicitási pontozási táblázatokban, sem a Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC) jelentésben a csontot nem határozták meg veszélyeztetett szervként, és nem határoztak meg dózis- és mennyiségi korlátozást erre a szövetre (25, 26). A korábbi vizsgálatok és a nemrégiben publikált tanulmányunk azonban azt mutatta, hogy az oszteoporózist és a csonttörés kockázatát komolyan figyelembe kell venni, és a besugárzott betegek követése során meg kell tenni a szükséges óvintézkedéseket a sugárzással összefüggő törések megelőzése érdekében (1-8).
A BMD számszerűsítésére és az oszteoporózis rutinszerű szűrésére a DEXA az arany standard módszer. A sugárterápiás onkológusok nem rendelnek DEXA-t a kismedencei vagy hasi besugárzásban részesülő betegeik számára. Nem konzultálnak ezekkel a betegekkel az endokrinológussal a töréskockázat felmérése és a csontritkulás megléte céljából a sugárkezelés előtt. Sugáronkológusként azonban használhatjuk a tervezőrendszerünket a BMD és a csontritkulás kockázatának meghatározására. Ezek az értékelések könnyen elvégezhetők a CT-vizsgálatokon keresztül, amelyeket akár a betegség stádiumbeállítása, akár a sugárkezelés tervezése és a betegek nyomon követése céljából rendelnek. A BMD-csökkenést, az oszteoporózist és az észrevétlen töréseket a betegek tervezőrendszerbe importált CT-felvételeiből a csont HU-értékeinek mérésével, valamint a besugárzott csontterületek szagittális képeinek elkészítésével tudjuk meghatározni.
A közelmúltban felvetették, hogy a CT-ből származó csont HU-értékek felhasználhatók a csökkent BMD-vel és oszteoporózissal rendelkező betegek azonosítására (19-22, 27-30). Pickhardt és munkatársai (22) egyértelműen meghatározták, hogyan mérhetők és használhatók a csont HU-értékei a DEXA alternatívájaként a BMD és az oszteoporózis diagnózisának felállítására. Ezekben a vizsgálatokban, míg a 100 alatti csont HU-értékeket osteoporosisra utalónak, a 100 és 160 közötti HU-értékeket osteopeniára utalónak, a 160 feletti HU-értékeket pedig normális csont ásványi sűrűségre utalónak tekintik (19-22). A 160 feletti HU-értékkel rendelkező betegek csontsűrűsége normális, így nincs szükség DEXA-mérésre, és nem kell aggódni a csontok egészségéért. A 100 és 160 közötti HU-értékkel rendelkező betegek csontritkulásosnak tekinthetők, és korai beavatkozásra van szükségük a jövőbeni csontritkulás és törésveszély megelőzése érdekében. A 100 alatti HU-értékkel rendelkező betegeket csontritkulásosnak kell tekinteni. Az alacsony HU-értékeknek figyelmeztetniük kell a sugárkezeléssel foglalkozó onkológust a sugárzásnak kitett csontos területeken a későbbi törésveszélyre. Ezeket a betegeket a sugárkezelés előtt konzultálni kell az endokrinológussal. A csont ásványi sűrűségének és a csontritkulás meghatározására szolgáló DEXA és HU összehasonlításával végzett vizsgálatokban a CT-felvételekből történő HU-meghatározás során néhány, a DEXA alapján nem csontritkulásos csoportba tartozó betegnél csigolyatörést mutattak ki (22, 29-31).
Vizsgálatunkban arra törekedtünk, hogy a sugáronkológusok számára egyszerű módszert találjunk a csontritkulás diagnosztizálására és a törési kockázat meghatározására. Ha ezeket a méréseket beépítjük a mindennapi rutinba a sugárkezelés tervezése során, akkor meghatározhatjuk az oszteopéniát, az oszteoporózist és a törési kockázatot azoknál a betegeknél, akik hasi vagy kismedencei sugárterápiában részesülnek, és időben beavatkozhatunk a késői sugárzás okozta csonttoxicitás megelőzése érdekében.
Míg a T12, L1, L2 csigolyák kiindulási és 1 évvel későbbi HU-értékei között a kontrollcsoportban nem volt statisztikai szignifikáns különbség, a besugárzott betegeknél jelentősen csökkentek a HU-értékek. Csigolyatöréseket csak a besugárzott betegeknél találtunk. Az 57 betegből négynél volt csigolyatörés a 24 hónapos medián követés után, a törések kumulatív előfordulási aránya 7% volt. Bár a követési idő rövid volt, és a törések többsége tünetmentes volt, korábbi tanulmányunkban 9,6%-os törési arányról számoltunk be, hosszabb követési idővel, és e törések többsége tünetmentes volt (8). A magas csonttörési kockázat ezeknél a betegeknél figyelmet érdemel, és a csontot veszélyeztetett szervnek kell tekinteni. A sugárterápiát követően a csonttörések kialakulásáig eltelt idő 2 és 63 hónap között mozgott (2, 14). Érdekes módon a törések mint IV. fokozatú késői sugárfertőzés nagyobb gyakorisággal fordulnak elő, mint más jól ismert késői sugárfertőzések, például sugárfibrózis, cystitis, proctitis stb.
A HU csökkenése dózisfüggő volt. A csontok HU-értékeinek csökkenése nagyobb kockázatot jelentett a csigolyák által kapott nagyobb sugárdózisok esetén. Ugyanakkor azt találtuk, hogy a HU-értékek csökkenése nem volt szignifikáns a 20 Gy alatti sugárdózisnak kitett csigolyatestek esetében.
A szakirodalomban ellentmondásos eredmények vannak a tekintetben, hogy a BMD-vesztés milyen sugárdózisban figyelhető meg. Míg egy vizsgálat BMD-vesztést mutatott ki a 22,5 Gy kismedencei besugárzással kezelt betegeknél, egy másik vizsgálat nem mutatott ki összefüggést a sugárdózis és az elégtelen törés kockázata között (32, 33). Wei és munkatársai (33) arról számoltak be, hogy még az 5 Gy csigolyasugárzási dózis is jelentős BMD-csökkenést és IF-eket eredményez a hasi sugárterápiával kezelt betegeknél. Ők is javasolták a csigolyatestek sugárzási dózisának korlátozását, különösen azoknál a betegeknél, akiknél a sugárkezelés tervezése során alacsony HU-értékeket észleltek. Ezért a sugárzási mezőn belüli csigolyákra dóziskorlátozást kell meghatározni. A dóziskorlátozások a sugárkezelés tervezése során mért HU-értékektől függően változhatnak. Meg kell próbálnunk csökkenteni a sugárzási mezőn belüli csigolyacsontok átlagos sugárdózisát, különösen az idős és már csontritkulásos betegeknél.
Következtetések
A sugárzás okozta csontritkulás és az ebből eredő elégtelenségtörések (IF) nagyon gyakoriak. A BMD-csökkenés, az oszteoporózis és az észrevétlen törések kimutathatók a csont HU-értékeinek mérésével a betegek tervező rendszerbe importált CT-felvételeiből, valamint a besugárzott csontterületek szagittális képeinek rekonstrukciójával. Azoknál a betegeknél, akiknél a sugártervezés során már alacsony csont HU-értékeket észleltek, korán be lehet avatkozni a csont egészségének helyreállítása és a sugárkezeléssel összefüggő jövőbeli törések megelőzése érdekében. A sugárzással kapcsolatos csonttoxicitás megelőzése érdekében a kezelés tervezésének időpontjában már alacsony HU-értékekkel rendelkező csigolyacsontok sugárzási dózisát 20 Gy alá kell korlátozni.
Adatok hozzáférhetőségi nyilatkozata
A cikkben leírt anyagok, beleértve az összes releváns nyers adatot, szabadon hozzáférhetőek minden olyan tudós számára, aki azokat nem kereskedelmi célokra, a résztvevők titoktartásának megsértése nélkül kívánja felhasználni, és a megfelelő szerzőtől beszerezhetőek.
Etikai nyilatkozat
Vizsgálatunkat a Helsinki Nyilatkozatnak megfelelően végeztük. A vizsgálatot a Dr. Lutfi Kirdar Kartal Oktatási és Kutató Kórház etikai bizottsága jóváhagyta (2017/514/109/2). A vizsgálatban részt vevők mindegyikétől írásbeli beleegyezést kaptunk.
Author Contributions
GY: a teljes vizsgálat integritásának garanciája. GY és CG: a tanulmány koncepciója és tervezése. NC: irodalomkutatás. GY, CG, IK, OS és NC: klinikai vizsgálatok. GY: statisztikai elemzés. OS: a kézirat elkészítése. CG: kéziratszerkesztés. Minden szerző elolvasta és jóváhagyta a végleges kéziratot.
Érdekütközés
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális érdekellentétként értelmezhetők.
Kiegészítő anyagok
A cikkhez tartozó kiegészítő anyagok online elérhetők a következő címen: https://www.frontiersin.org/articles/10.3389/fonc.2020.00742/full#supplementary-material
Rövidítések
IFs, Insuffiency fractures; DEXA, Dual energy x-ray absorptiometry; BMD, Bone mineral density; CT, Computerized tomography; HU, Hounsfield unit; Δ%HU, Percent change in HU; ROI, Region of interest; SPSS, Statistical package for the social sciences; CTCAE, Common terminology criteria for adverse event; QUANTEC, Quantitative analyses of normal tissue effects in the clinic.
1. Oh D, Huh SJ. Hiánytörés sugárterápiát követően. Radiat Oncol J. (2014) 32:213-20. doi: 10.3857/roj.2014.32.4.213
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Higham CE, Faithfull SJ. A csontok egészsége és a kismedencei sugárterápia. Clin Oncol. (2015) 11:668-78. doi: 10.1016/j.clon.2015..07.006
CrossRef Full Text | Google Scholar
3. Shih KK, Folkert MR, Kollmeier MA, Abu-Rustum NR, Sonoda Y, Leitao MM Jr, et al. Pelvic insufficiency fractures in patients with cervical and endometrial cancer treated with postoperative pelvic radiation. Gynecol Oncol. (2013) 128:540-3. doi: 10.1016/j.ygyno.2012.12.021
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Uezono H, Tsujino K, Moriki K, Nagano F, Ota Y, Sasaki R, et al. Pelvic insufficiency fracture after definitive radiotherapy for uterine cervical cancer: retrospective analysis of risk factors. J Radiat Res. (2013) 54:1102-9. doi: 10.1093/jrr/rrt055
PubMed Abstract | CrossRef Full Text | Google Scholar
5. J Radiat Res. Igdem S, Alco G, Ercan T, Barlan M, Ganiyusufoglu K, Unalan B, et al. Elégtelen törések kismedencei sugárterápia után prosztatarákos betegeknél. Int J Radiat Oncol Biol Phys. (2010) 77:818-23. doi: 10.1016/j.ijrobp.2009.05.05.059
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Int. Schmeler KM, Jhingram A, Iyer RB, Sun CC, Eifel PJ, Soliman PT, et al. Pelvic fractures after radiotherapy for cervical cancer: implications for survivors. Cancer. (2010) 116:625-30. doi: 10.1002/cncr.24811
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Kim HJ, Boland PJ, Meredith DS, Lis E, Zhang Z, Shi W, et al. Fractures of the sacrum after chemoradiation for rectal carcinoma: incidence, risk factors, and radiographic evaluation. Int J Radiat Oncol. (2012) 84:694-9. doi: 10.1016/j.ijrobp.2012.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Hosszú távú kutatásokat végeznek az orvostudományban. Yaprak G, Gemici C, Temizkan S, Ozdemir S, Dogan BC, Seseogullari OO. Csontritkulás kialakulása és csigolyatörések hasi besugárzást követően gyomorrákos betegeknél. BMC Cancer. (2018) 18:972. doi: 10.1186/s12885-018-4899-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. A rákos megbetegedések és a daganatos megbetegedések vizsgálata. Lustberg MB, Reinbolt RE, Shapiro CL. A csontok egészsége a felnőttkori rákos túlélésben. J Clin Oncol. (2012) 30:3665-74. doi: 10.1200/JCO.2012.42.2097
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Onkológus és Onkológus. Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, ESMO Guidelines Working Group. Csontok egészsége daganatos betegeknél: ESMO klinikai gyakorlati iránymutatások. Ann Oncol. (2014) 25:124-37. doi: 10.1093/annonc/mdu103
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Beszámoló a csontkárosodásról és a csontritkulásról. Pfeilschifter J, Diel IJ. Rákkezelés miatti csontritkulás: patogenezis és kezelés. J Clin Oncol. (2000) 18:1570-93. doi: 10.1200/JCO.2000.18.7.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Az Onkológiai Klinika és az Onkológiai Társaságok Szövetsége és az Onkológiai Társaságok Szövetsége. Hadji P, Gnant M, Body JJ, Bundred NJ, Brufsky A, Coleman RE, et al. Cancer treatment-induced bone loss in premenopausal women: a need for therapeutic intervention? Cancer Treat Rev. (2012) 38:798-806. doi: 10.1016/j.ctrv.2012.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Cancer Treat Rev. (2012) 38:798-806. Skolarus TA, Caram MV, Shahinian VB. Androgénhiánnyal összefüggő csontbetegség. Curr Opin Urol. (2014) 24:601-7. doi: 10.1097/MOU.000000000000010101
PubMed Abstract | CrossRef Full Text | Google Scholar
14. A csontritkulás és a csontritkulás problémája. Boehling NS, Grosshans DR, Allen PK, McAleer MF, Burton AW, Azeem S, et al. Vertebral compression fracture risk after stereotactic body radiotherapy for spinal metastases. J Neurosurg Spine. (2012) 16:379-86. doi: 10.3171/2011.11.SPINE116
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gyógyszerészi szakvélemény | CrossRef Full Text | Google Scholar
. Cunha MV, Al-Omair A, Atenafu EG, Masucci GL, Letourneau D, Korol R, et al. Vertebral compression fracture (VCF) after spine stereotactic body radiation therapy (SBRT): analysis of predictive factors. Int J Radiat Oncol Biol Phys. (2012) 84:343-9. doi: 10.1016/j.ijrobp.2012.04.034
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Int. Jawad MS, Fahim DK, Gerszten PC, Flickinger JC, Sahgal A, Grills IS, et al. Vertebral compression fractures after stereotactic body radiation therapy: a large, multi-institutional, multinational evaluation. J Neurosurg Spine. (2016) 24:928-36. doi: 10.3171/2015.10.SPINE141261
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Vö. Marshall D, Johnell O, Wedel H. Metaanalízis arról, hogy a csont ásványi sűrűségének mérései mennyire jól jelzik előre a csontritkulásos törések előfordulását. BMJ. (1996) 312:1254-9. doi: 10.1136/bmj.312.7041.1254
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. A referencia standard az osteoporosis leírására. Bone. (2008) 42:467-75. doi: 10.1016/j.bone.2007.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
19. A csontritkulás és a csontritkulás között a csontritkulás és a csontritkulás közötti különbségek és a csontritkulás közötti különbségek. Schreiber JJ, Anderson PA, Rosas HG, Buchholz AL, Au AG. Hounsfield-egységek a csont ásványi sűrűségének és szilárdságának értékelésére: a csontritkulás kezelésének eszköze. J Bone Joint Surg Am. (2011) 93:1057-63. doi: 10.2106/JBJS.J.00160
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Beszámoló a Honextrópia és a Honextrópia és a Honextrópia és a Honextrópia és a Honextrópia között. Schreiber JJ, Anderson PA, Hsu WK. A komputertomográfia alkalmazása a csont ásványi sűrűségének értékelésére. Neurosurg Focus. (2014) 37:E4. doi: 10.3171/2014.5.FOCUS1483
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Áttekintés a neurológia és a neurológia területén. Batawil N, Sabiq S. Hounsfield-egység a csontsűrűség-betegség diagnosztizálására: egy koncepciót bizonyító vizsgálat. Radiográfia. (2016) 22:93-8. doi: 10.1016/j.radi.2015.11.004
CrossRef Full Text | Google Scholar
22. A teljes szöveg | Google Scholar
. Pickhardt PJ, Pooler BD, Lauder T, del Rio AM, Bruce RJ, Binkley N. Opportunistic screening for osteoporosis using abdominal computed tomography scans obtained for other indications. Ann Intern Med. (2013) 158:588-95. doi: 10.7326/0003-4819-158-8-201304160-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Az orvosok és az orvosszakértők a következő adatokat közölték:
PubMed Abstract | CrossRef Full Text | Google Scholar
. Lenchik L, Shi R, Register TC, Beck SR, Beck SR, Langefeld CD, et al. A trabecularis csont ásványi sűrűségének mérése a mellkasi gerincben a szív kapuzott kvantitatív komputertomográfiával. J Comput Assist Tomogr. (2004) 28:134-9. doi: 10.1097/00004728-200401000-00023
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Google Scholar
. A nemkívánatos események közös terminológiai kritériumai (CTCAE). Változat 5.0. U.S. Department of Health and Human Services, National Institutes of Health National Cancer Institute. Maryland (2017).
25. Overgaard J, Bartelink H. Késői hatások konszenzuskonferencia: RTOG/EORTC. Radiother Oncol. (1995) 35:1-82. doi: 10.1016/0167-8140(95)01548-U
CrossRef Full Text | Google Scholar
26. A teljes szöveg | Google Scholar
. Bentzen SM, Constine LS, Deasy JO, Eisbruch A, Jackson A, Marks LB. A normál szöveti hatás kvantitatív elemzése a klinikumban (QUANTEC): bevezetés a tudományos kérdésekbe. Int J Radiat Oncol Biol. Phys. (2010) 76(3 Suppl):S3-S9. doi: 10.1016/j.ijrobp.2009.09.040
CrossRef Full Text | Google Scholar
27. A sugárzástudományok és a sugárzástudományi kutatások eredményeiről és a sugárzástudományi kutatásokról (2010). Buckens CF, Dijkhuis G, de Keizer B, Verhaar HJ, de Jong PA. Opportunista csontritkulás-szűrés rutinszerű komputertomográfián? Egy külső validációs vizsgálat. Eur Radiol. (2015) 25:2074-9. doi: 10.1007/s00330-014-3584-0
PubMed Abstract | CrossRef Full Text | Google Scholar
28. ombudsmani vizsgálat. Emohare O, Cagan A, Morgan R, Davis R, Asis M, Switzer J, et al. The use of computed tomography attenuation to evaluate osteoporosis following acute fractures of the thoracic and lumbar vertebra. Geriatr Orthop Surg Surg Rehabil. (2014) 5:50-5. doi: 10.1177/215141458514525042
PubMed Abstract | CrossRef Full Text | Google Scholar
29. A csontritkulás és a csontritkulás elleni küzdelem és a csontritkulás elleni küzdelem és a csontritkulás elleni küzdelem és a csontritkulás elleni küzdelem és a csontritkulás elleni küzdelem. Alacreu E, Moratal D, Arana E. Az osteoporosis opportunista szűrése rutin CT-vel Dél-Európában. Osteoporos Int. (2017) 28:983-90. doi: 10.1007/s00198-016-3804-3
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Az osteoporoszkópia és az oszteoporoszkópiás megbetegedések és a csontritkulás megelőzése. Lee S, Chung CK, Oh SH, Park SB. A kettős energiájú röntgenabszorpcióméréssel mért csont ásványi sűrűség és a diagnosztikus CT-vel mért hounsfield-egységek közötti korreláció az ágyéki gerincben. Korean Neurosurg Soc. (2013) 54:384-9. doi: 10.3340/jkns.2013.54.5.384
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Korea Neurosurg Soc. Miyabara Y, Holmes D, Camp J, Miller VM, Kearns AE. A kalibrált és kalibrálatlan csontsűrűség összehasonlítása CT-vel és DEXA-val menopauzában lévő nőknél. Climacteric. (2012) 15:374-81. doi: 10.3109/13697137.2011.618566
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Vizsgálatok a csontritkulással kapcsolatban. Park SH, Kim JC, Lee JE, Park IK. Kismedencei elégtelenségtörés sugárterápiát követően méhnyakrákos betegeknél a PET/CT korszakában. Radiat Oncol J. (2011) 29:269-76. doi: 10.3857/roj.2011.29.4.269
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Radiat Oncol J. (2011) 29:269-76. o. Wei RL, Jung BC, Manzano W, Sehgal V, Klempner SJ, Lee SP, et al. Bone mineral density loss in thoracic and lumbar vertebrae following radiation for abdominal cancers. Radiother Oncol. (2016) 118:430-6. doi: 10.1016/j.radonc.2016.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply