A frakcionálatlan heparin farmakológiája
Ez a gyógyszer az intenzív osztályos antikoaguláció egyik főszereplője, és jól teszi az ember, ha jól megismeri a tulajdonságait.
Kémiai tulajdonságok és molekulaszerkezet
A heparin a glikozaminoglikánoknak nevezett mukopoliszacharidok heterogén keveréke.
Ez lényegében egy polimerizált diszacharid, egy keményítő.
Minden ismétlődő diszacharid változóan szulfatált. Íme egy kép, amit a Wikipédiából téptem le:
Mivel a diszacharid polimerek különböző hosszúságúak, a heparin átlagos molekulatömege 3 és 30 kDa között van. Kivéve, ha frakcionálták, amely esetben ellenőrizni lehet, hogy csak az alacsony molekulatömegű változatot kapja meg.
A polimer hossza valóban nagyon-nagyon véletlenszerű, főként azért, mert a kórházában lévő heparin szarvasmarha-tüdőből vagy sertésbélből származik, és ezek az állatok nagyrészt érdektelenek az ipari kémia minőségellenőrzésében. Az első heparint valójában kutyamájsejtekből nyerték 1916-ban, egy másodéves orvostanhallgató által.
Mi a fene az az “egység” heparin?
Egy egység heparin az a mennyiség, amely ahhoz szükséges, hogy 1 ml macskavér 24 órán keresztül 0 Celsius fokon folyékonyan maradjon. Ez a szokatlanul állatbarát definíció egy bizonyos WH Howelltől származik, aki néhány macska vérét éjszakára a hűtőben hagyta. Nem alvadt meg – félig-meddig megalvadt -, de ettől függetlenül folyékony maradt. Manapság a Nemzetközi Heparin Szabvány juhplazmát használ, feltehetően azért, mert a juhokat könnyebb befogni és kivéreztetni.
Kémiai rokonok
Gondolom, ezek a frakcionált heparinok (pl. Enoxaparin).
Funkcionális rokonai az összes többi indirekt trombin gátló, amelyek között van a Fondaparinux
A beadás és felszívódás
Jellemzően intravénásan, vagy szubkután adják (ahonnan fokozatosan disszociál).
-
- A szubkután beadási módnál 1-2 óra kell a csúcshatás eléréséhez.
Ezt követően a megoszlási térfogata 40-70ml/kg, lényegében az intravaszkuláris térfogatra korlátozódik.
Nem hatol át a méhlepényen, ezért különösen hasznos a terhességben.
Mi van, ha megittam?
Az orális heparinnak nagyon rossz a biológiai hozzáférhetősége. Túl nagy molekula, és töltése túl negatív ahhoz, hogy könnyen felszívódjon. Emiatt szinte kizárólag a keringő térfogatban oszlik el. Bátor emberek megpróbáltak főzni a heparinnal, hogy szájon át jobban biohasznosíthatóvá tegyék. Ezenkívül 45 bátor ember megivott 20 000 egység heparint, majd megengedték, hogy megvizsgálják az APTT-jüket – kiderült, hogy átlagosan 2,3 másodperccel nő, ami nem sok, de azt mutatja, hogy van némi felszívódás. A tanulmány nem áll rendelkezésemre, de szívesen hallanám egy önkéntestől, hogy milyen íze volt a heparinnak.
Metabolizmus és clearance
2 mechanizmus létezik: a gyors telítődéses clearance és a lassú elsőrendű clearance.
A felezési idő a dózistól függ.
25 egység/ kg felezési ideje = 30 perc
100 egység/ kg felezési ideje = 60 perc
400 egység/ kg felezési ideje = 150 perc
Kisebb adagok esetén, a felezési idő nagyon rövid (mivel az infúzióba adott heparin nagy része közvetlenül a makrofágokhoz és az endotélsejtekhez kötődik, ahol depolimerizálódik). Ez a mechanizmus nagyobb dózisoknál telítődik, és az elimináció lassabbá válik, a dózissal összefüggő sebességgel.
Rövid telítődő nulladik rendű clearance:
- A heparinkötő fehérjékhez, makrofágokhoz és endotélsejtekhez való kötődés miatt.
- A heparin így kötődve használhatatlanná válik, és végül depolimerizálódik.
- Ez a kis dózisoknál megfigyelhető nulladik rendű lineáris elimináció.
Lassú elsőrendű clearance:
- Renális kiválasztás… talán? Hogy őszinte legyek, valószínűleg nem renális. Hatalmas adagok után egy kis mennyiség ürül a vizelettel.”
- A MIMS jelenleg elismeri, hogy “a heparin metabolikus sorsa kevéssé ismert”, de megemlíti, hogy a retikuloendotheliális rendszer szerepet játszhat a heparin szekvenálásában és megsemmisítésében.
A hatásmechanizmus
A heparin a szervezetben a hízósejtek szekréciós granulumaiban van jelen. Számos állatban is megtalálható, köztük különböző gerinctelen állatokban, amelyekben nincs semmi, ami akár csak távolról is hasonlítana az emberi véralvadási kaszkádhoz. Ami furcsa.
Szóval senki sem tudja pontosan, mi a célja.
De az emberben…
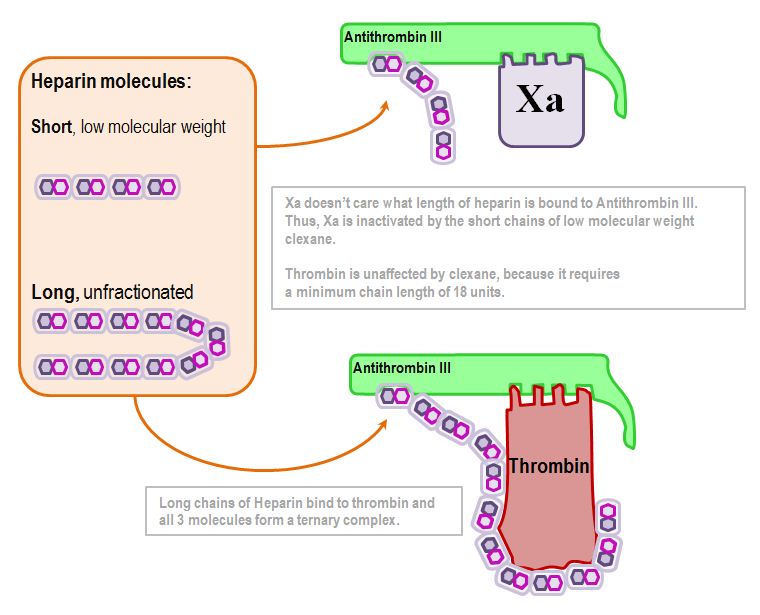
A heparin 1000-szeresére fokozza az antitrombin-III aktivitását.
Azt teszi, hogy az antitrombin III-hoz kötődik, és az aktív hely konformációs változáson megy keresztül.
A gyerekes ábrámon az Antitrombin-III molekuláris farkának elpattintása az aktív centrum fokozott elérhetőségét jelenti.
Az így aktivált Antitrombin-III számos faktort inaktivál – de leginkább a Xa-t és a IIa-t (trombin).
Most elérkeztünk egy fontos ponthoz.
A trombin inaktiválása a heparinmolekula hosszától függ:
18 diszacharid egység a kulcsszám (kb. 5kDa)
A Xa inaktiválása független a hosszától: amíg bármilyen heparin kötődik hozzá, addig az Antithrombin-III inaktiválja a Xa-t.
Ez áll az alacsony molekulatömegű heparin és a frakcionálatlan heparin farmakokinetikájának különbsége mögött.
Így összefoglalva, a frakcionálatlan heparin befolyásolja a trombint, míg az alacsony molekulatömegű heparin csak a Xa-t.
Ez azt is megmagyarázza, hogy az APTT mérése miért nem fogja megmondani, hogy a klexán adagja terápiás-e.
A frakcionálatlan heparin a 9-es faktor aktivitását is befolyásolja, de a 7-es faktorét nem. Így az intrinzik és a közös útvonalakat érinti, ami megnöveli az APTT-t. Az extrinsic útvonal nem érintett, és a PT nem emelkedik nagyon. Mivel a trombint nem befolyásolja az alacsony molekulatömegű heparin, az APTT lényegében változatlan marad.
Használati javallatok
- Hát az antikoaguláció, ami egy sokkal nagyobb téma. Az APTT monitorozása a kulcskérdés.
- Röviden: a heparint DVT-profilaxisban, trombózis és tromboembólia kezelésében, akut koronária-szindrómákban és lassú áramlású dialíziskörök fenntartásában alkalmazzák.
- A terhesség alatti DVT farmakológiai kezelése korábban a frakcionálatlan heparinon nyugodott. A PROTECT vizsgálat, amely összehasonlította a frakcionálatlan és az LMWH-t, nem talált nagy különbséget a DVT arányában (még mindig 5,6% körül volt), de az LMWH csoportban kevesebb PE volt, és tendencia volt a kevesebb HITS felé.
Kontraindikációk
- Ha vérzést okoz, akkor újra kell gondolni a heparint. Ez nagyjából összefoglalja az ellenjavallatokat gyakorlati szempontból. Az invazív beavatkozások fenyegető veszélye a fő ellenjavallat.
- Az egyetlen abszolút ellenjavallat a korábbi HIT vagy HITT.
Kölcsönhatások
Attól az ostobán nyilvánvaló tendenciától eltekintve, hogy növeli a vérzésveszélyt azoknál az embereknél, akik valamilyen másfajta véralvadásgátló gyógyszerrel is antikoaguláltak, a heparinnak kevés valódi farmakológiai kölcsönhatása van:
| A heparin hatásait erősíti | A heparin hatásait antagonizálja |
| Hydroxycholoroquine | Antihisztaminok |
| Probenecid | Digoxin |
| Nátrium-valproát | Tetraciklinek |
| Vitamin. C | |
| Nikotin |
Krónikus szövődmények
Heparin-Induced Thrombocytopenia Syndrome (HITS) plus Heparin-Induced Thrombocytopenia and Thrombosis Syndrome (HITTS)
-
- Immun-mediált trombocitopéniát jól tárgyalta Franchini 2005-ben
-
-
-
- Gyakrabban társul frakcionálatlan heparinnal
- Egyre gyakoribb időseknél; gyermekeknél ismeretlen
- Szív- és ortopédiai műtéti betegeknél nagyobb a kockázat
- Típusosan 5-10 nappal a heparin elkezdése után jelentkezik
-
-
-
-
- 2 ízben kapható: 1. és 2. típusú.
HITS 1-es típusú:
- Enyhe átmeneti trombocitopénia, 100 feletti vérlemezkeszám
- Heparin elhagyásával teljesen visszafordítható
- A szabadalmak legfeljebb 10%-ánál fordul elő
- NEM jár fokozott trombóziskockázattal
- Vélhetően nem is immun eredetű
HITS 2. típus:
- Kellemetlen súlyos trombocitopénia, a vérlemezkeszám a nullára csökkenhet
- A szabadalmak kb. 1%-ában fordul elő
- Az esetek 30%-ában trombózissal társul
- A trombocita faktor 4 (PF4) és a heparin alkotta komplex ellenanyagának képződése miatt; ez a komplex a vérlemezkék felszínén alakul ki.
- Amikor a HIT-antitest ehhez a komplexhez kötődik, vérlemezke-aktivációt és aggregációt okoz, és így fennáll a véralvadási hajlam (mivel az összes vérlemezke aktiválódik), valamint egyidejűleg a vérzésre való hajlam is (mivel az antitesttel bevont vérlemezkék elpusztulnak a retikuloendothelialis rendszerben)
Amikor a betegnek HIT-je van, továbbra is antikoagulálni kell.
A közvetlen trombin gátló szerek jelentik a választandó kezelést.
A krónikus heparinhasználat egyéb hatásai
- Csontritkulás
- A heparin valamilyen okból aktiválja az oszteoklasztokat, és a csontreszorpció fokozódik.
- Mineralokortikoidhiány
- Úgy tűnik, hogy a heparin antagonizálja az ACTH hatását
- Furcsa mellékhatások
- Alopecia- ki tudja hogyan.
- Az AST és ALT emelkedése – ki tudja miért.
Akut toxicitás és túladagolás
- A fő akut mellékhatás a vérzés. Nagyon kevés ember valóban allergiás a heparinra.
- A bőr nekrózisa előfordulhat a szubkután injekció beadási helyein a kis erek trombózisa miatt.
Az akut toxicitás kezelése
Ha valaki túladagolta a heparinizálást, az APTT drámaian megemelkedik, és mya valamilyen vérzéses szövődmény lép fel. Az ember azon kaphatja magát, hogy azt gondolja: “Bárcsak vissza tudnám rakni a véralvadási kaszkádot”. Ezt protaminnal lehet elérni.
A HEPARINIZÁCIÓ VISSZAfordítása protamin-szulfáttal
- 1mg 100 egységet fordít vissza
- Nem adható egyszerre 50mg-nál több
- Lassan, intravénás infúzióként
A protamin veszélyei
A protamin-szulfát messze nem jóindulatú. Ez egy idegen, szokatlan anyag – egy erősen lúgos polipeptid, amely irreverzibilisen kötődik az erősen savas heparinhoz, és ezáltal csökkenti annak antikoaguláns hatását az antitrombin-3-ra. Nevetséges dózisokban azonban maga a protamin is véralvadásgátlóként hat.
Számos káros hatása között a következők szerepelnek:
- Katasztrofális hipotenzió az értágulat miatt, amely szerencsére rövid ideig tart (csak kb. 3-4 percig) – úgy tűnik, hogy ez a szisztémás hisztamin felszabadulás eredménye, amelyet valamilyen közvetlenül komplementer-aktiváló módon a keringésben lévő heparin-protamin komplexek váltanak ki
- Pulmonális hipertónia a tromboxán lokális érösszehúzó hatása miatt, aktiválódik a protaminra adott anafilaktoid reakció által
- Anafilaxia (elvégre haltermékről van szó)
Rezisztencia a heparinterápiával szemben
Vannak olyan helyzetek, amikor a hatalmas mennyiségű intravénás heparin minden erőfeszítése ellenére sem képes növelni az APTT-t. Ezt nevezhetjük “heparinrezisztenciának”, vagy “heparinérzékenységnek”.
Egy heparinnal szembeni rezisztencia több okból is kialakulhat:
- Növekedett heparinkötő fehérjeszint (mindegyik akut fázisreaktáns)
- alacsony antitrombin-III szint (ill.azaz nincs mit megkötnie a heparinnak)
- Növekedett heparin clearance (pl. májbetegségben)
- Nagy VIII-as faktor szint
Az UpToDate egy jó cikket kínál az antitrombin III hiányról. Vagy öröklődően nem tudsz belőle eleget szintetizálni, vagy a májad annyira károsodott, hogy nem tud eleget termelni. Vagy valahogyan elhasználódott, pl. DIC, MAHA, vagy bypass körfolyamat kapcsán. Végül, lehetséges, hogy más fehérjékkel együtt a szivárgó nefrotikus vesén keresztül veszíti el.
Az AT-III hiány kezelése, előre láthatóan, az AT-III pótlása.
Ha a drága tisztított faktor nem áll rendelkezésre, az FFP is elegendő.
A heparinrezisztens beteg hatékony véralvadása
Többféle stratégiát is alkalmazhatunk. A konkrét választás attól függ, hogy pontosan mi okozza a heparinrezisztenciát.
Ezzel kapcsolatban van néhány jó cikk. A legtöbbjük nem érinti néhány véletlenszerűen kiválasztott beteg rutinszerű antikoagulációját, akinek történetesen eszkalálódó heparinadagjai vannak; feltételezem, hogy általában azt feltételezik, hogy az ember addig folytatja a dózis eszkalálását, amíg a terápiás célokat el nem éri. Vannak azonban olyan helyzetek, amikor az antikoaguláció kritikusan fontos, és az egyik ilyen forgatókönyv a kardiopulmonális bypass-kör.
– Váltson alacsony molekulájú heparinra a frakcionálatlan heparin helyett
– Adjon krioprecipitátumot és/vagy friss fagyasztott plazmát (ha igazolt ATIII-hiány áll fenn )
– Adjon antitrombin III koncentrátumotVagy megfontolhatja valami más, például egy direkt trombin inhibitor (hirudin vagy argobatran)
alkalmazását.
- Immun-mediált trombocitopéniát jól tárgyalta Franchini 2005-ben




Leave a Reply