8.3: Gázok és nyomás
Tanulási célok
- A gázfázis leírása.
A gázfázis egyedülálló az anyag három halmazállapota között, mivel van néhány egyszerű modell, amellyel minden gáz fizikai viselkedését meg tudjuk jósolni – függetlenül azok azonosságától. A szilárd és folyékony halmazállapotok esetében ezt nem tudjuk megtenni. Valójában a gázok viselkedésének e megértése jelenti a történelmi választóvonalat az alkímia és a modern kémia között. A gázok viselkedésének megértésében a kezdeti előrelépéseket az 1600-as évek közepén Robert Boyle angol tudós tette, aki megalapította a Royal Society-t (a világ egyik legrégebbi tudományos szervezetét).
Hogyan lehetséges, hogy minden gázt a kémiai identitásától függetlenül modellezni tudunk? A válasz a gázok kinetikai elméletének nevezett állításcsoportban rejlik:
- A gázok apró részecskékből állnak, amelyeket nagy távolságok választanak el egymástól.
- A gázrészecskék folyamatosan mozgásban vannak, ütköznek más gázrészecskékkel és a tartályuk falával.
- A gázrészecskék sebessége összefügg a gáz hőmérsékletével.
- A gázrészecskék nem tapasztalnak egymással semmilyen vonzó vagy taszító erőt.
Észrevetted, hogy ezen állítások egyike sem kapcsolódik a gáz azonosságához? Ez azt jelenti, hogy minden gáznak hasonlóan kell viselkednie. Azt a gázt, amely tökéletesen követi ezeket az állításokat, ideális gáznak nevezzük. A legtöbb gáz enyhe eltérést mutat ezektől az állításoktól, ezért valódi gázoknak nevezzük őket. A valódi gázok létezése azonban nem csökkenti a gázok kinetikai elméletének fontosságát.
A kinetikai elmélet egyik állítása említi az ütközéseket. Mivel a gázrészecskék folyamatosan mozognak, folyamatosan ütköznek egymással és a tartályuk falával is. Erők lépnek fel, mivel a gázrészecskék visszapattannak a tartály faláról (\(\PageIndex{1}\) ábra). A gázrészecskék által keltett erő és a tartály falának területe osztva adja a nyomást. A nyomás olyan tulajdonság, amelyet a gázok esetében mérni tudunk, de a szilárd vagy folyékony anyagok esetében általában nem vesszük figyelembe a nyomást.
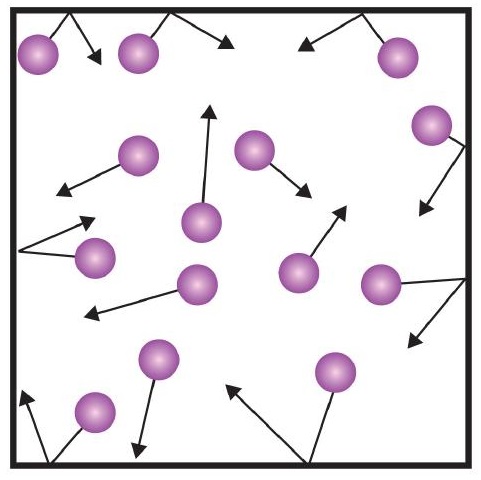
A nyomás alapegysége a newton per négyzetméter (N/m2). Ezt a kombinált egységet pascal (Pa) néven definiálják újra. Egy pascal nem túl nagy nyomás. A nyomás hasznosabb mértékegysége a bar, amely 100 000 Pa (1 bar = 100 000 Pa). Más elterjedt nyomásegységek az atmoszféra (atm), amelyet eredetileg a földi légkör átlagos nyomásaként határoztak meg a tengerszinten; és a mmHg (milliméter higany), amely az 1 mm magas higanyoszlop által keltett nyomás. A higanymilliméter egységet torrnak is nevezik, nevét Evangelista Torricelli olasz tudósról kapta, aki az 1600-as évek közepén feltalálta a barométert. A légkör pontosabb meghatározása torrban kifejezve az, hogy 1 atm-ban pontosan 760 torr van. Egy bar 1,01325 atm-nak felel meg. Tekintettel a nyomásegységek közötti összefüggésekre, az egyik nyomásegységről a másikra való átváltás képessége hasznos készség.
Példa \(\PageIndex{1}\): Nyomások átváltása
Az átváltási tényező megírása annak meghatározására, hogy hány atmoszféra van 1,547 mmHg-ban.
Megoldás
Mivel 1 mmHg egyenlő 1 torrral, az adott nyomás is egyenlő 1,547 torrral. Mivel 1 atm-ban 760 torr van, ezzel az átváltási tényezővel elvégezhetjük a matematikai átváltást:
\(\mathrm{1,547\: torr\times \dfrac{1\: atm}{760\: torr}=2.04\: atm}\)
Jegyezzük meg, hogy a torr egységek algebrailag kioltják egymást.
gyakorlat \(\PageIndex{1}\): Nyomások átváltása
Írd meg egy átváltási tényezőt annak meghatározására, hogy hány milliméter higany van 9,65 atm-ban.
Válasz
\(\mathrm{9,65\: atm\times \dfrac{760\: mm Hg}{1\: atm}=7,334 \: mm Hg}\).
A kinetikai elmélet is azt állítja, hogy az egyes gázrészecskék között nincs kölcsönhatás. Bár tudjuk, hogy a valódi gázokban valójában vannak molekulák közötti kölcsönhatások, a kinetikai elmélet feltételezi, hogy a gázrészecskék olyan távol vannak egymástól, hogy az egyes részecskék nem “érzik” egymást. Így a gázrészecskéket olyan apró anyagdarabkáknak tekinthetjük, amelyek azonossága nem fontos bizonyos fizikai tulajdonságok szempontjából.
Koncepció áttekintő gyakorlat
-
Mi a nyomás, és milyen mértékegységeket használunk a kifejezésére?
Válasz
-
A nyomás az egységnyi területre jutó erő; mértékegysége lehet pascal, torr, higanymilliméter vagy atmoszféra.
Főbb tanulságok
- A gázfázisnak vannak bizonyos, az adott fázisra jellemző általános tulajdonságai.
GYakorlatok
-
Mi a gázok kinetikai elmélete?
-
A gázok kinetikai elmélete szerint az egyes gázrészecskék (mindig, gyakran, soha) mozgásban vannak.
-
Miért gyakorol nyomást egy gáz?
-
Miért engedi a gázok kinetikai elmélete feltételezni, hogy minden gáz hasonló viselkedést mutat?
-
Az alábbi nyomásmennyiségeket a legkisebbtől a legnagyobbig sorrendbe állítjuk: 1 mmHg, 1 Pa és 1 atm.
-
Melyik nyomásegység a nagyobb – a torr vagy a légkör?
-
Hány torr van 1 atm-ban.56 atm?
-
760 torr-t alakítsuk át pascalra.
-
A vérnyomást higanymilliméterben fejezzük ki. Mekkora lenne a vérnyomás atmoszférában kifejezve, ha egy beteg szisztolés vérnyomása 120 mmHg, diasztolés vérnyomása pedig 82 mmHg? (Az orvostudományban az ilyen vérnyomást “120/82”-ként jelentenék, amit úgy beszélnek, hogy “százhúsz per nyolcvankettő”.)
-
Az időjárás-előrejelzésben a barometrikus nyomást higanycentiméterben (in. Hg) fejezik ki, ahol minden 1 in. Hg-ben pontosan 25,4 mmHg van. Mekkora a barometrikus nyomás higanymilliméterben, ha a barometrikus nyomást 30,21 in. Hg-nek jelentik?
Válaszok
-
A gázok apró részecskékből állnak, amelyeket nagy távolság választ el egymástól. A gázrészecskék folyamatosan mozgásban vannak, ütköznek más gázrészecskékkel és a tartályuk falával. A gázrészecskék sebessége összefügg a gáz hőmérsékletével. A gázrészecskék nem tapasztalnak egymással semmilyen vonzó vagy taszító erőt.
-
A gáz nyomást gyakorol, mivel részecskéi visszapattannak a tartály faláról.
-
1 Pa, 1 mmHg és 1 atm
-
1,190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
Leave a Reply