Frontiers in Plant Science
Die verschiedenen Arten der Heterochronie
In den 1870er Jahren identifizierte Ernst Haeckel zeitliche und räumliche Veränderungen in der Entwicklung eines Nachkommen im Vergleich zu seinem Vorfahren als die beiden wichtigsten Mechanismen für die Evolution (Haeckel, 1875). Haeckel bezeichnete die räumlichen Veränderungen als Heterotopie und die zeitlichen Veränderungen als Heterochronie.
Die Bedeutung von Heterochronie hat sich jedoch geändert, seit Haeckel den Begriff erstmals prägte. Haeckel verwendete den Begriff Heterochronie für Abweichungen von seinem bekannten „Biogenetischen Gesetz“, das besagt, dass die Abfolge der Entwicklungsereignisse (Ontogenese) die Abfolge der Ereignisse in der Evolutionsgeschichte der Art (Phylogenese) weitgehend rekapituliert (Haeckel, 1875). Ursprünglich bezog sich Heterochronie also auf eine Veränderung des Zeitpunkts des Auftretens eines Merkmals in der Entwicklungsfolge eines Organismus im Vergleich zu der in der Phylogenie des Organismus aufgetretenen Abfolge. Mitte des 20. Jahrhunderts entkoppelte De Beer (1951) die Heterochronie von der Rekapitulation. Er verwendete Heterochronie zur Bezeichnung von Unterschieden im Zeitablauf von Entwicklungsereignissen beim Vergleich zweier verwandter Arten, um zu erklären, wie Heterochronie zur Vielfalt unter den Organismen führen kann. Gould (1977) brachte das Konzept der Heterochronie wieder mit der Rekapitulation in Verbindung und definierte Heterochronie als „Veränderungen in der relativen Zeit des Auftretens und der Entwicklungsgeschwindigkeit von Merkmalen, die bereits bei den Vorfahren vorhanden waren“, wobei er den Schwerpunkt auf Veränderungen in der relativen Größe und Form legte und nicht auf den Zeitpunkt von Entwicklungsereignissen, um Heterochronie zu erkennen. Zu Beginn des 21. Jahrhunderts schlug Smith vor, dass es sinnvoller wäre, zwei Arten von Heterochronie zu definieren: „Wachstumsheterochronie“, die Veränderungen in der endgültigen Größe und Form betont, und „Sequenzheterochronie“, die näher an der ursprünglichen Verwendung von Haeckel und de Beer liegt und eine Erklärung der phänotypischen Variation durch Veränderungen im Timing von Entwicklungsereignissen ermöglicht (Smith, 2002, 2003; Keyte und Smith, 2014).
Sequenzheterochronie (im Folgenden als „Heterochronie“ bezeichnet) kann in zwei Kategorien eingeteilt werden: Pädomorphose und Peramorphose. Im Vergleich zur Entwicklung der Vorfahren führt die Pädomorphose zu einem jugendlichen oder einfachen Ergebnis, während die Peramorphose zu einem erwachsenen oder komplexeren Phänotyp führt. Jede dieser beiden Kategorien von Heterochronie kann aus einer Variation des Zeitpunkts des Beginns, der Verschiebung oder der Geschwindigkeit eines Entwicklungsprozesses resultieren, wie von Alberch et al. (1979) vorgeschlagen. Diese Variation kann zu 6 verschiedenen Arten von Heterochronie führen (Abbildung 1). Die Pädomorphose kann das Ergebnis eines verfrühten Endes eines Entwicklungsprozesses (Progenese), eines verzögerten Beginns des Prozesses (Postdisplacement) oder einer langsameren Entwicklungsgeschwindigkeit (Neotenie) sein. Peramorphose ist das Ergebnis einer verlängerten Entwicklungszeit aufgrund eines späteren Endes (Hypermorphose) oder eines früheren Beginns (Vorverlagerung) oder einer höheren Entwicklungsgeschwindigkeit (Beschleunigung) (Abbildung 1A). Hypothetische Beispiele für Peramorphose und Paedomorphose in der pflanzlichen Embryogenese und vegetativen Entwicklung sind in den Abbildungen 1B und C dargestellt.
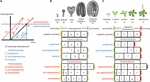
Abbildung 1. Arten der Heterochronie. (A) Schematische Darstellung der 6 Arten von Heterochronie. Die schwarze Linie stellt die Zeit dar, die erforderlich ist, um ein bestimmtes Entwicklungsstadium in der ursprünglichen Ontogenese zu erreichen. Die blauen Linien zeigen die 3 Arten der Pädomorphose: Progenese (frühzeitiger Versatz), Postdisplacement (verzögerter Beginn) und Neotenie (langsamere Entwicklungsrate). Rote Linien zeigen die 3 Arten der Peramorphose: Hypermorphose (verzögerter Versatz), Vorverlagerung (frühzeitiger Beginn) und Beschleunigung (höhere Entwicklungsgeschwindigkeit). Die Zeichnung in (A) basiert auf Alberch et al. (1979) und Geuten und Coenen (2013). (B) Heterochronie-Szenarien für die Embryogenese. Die Embryogenese von Arabidopsis wird hier als hypothetische Vorläuferentwicklung betrachtet, die zur Veranschaulichung in vier Stadien unterteilt ist. Ein fünftes Stadium, in dem der Embryo die ersten beiden Blätter und die beiden Keimblätter hervorgebracht hat (als embryonaler Keimling bezeichnet), wird als Endstadium der peramorphen Embryogenese vorgeschlagen, während die pädomorphe Embryogenese voraussichtlich im Herzstadium endet. (C) Heterochronie-Szenarien für die vegetative Entwicklung. In diesem Fall stellt die vegetative Entwicklung von Arabidopsis, bei der die Pflanze vor der Blüte weiterhin kauline/reproduktive Blätter am Stamm produziert (oben eingezeichnet), einen hypothetischen Fall von peramorpher vegetativer Entwicklung dar, verglichen mit einem hypothetischen Vorfahren, der im Erwachsenenstadium blüht, ohne kauline Blätter zu produzieren. Bei der pädomorphen vegetativen Entwicklung wird vorausgesagt, dass die Pflanzen im Jugendstadium blühen.
Während diese Klassifizierungen nützlich sind, um Veränderungen im Entwicklungszeitpunkt zu veranschaulichen, ist es bei realen Beispielen oft schwierig, zwischen verschiedenen Arten von Heterochronie zu unterscheiden. In vielen Fällen kann die Evolution zu verschiedenen Arten von Heterochronie führen, die jeweils in einem bestimmten Stadium eines Entwicklungsprozesses auftreten (Li und Johnston, 2000).
Heterochronie in der Evolution und Diversifizierung von Pflanzen
Landpflanzen (Embryophyten) haben seit ihrer Entstehung in der Mitte des Erdoviziums vor etwa 470 Millionen Jahren viele morphologische Innovationen erfahren. Frühe divergierende Linien entstanden über einen Zeitraum von mehr als 100 Millionen Jahren, während des Silur und des frühen Devon (Kenrick und Crane, 1997; Pires und Dolan, 2012; Harrison und Morris, 2018). Embryophyten entwickelten sich aus einem Süßwasseralgenvorläufer, der mit den heutigen Charophytengruppen Charales, Coleochaetales und Zygnematales verwandt war. Der Übergang zum Wachstum an Land, wie er bei den Bryophyten (Hornmoose, Moose und Lebermoose) zu beobachten ist, beinhaltete die Entstehung von Sporen, den Wechsel von Gametophyten- und Sporophytengenerationen, einachsige Formen und dreidimensionales Wachstum. Zu den Innovationen der terrestrischen Gefäßpflanzen (Lycophyten, Monilophyten und Spermatophyten) gehörten Bifurkation, Unbestimmtheit, Sporophytendominanz, axilläre Verzweigung und die Bildung von Meristemen, Blättern und Wurzeln (Harrison, 2017).
Einige der oben genannten Evolutionsschritte wurden mit Heterochronie in Verbindung gebracht. Für den Ursprung der Sporogenese legen Daten von Moospflanzen nahe, dass Sporen direkt aus Zygoten in einem Prozess erzeugt wurden, der eine frühzeitige Zytokinese, eine Beschleunigung der Meiose und eine verzögerte Wandablagerung von der Zygote zu den Meiosporen beinhaltet (Brown und Lemmon, 2011). Der verzweigte Sporophyt (Polisporangiophyt) hat sich, so die Hypothese, durch ein verlängertes vegetatives Wachstum der apikalen Zelle entwickelt. Dieser längere Zeitraum des vegetativen Wachstums soll zu einer verlängerten Embryonalachse, einer Verzweigung des Sprosses und einer Verzögerung des Übergangs zum reproduktiven Wachstum führen, wodurch das Sporangium entsteht (Rothwell et al., 2014; Tomescu et al., 2014). Weitere Untersuchungen von Pflanzenfossilien sollten mehr Beweise für alte Pflanzenmorphologien liefern, die einen Vergleich zwischen heutigen und ausgestorbenen Formen ermöglichen würden (Rothwell et al., 2014).
In lebenden Pflanzen wurden heterochrone Veränderungen in der Gametophytenentwicklung, Embryogenese, vegetativen Entwicklung, Sprossreifung und Blütenmorphogenese festgestellt. Der weibliche Gametophyt von Gnetum unterscheidet sich strukturell von anderen Pflanzen, da der Zeitpunkt der Befruchtung und der somatischen Entwicklung unterschiedlich ist. Zeitliche Veränderungen in der Zellzyklusprogression haben zu unterschiedlichen zeitlichen Mustern der Spermatogenese und Gametenfusion während der Befruchtung beigetragen (Friedman, 1999; Tian et al., 2005). Im Falle der Progenese erfolgt die Befruchtung in einem freien Kernstadium der somatischen Entwicklung, einem juvenilen Stadium im Vergleich zur somatischen Ontogenese der Vorfahren, was die Differenzierung der Eizellen ausschließt (Friedman und Carmichael, 1998). Die apomiktische Entwicklung der Eizellen von Boechera wurde mit heterochronen Genexpressionsmustern im Vergleich zu nicht-apomiktischen (sexuellen) Eizellen in Verbindung gebracht (Sharbel et al., 2010). Die Entwicklung von Rafflesiaceae, einer holoparasitischen Pflanzenfamilie, die Weinreben infiziert, zeigt zwei heterochrone Verschiebungen: einen Stillstand im Proembryonalstadium, der als Beispiel für Neotenie angesehen werden kann, und eine Beschleunigung des Übergangs vom undifferenzierten Endophyten zur Blüte, wobei die vegetative Sprossreifung übersprungen wird (Nikolov et al, 2014).
Eine QTL-Analyse (Quantitative Trait Loci), die Eucalyptus globulus-Populationen mit frühem vegetativem Phasenwechsel und Populationen vergleicht, in denen der vegetative Phasenwechsel mehrere Jahre verzögert ist, identifizierte die Expression der microRNA EglMIR156.5 als verantwortlich für die heterochrone Variation des vegetativen Phasenwechsels bei E. globulus (Hudson et al., 2014). Eine weitere QTL-Analyse ergab, dass Heterochronie für die natürliche Variation der Blattform von Cardamine hirsuta verantwortlich ist (Cartolano et al., 2015). Die QTL-Kartierung ergab, dass der Effekt durch eine cis-regulatorische Variation des Blütenrepressors ChFLC verursacht wird, so dass Populationen mit ChFLC-Allelen mit geringer Expression sowohl eine frühe Blüte als auch einen beschleunigten Erwerb von Merkmalen erwachsener Blätter, insbesondere eine erhöhte Anzahl von Fiederblättchen, aufweisen. Morphometrische und QTL-Analysen haben ergeben, dass heterochrone Mutationen zur natürlichen Variation bei Antirrhinum und zur Heteroblastie bei Weinreben beitragen (Costa et al., 2012; Chitwood et al., 2016). Eine Hauptkomponentenanalyse (PCA) der ontogenetischen Entwicklung der Blattform bei den drei Gattungen der Marsileaceenfarne (Marsilea, Regnellidium und Pilularia) deutet darauf hin, dass sie im Vergleich zur komplexeren Entwicklung der Vorfahren einen pädomorphen Phänotyp aufweisen, der durch eine beschleunigte Wachstumsrate und ein frühes Ende der vereinfachten Blattform verursacht wird (Pryer und Hearn, 2009).
Die evolutionäre Vielfalt in der Blütenstandarchitektur der Nachtschattengewächse wird durch heterochrone Verschiebungen beim Erwerb des Blütenschicksals moduliert (Lippman et al., 2008; Park et al., 2012). Ein Vergleich der Transkriptome der Meristemreifung von fünf domestizierten und wilden Solanaceae-Arten ergab eine Spitze der Expressionsdivergenz, die dem Modell der „umgekehrten Sanduhr“ für die tierische Embryogenese ähnelt, das besagt, dass eine Divergenzperiode in der Mitte der Entwicklung die morphologische Variation vorantreibt (Lemmon et al., 2016). Bei Gräsern führt eine Verzögerung des Übergangs vom Sprossmeristem (SM) zum Blütenmeristem (FM) zu komplexeren Rispen (Kyozuka et al., 2014). Pappeln (Populus sp.) und Weiden (Salix sp.) tragen kompakte eingeschlechtliche Blütenstände, die als „Kätzchen“ bekannt sind und von denen man annimmt, dass sie sich aus einer Vereinfachung der Rispenform durch einen frühen Übergang vom SM zum FM entwickelt haben (Cronk et al., 2015). Heterochrone Veränderungen haben auch zur natürlichen Variation in der Blütezeit und der Sprossarchitektur zwischen den Populationen von Mimulus guttatus beigetragen (Baker und Diggle, 2011).
Die morphologische Vielfalt des Perianths bei Dipsacoideae wird durch heterochrone Veränderungen in der Organinitiierung verursacht, insbesondere in der Anzahl der Sepalen (Naghiloo und Claßen-Bockhoff, 2017). Die große Formvielfalt der Kelchblätter bei Iris-Arten ist eher auf Heterochronie als auf heterotopische Veränderungen zurückzuführen (Guo, 2015). Eine Studie an Brassicaceae zeigte, dass die Evolution der Monosymmetrie der Blumenkrone aus der polysymmetrischen Vorgängerblüte eine heterochrone Verschiebung der Expression von CYC2-Genen (einer Gruppe von TCP-Transkriptionsfaktoren) von einer frühen adaxialen Expression in den Vorgängerblütenmeristemen zu einer späteren adaxialen Expression in der Blütenblattentwicklung beinhaltete (Busch et al., 2012). Die heterochrone, aber nicht heterotope CYC2-Expression wurde auch mit dem Verlust papillarer, konischer Zellen in den Blütenblättern und einer Umstellung auf das Vogel-Bestäubungssystem bei Lotus in Verbindung gebracht (Ojeda et al., 2017). Eine pädomorphe Morphologie, bei der die Blüten reifen Pollen in ungeöffneten knospenähnlichen Strukturen halten, führte zu einer spezialisierten Bestäubung in einer Klade von Madagaskar-Reben (Euphorbiaceae) (Armbruster et al., 2013). Die Entwicklung des kleistogamen Capitulums aus einem chasmogamen Vorzustand ist ein klassisches Beispiel für Pädomorphose, da die kleistogame Form juvenile Merkmale aufweist (Lord und Hill, 1987). Bei den Asteraceae entwickelte sich die Kleistogamie speziell durch Vorverlagerung und Nachkommenschaft der Blütenentwicklung sowie durch Neotenie aller Wirtel außer dem Gynoeceum (Porras und Muñoz, 2000). Die Vielfalt der Blütenmorphologie bei Jaltomata, einer Gattung der Nachtschattengewächse (Solanaceae), ist auf die Hypermorphose und die Beschleunigung einiger Korolla-Merkmale zurückzuführen (Kostyun et al., 2017). Die Vielfalt der Schmetterlingsorchideen auf den Azoren ist ebenfalls auf florale heterochrone Verschiebungen zurückzuführen (Bateman et al., 2014). Kürzlich betonte Ronse de Craene (2018) die Bedeutung der Heterochronie für drei Entwicklungsprozesse: Phyllotaxis, die Entwicklung gemeinsamer Staubblatt-Primordien und Obdiplostemie, wobei er Änderungen der Wachstumsrate mit einer verzögerten Organinitiierung in Verbindung brachte. Heterochrone Wachstumsraten des Perianths und des Griffels sowie eine frühe Verlängerung des Hypanthiums sind für die große Artenvielfalt innerhalb der morphologisch homogenen Gattung Eugenia verantwortlich (Vasconcelos et al., 2018). Schließlich ist die heterochrone Expression des fw2.2-Allels, das die Zellteilung in der frühen Fruchtentwicklung beeinflusst, für die natürliche Variation in der Tomatenfruchtgröße verantwortlich (Cong et al., 2002).
Studying Heterochronic Mutants to Elucidate Genetic Control of Timing
Die Untersuchung von Mutanten, die in der Entwicklungszeit beeinträchtigt sind, hat Licht auf genetische Wege geworfen, die die Morphogenese und Entwicklungsübergänge kontrollieren. Heterochronie kann durch eine frühere oder spätere Aktivierung oder Unterdrückung dieser Wege verursacht werden.
Leafy cotyledon (lec), dicer-like1 (dcl1) und extra cotyledon (xtc) Mutanten von Arabidopsis thaliana stellen heterochrone Phänotypen dar, die dazu beigetragen haben, Programme zur Samenreifung zu definieren. lec-Mutanten produzieren Keimblätter mit Merkmalen der Blattidentität (Meinke, 1992), ein klares Beispiel für Homöose: der Ersatz einer Struktur durch eine andere. Allerdings ist es oft schwierig, zwischen Homöose und Heterochronie zu unterscheiden, da Homöose sowohl das Ergebnis von Heterochronie als auch von Heterotopie sein kann (Li und Johnston, 2000; Geuten und Coenen, 2013). Während der späten Embryogenese fördert LEC2 die Samenreifung und unterdrückt die postembryonale Identität (Stone et al., 2008). Wie lec-Mutanten zeigen auch dcl1-Mutanten peramorphe Phänotypen während der Embryogenese, da die Chloroplastenentwicklung und die Expression von Genspeicherproteinen im Samen früher als in Wildtyp-Embryonen stattfindet. DCL1 ist für die Biogenese von microRNAs erforderlich, die die Samenreifung durch die Hauptregulatoren LEC2 und FUSCA3 unterdrücken (Nodine und Bartel, 2010; Willmann et al., 2011). Die Mutanten xtc1, xtc2 und veränderte Meristemprogrammierung1 (amp1) zeigen einen homöotischen Phänotyp, bei dem die ersten ein oder zwei Blätter zu Keimblättern werden (Conway und Poethig, 1997). Bei diesen drei Mutanten ist der Übergang von der Kugel- zur Herzform verzögert, was zu einem vergrößerten Sprossmeristem führt, das während der Embryogenese zusätzliche Organe bildet. Dieser Phänotyp kann als Hypermorphose, eine Art Peramorphose, interpretiert werden, da sich die Embryonalentwicklung zu einer stärker entwickelten Form ausweitet (wie das peramorphe Szenario in Abbildung 1B). Wenn jedoch die vegetative Entwicklung als Bezugspunkt gewählt wird, würden lec-Mutanten einen Fall von Vorverlagerung (Peramorphose) darstellen, und xtc1, xtc2 und amp1 würden eine Nachverlagerung (Pädomorphose) beim Erwerb der Blattidentität darstellen. AMP1 ist für die miRNA-vermittelte Translationsunterdrückung an der ER-Membran erforderlich (Li et al., 2013).
Die genetische Regulierung des Übergangs von der Jugend- zur Erwachsenenphase, auch vegetativer Phasenwechsel genannt, wurde sowohl mit pädomorphen als auch mit peramorphen Mutanten untersucht. Screenings nach Mutanten, die einen frühen adulten (peramorphen) Phänotyp zeigen, ergaben Allele von Genen, die mit der Biogenese kleiner RNAs zusammenhängen, wie zippy/ago7, sgs3 und rdr6 (Hunter et al., 2003; Peragine et al., 2004), während Mutanten mit einem späten adulten (paedomorphen) Phänotyp auf erhöhte miRNA-Spiegel zurückzuführen sind (Gillmor et al., 2014; Xu M. et al., 2016, 2018; Guo et al., 2017). Die genetische Grundlage für diese Phänotypen wird durch eine veränderte Expression der eng verwandten microRNAs miR156 und miR157 erklärt, den Hauptregulatoren der vegetativen Phasenveränderung, die SPL-Transkriptionsfaktoren sowohl auf Transkriptions- als auch auf Translationsebene in einer schwellenwertabhängigen Weise unterdrücken (Wu und Poethig, 2006; Chuck et al., 2007; Poethig, 2013; He et al., 2018). Sowohl MIR156 als auch die SPL-Genfamilien werden direkt durch epigenetische Markierungen reguliert: MIR156 wird durch H3K4me3 und H3K4ac aktiviert, die durch den SWR1-C-Komplex und den Chromatin-Remodeler BRAHMA gefördert werden, und wird durch H3K27me3 unterdrückt, das durch die Polycomb-Proteine SWINGER und CURLY LEAF sowie den Chromatin-Remodeler PICKLE gefördert wird (Xu M. et al., 2016; Xu Y. et al., 2016; Xu M. et al., 2018). SPL-Gene werden durch Histonacetylierung aktiviert, die durch den SAGA-ähnlichen Komplex vermittelt wird, und durch H2AUb unterdrückt, das durch die Polycomb-Proteine RING1A und RING1B vermittelt wird (Kim et al., 2015; Li et al., 2017). Die Untersuchung von Pflanzen mit Funktionsverlust oder -gewinn von SPL-Genen hat auch einen endogenen Blühweg definiert, bei dem einige SPL-Gene die Expression von miR172 fördern, was wiederum die Blüte fördert, indem es die Blührepressoren der APETALA2-Familie unterdrückt (Wang et al., 2009; Wu et al., 2009; Huijser und Schmid, 2011).
Neben den großen Entwicklungsübergängen kann die Morphogenese von Organen auch durch die heterochrone Aktivierung von genetischen Regulatoren beeinflusst werden. So führt beispielsweise die frühe Keimung von Brassica rapa-Embryonen zu Organen mit einem Mosaik aus Keimblatt- und Blattidentität (Fernandez, 1997), und die unterschiedliche zeitliche Expression der Klasse II der TEOSINTE BRANCHED1/CYCLOIDEA/PROLIFERATION CELL FACTOR (TCP)-Gene führt zu Blättern mit unterschiedlicher Größe und Form (Efroni et al, 2008).
Mechanismen, die Änderungen des Entwicklungszeitpunkts in Pflanzen antreiben (transkriptionelle, metabolische und zelluläre Heterochronie)
Transkriptionelle Heterochronie bezieht sich auf eine Änderung des Zeitpunkts der Aktivierung oder Unterdrückung der Genexpression und wird oft durch Änderungen in cis-regulatorischen Genregionen verursacht (Pham et al., 2017). Transkriptionelle Heterochronie in den oben erwähnten genetischen Pfaden ist eine gängige Methode zur Erzeugung heterochroner Phänotypen. Die metabolische Kontrolle von Stoffwechselwegen, die Entwicklungsübergänge regulieren (hier als „metabolische Heterochronie“ bezeichnet), und die zeitliche Kontrolle von Zellproliferation, Zellexpansion und Zelldifferenzierung (hier als „zelluläre Heterochronie“ bezeichnet) sind weitere Mechanismen, die Heterochronie in Pflanzen antreiben (Abbildung 2). Transkriptions-, Stoffwechsel- und zelluläre Prozesse sind miteinander verbunden, so dass der molekulare Ursprung der Heterochronie auf eine Kombination von Mechanismen zurückzuführen sein kann.

Abbildung 2. Mechanismen, die Heterochronie in Pflanzen antreiben. (A) Zelluläre Heterochronie. Dargestellt ist die Abfolge der Rosettenblätter, die während der vegetativen Entwicklung entstehen. Der Phänotyp der Arabidopsis-Columbia-Wildtyp-Pflanzen wird als hypothetischer Vorgängerzustand angenommen; ein pädomorphes Szenario (Neotenie) und ein peramorphes Szenario (Beschleunigung) sind ebenfalls dargestellt. Die Pfeile stellen die Richtung der Welle des Zellteilungsstopps in einem basipetalen Gradienten dar, wobei sich die Zellen unterhalb der gestrichelten Linie noch aktiv teilen, während die Zellen oberhalb expandieren und/oder sich differenzieren. (B) Transkriptionelle und metabolische Heterochronie. Eine grafische Darstellung der vorhergesagten Häufigkeit der microRNA miR156/7 und ihrer Ziele, der SPL-Gene, sowie der Zuckerhäufigkeit entlang der Zeit der vegetativen Entwicklung, entsprechend den Phänotypen in (A). Die gestrichelten Linien stellen den Schwellenwert der miR156/7- und SPL-Häufigkeit dar, der zur Jugendlichkeit (oberhalb des Schwellenwerts) oder zum Erwachsenenalter (unterhalb des Schwellenwerts) führt. In diesem Fall führt eine Verzögerung der Unterdrückung von miR156 und der Aktivierung der SPL-Expression und der Zuckerproduktion zur Pädomorphose, während ein frühzeitiger Abfall von miR156 und eine frühe Aktivierung der SPL-Expression und der Zuckerproduktion zur Peramorphose führen. Bei diesen Zeichnungen handelt es sich um vereinfachte Darstellungen, die nicht die genauen Häufigkeiten in der Natur widerspiegeln. Das tatsächliche Muster der miR156/SPL-Häufigkeit ist näher an dem für den Zustand „Peramorphose“ dargestellten Muster.
Metabolische Heterochronie kann durch Hormone, Zucker und Redox-Signale beeinflusst werden (Jia et al., 2017). Unterschiedliche Biosynthese, Transport und Wahrnehmung von Hormonen wie Auxin, Jasmonsäure (JA), Gibberellin und Abscisinsäure beeinflussen die Heterochronie, indem sie Regulatoren von Entwicklungsprozessen steuern. So verzögern beispielsweise Mutanten in den AUXIN RESPONSE FACTORS (ARF) ARF3 und ARF4 den Übergang zum Erwachsenen (Fahlgren et al., 2006; Hunter et al., 2006), und die Auxin-Homöostase steuert den Übergang von der Erhaltung der Blütenstammzellen zur Bildung des Gynoeceums (Yamaguchi et al., 2017). Exogenes JA kann den adulten Übergang verzögern, indem es den Rückgang der miR156-Expression aufschiebt (Beydler et al., 2016), und Gibberellin beschleunigt die Blüte, indem es SPL-Gene aus der Unterdrückung durch DELLA-Proteine freisetzt (Yu et al., 2012). Der Ernährungszustand wird seit dem frühen 20. Jahrhundert mit der Kontrolle des Wechsels der vegetativen Phase in Verbindung gebracht (Goebel, 1908). Der durch die Photosynthese produzierte Zucker ist für den Erwerb erwachsener Merkmale notwendig und ist teilweise für den Rückgang der miR156-Expression in der späten vegetativen Entwicklung verantwortlich (Yang et al., 2013; Yu et al., 2013; Buendía-Monreal und Gillmor, 2017). HEXOKINASE1 (HXK1) und Trehalose-6-Phosphat (T6P) sind wichtig für die zuckervermittelte Unterdrückung von miR156 und fördern dadurch den vegetativen Phasenwechsel und die Blüte (Wahl et al., 2013; Yang et al., 2013).
Auf zellulärer Ebene besteht die Organogenese aus einer Abfolge von drei Phasen: der Etablierung der Polarität, der Zellproliferation und der Zellexpansion (Walcher-Chevillet und Kramer, 2016). Der Zeitpunkt des Beginns und der Beendigung dieser Phasen ist entscheidend für die Größe und Form der Organe, und eine Heterochronie in dieser Abfolge führt zu einer Diversifizierung der Organgröße und -form (Abbildung 2). Der Übergang von der Zellproliferation zur Zellexpansion und -differenzierung erfordert eine Koordination zwischen dem Zellzyklus und dem Zellwachstum (Sablowski und Carnier Dornelas, 2014). In Blättern von Modellpflanzen verläuft dieser Übergang als basipetale Welle des Zellzyklusstillstands, die am distalen Teil des Primordiums beginnt und sich zur Basis hin bewegt. Die Zellen hinter der mitotischen Arrestfront werden stark vakuolisiert und beginnen zu expandieren (Donnelly et al., 1999; Czesnick und Lenhard, 2015). Andere Pflanzenarten können jedoch ein diffuses Wachstum und acropetale oder bidirektionale Zellzyklus-Arrest-Gradienten aufweisen (Das Gupta und Nath, 2015). Der Erwerb der photosynthetischen Kapazität ist für den Übergang von der Zellteilung zur Zellexpansion erforderlich (Andriankaja et al., 2012). Diese Verschiebung korreliert mit der Rolle des Zuckers bei der Förderung des Target of Rapamycin (TOR)-Wegs und der Unterdrückung der Sucrose-non-fermenting1-related kinase 1 (SnRK1): TOR und T6P induzieren die Zellexpansion, indem sie die makromolekulare Synthese fördern, während SnRK1 den Katabolismus fördert (Tsai und Gazzarrini, 2014; Sablowski, 2016). Zwei microRNAs spielen bei dieser zellulären Verschiebung entgegengesetzte Rollen: miR319 unterdrückt die Expression von Klasse-II-TCP-Faktoren, die die Zellproliferation hemmen, während miR396 die Expression von GROWTH REGULATING FACTORS (GRFs) einschränkt, die die Differenzierung verzögern (Das Gupta und Nath, 2015; Maugarny-Calés und Laufs, 2018). Der Übergang von einem indeterminierten Sprossapikalmeristem zu einem determinierten Blütenmeristem beinhaltet auch eine zeitliche Regulierung der zellulären Identität. Der Zeitpunkt der Aktivierung von KNUCKLES durch AGAMOUS, das wiederum WUSCHEL unterdrückt, definiert das zeitliche Fenster der Unbestimmtheit und folglich die Größe und Anzahl der Organe (Sun et al., 2014).
Schlussfolgerung
Ein Verständnis der zeitlichen Regulierung der Pflanzenentwicklung ist notwendig, um die Vielfalt der Pflanzenformen, die wir in der Natur sehen, besser zu verstehen, die morphologische Evolution der Pflanzen zu erklären und die Pflanzenarchitektur zum Nutzen der Landwirtschaft zu manipulieren. Wie oben dargelegt, wird die Heterochronie bei lebenden Arten durch miteinander verknüpfte Transkriptions-, Stoffwechsel- und Zellmechanismen gesteuert. Weitere Forschungen zu diesen Mechanismen bei Angiospermen und basalen Pflanzenlinien sollten mehr über die Veränderungen in der Entwicklungszeit aufdecken, die die Evolution der Pflanzenentwicklung vorangetrieben haben.
Beiträge der Autoren
MB-M konzipierte und schrieb das Manuskript. CSG redigierte und überarbeitete das Manuskript.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Alberch, P., Gould, S., Oster, G., und Wake, D. (1979). Größe und Form in Ontogenie und Phylogenie. Paleobiology 5, 296-317. doi: 10.1017/S0094837300006588
CrossRef Full Text | Google Scholar
Andriankaja, M., Dhondt, S., DeBodt, S., Vanhaeren, H., Coppens, F., DeMilde, L., et al. (2012). Ausstieg aus der Proliferation während der Blattentwicklung in Arabidopsis thaliana: ein nicht ganz so schrittweiser Prozess. Dev. Cell 22, 64-78. doi: 10.1016/j.devcel.2011.11.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Armbruster, W. S., Lee, J., Edwards, M. E., and Baldwin, B. G. (2013). Florale Paedomorphie führt zu sekundärer Spezialisierung bei der Bestäubung von Madagaskar Dalechampia (Euphorbiaceae). Evolution 67, 1196-1203. doi: 10.1111/evo.12002
PubMed Abstract | CrossRef Full Text | Google Scholar
Baker, R. L., and Diggle, P. K. (2011). Node-specific branching and heterochronic changes underlie population-level differences in Mimulus guttatus (Phrymaceae) shoot architecture. Am. J. Bot. 98, 1924-1934. doi: 10.3732/ajb.1100098
PubMed Abstract | CrossRef Full Text | Google Scholar
Bateman, R. M., Rudall, P. J., Bidartondo, M. I., Cozzolino, S., Tranchida-Lombardo, V., Carine, M. A., et al. (2014). Speziation durch florale Heterochronie und mutmaßlichen Mykorrhiza-Wirtswechsel bei endemischen Schmetterlingsorchideen auf dem Azoren-Archipel. Am. J. Bot. 101, 979-1001. doi: 10.3732/ajb.1300430
PubMed Abstract | CrossRef Full Text | Google Scholar
Beydler, B. D., Osadchuk, K., Cheng, C.-L., Manak, J. R., and Irish, E. E. (2016). In der juvenilen Phase von Mais kommt es zu einer Hochregulierung von Genen, die auf Stress reagieren, und sie wird durch exogenes JA verlängert. Plant Physiol. 171, 2648-2658. doi: 10.1104/pp.15.01707
PubMed Abstract | CrossRef Full Text | Google Scholar
Brown, R. C., and Lemmon, B. E. (2011). Sporen vor Sporophyten: Hypothesen zum Ursprung der Sporenentstehung am Übergang von Algen zu Pflanzen. New Phytol. 190, 875-881. doi: 10.1111/j.1469-8137.2011.03709.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Buendía-Monreal, M., and Gillmor, C. S. (2017). Konvergente Unterdrückung von miR156 durch Zucker und das CDK8-Modul von Arabidopsis Mediator. Dev. Biol. 423, 19-23. doi: 10.1016/j.ydbio.2017.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Busch, A., Horn, S., Mühlhausen, A., Mummenhoff, K., and Zachgo, S. (2012). Corolla monosymmetry: evolution of a morphological novelty in the Brassicaceae family. Mol. Biol. Evol. 29, 1241-1254. doi: 10.1093/molbev/msr297
PubMed Abstract | CrossRef Full Text | Google Scholar
Cartolano, M., Pieper, B., Lempe, J., Tattersall, A., Huijser, P., Tresch, A., et al. (2015). Heterochronie untermauert die natürliche Variation der Blattform von Cardamine hirsuta. Proc. Natl. Acad. Sci. U.S.A. 112, 10539-10544. doi: 10.1073/pnas.1419791112
PubMed Abstract | CrossRef Full Text | Google Scholar
Chitwood, D. H., Klein, L. L., O’Hanlon, R., Chacko, S., Greg, M., Kitchen, C., et al. (2016). Latente Entwicklungs- und Evolutionsformen im Rebenblatt. New Phytol. 210, 343-355. doi: 10.1111/nph.13754
PubMed Abstract | CrossRef Full Text | Google Scholar
Chuck, G., Cigan, A. M., Saeteurn, K., and Hake, S. (2007). Die heterochrone Mais-Mutante corngrass1 resultiert aus der Überexpression einer tandem microRNA. Nat. Genet. 39, 544-549. doi: 10.1038/ng2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Cong, B., Liu, J., und Tanksley, S. D. (2002). Natürliche Allele an einem quantitativen Merkmalslocus der Tomatenfruchtgröße unterscheiden sich durch heterochrone regulatorische Mutationen. Proc. Natl. Acad. Sci. U.S.A. 99, 13606-13611. doi: 10.1073/pnas.172520999
PubMed Abstract | CrossRef Full Text | Google Scholar
Conway, L. J., and Poethig, R. S. (1997). Mutationen von Arabidopsis thaliana, die Blätter in Keimblätter umwandeln. Proc. Natl. Acad. Sci. U.S.A. 94, 10209-10214. doi: 10.1073/pnas.94.19.10209
PubMed Abstract | CrossRef Full Text | Google Scholar
Costa, M. M. R., Yang, S., Critchley, J., Feng, X., Wilson, Y., Langlade, N., et al. (2012). Die genetische Grundlage für die natürliche Variation der Heteroblastie bei Antirrhinum. New Phytol. 196, 1251-1259. doi: 10.1111/j.1469-8137.2012.04347.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Cronk, Q. C. B., Needham, I., and Rudall, P. J. (2015). Evolution der Kätzchen: Blütenstandsmorphologie ausgewählter Salicaceae in einem evolutionären und entwicklungsgeschichtlichen Kontext. Front. Plant Sci. 6:1030. doi: 10.3389/fpls.2015.01030
PubMed Abstract | CrossRef Full Text | Google Scholar
Czesnick, H., and Lenhard, M. (2015). Größenkontrolle bei Pflanzen – Lektionen aus Blättern und Blüten. Cold Spring Harb. Perspect. Biol. 7:a019190. doi: 10.1101/cshperspect.a019190
PubMed Abstract | CrossRef Full Text | Google Scholar
Das Gupta, M., und Nath, U. (2015). Divergenz in den Mustern der Blattwachstumspolarität ist mit der Expressionsdivergenz von miR396 verbunden. Plant Cell 27, 2785-2799. doi: 10.1105/tpc.15.00196
PubMed Abstract | CrossRef Full Text | Google Scholar
De Beer, G. R. (1951). Embryos and Ancestors. Oxford: Clarendon Press.
Google Scholar
Donnelly, P. M., Bonetta, D., Tsukaya, H., Dengler, R. E., and Dengler, N. G. (1999). Zellzyklus und Zellvergrößerung in sich entwickelnden Blättern von Arabidopsis. Dev. Biol. 215, 407-419. doi: 10.1006/dbio.1999.9443
PubMed Abstract | CrossRef Full Text | Google Scholar
Efroni, I., Blum, E., Goldshmidt, A., and Eshed, Y. (2008). Ein langwieriger und dynamischer Reifungsplan liegt der Blattentwicklung von Arabidopsis zugrunde. Plant Cell 20, 2293-2306. doi: 10.1105/tpc.107.057521
PubMed Abstract | CrossRef Full Text | Google Scholar
Fahlgren, N., Montgomery, T. A., Howell, M. D., Allen, E., Dvorak, S. K., Alexander, A. L., et al. (2006). Die Regulierung von AUXIN RESPONSE FACTOR3 durch TAS3 ta-siRNA beeinflusst den Entwicklungszeitpunkt und die Musterbildung in Arabidopsis. Curr. Biol. 16, 939-944. doi: 10.1016/j.cub.2006.03.065
PubMed Abstract | CrossRef Full Text | Google Scholar
Fernandez, D. E. (1997). Developmental basis of homeosis in precociously germinating Brassica napus embryos: phase change at the shoot apex. Development 124, 1149-1157.
PubMed Abstract | Google Scholar
Friedman, W. E. (1999). Expression des Zellzyklus in Spermien von Arabidopsis: Implikationen für das Verständnis von Mustern der Gametenbildung und Befruchtung in Pflanzen und anderen Eukaryoten. Development 126, 1065-1075.
PubMed Abstract | Google Scholar
Friedman, W. E., und Carmichael, J. S. (1998). Heterochronie und Entwicklungsinnovation: Evolution der Ontogenie des weiblichen Gametophyten bei Gnetum, einer stark apomorphen Samenpflanze. Evolution 52, 1016-1030. doi: 10.1111/j.1558-5646.1998.tb01830.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Geuten, K., and Coenen, H. (2013). Heterochronic genes in plant evolution and development. Front. Plant Sci. 4:381. doi: 10.3389/fpls.2013.00381
PubMed Abstract | CrossRef Full Text | Google Scholar
Gillmor, C. S., Silva-Ortega, C. O., Willmann, M. R., Buendía-Monreal, M., and Poethig, R. S. (2014). Die Arabidopsis Mediator CDK8 Modulgene CCT (MED12) und GCT (MED13) sind globale Regulatoren von Entwicklungsphasenübergängen. Development 141, 4580-4589. doi: 10.1242/dev.111229
PubMed Abstract | CrossRef Full Text | Google Scholar
Goebel, K. (1908). Einleitung in die Experimentelle Morphologie der Pflanzen. Leipzig: B.G. Teubner.
Google Scholar
Gould, S. J. (1977). Ontogeny and Phylogeny. Cambridge, MA: Harvard University Press.
Google Scholar
Guo, C., Xu, Y., Shi, M., Lai, Y., Wu, X., Wang, H., et al. (2017). Die Unterdrückung von miR156 durch miR159 reguliert den Zeitpunkt des Übergangs vom Jugend- zum Erwachsenenalter in Arabidopsis. Plant Cell 29, 1293-1304. doi: 10.1105/tpc.16.00975
PubMed Abstract | CrossRef Full Text | Google Scholar
Guo, J. (2015). Mechanismen für die Evolution komplexer und vielfältig ausgearbeiteter Kelchblätter bei Iris identifiziert durch vergleichende Analyse von Entwicklungssequenzen. Am. J. Bot. 102, 819-832. doi: 10.3732/ajb.1400519
PubMed Abstract | CrossRef Full Text | Google Scholar
Haeckel, E. (1875). Die Gastrula und die Eifurchung der Thiere. Jena. Z. Naturwiss. 9, 402-508.
Google Scholar
Harrison, C. J. (2017). Entwicklung und Genetik in der Evolution der Körperpläne von Landpflanzen. Philos. Trans. R. Soc. B Biol. Sci. 372:20150490. doi: 10.1098/rstb.2015.0490
PubMed Abstract | CrossRef Full Text | Google Scholar
Harrison, C. J., and Morris, J. L. (2018). Der Ursprung und die frühe Evolution der Sprossen und Blätter von Gefäßpflanzen. Philos. Trans. R. Soc. B Biol. Sci. 373:20160496. doi: 10.1098/rstb.2016.0496
PubMed Abstract | CrossRef Full Text | Google Scholar
He, J., Xu, M., Willmann, M. R., Mccormick, K., Hu, T., Yang, L., et al. (2018). Threshold-dependent repression of SPL gene expression by miR156/miR157 controls vegetative phase change in Arabidopsis thaliana. PLoS Genet. 14:e1007337. doi: 10.1371/journal.pgen.1007337
PubMed Abstract | CrossRef Full Text | Google Scholar
Hudson, C. J., Freeman, J. S., Jones, R. C., Potts, B. M., Wong, M. M. L., Weller, J. L., et al. (2014). Genetische Kontrolle der Heterochronie bei Eucalyptus globulus. G3 4, 1235-1245. doi: 10.1534/g3.114.011916
PubMed Abstract | CrossRef Full Text | Google Scholar
Huijser, P., and Schmid, M. (2011). Die Kontrolle von Entwicklungsphasenübergängen bei Pflanzen. Development 138, 4117-4129. doi: 10.1242/dev.063511
PubMed Abstract | CrossRef Full Text | Google Scholar
Hunter, C., Sun, H., and Poethig, R. S. (2003). Das heterochrone Arabidopsis-Gen ZIPPY ist ein Mitglied der ARGONAUTE-Familie. Curr. Biol. 13, 1734-1739. doi: 10.1016/j.cub.2003.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Hunter, C., Willmann, M. R., Wu, G., Yoshikawa, M., de la Luz Gutiérrez-Nava, M., and Poethig, R. S. (2006). Trans-wirkende siRNA-vermittelte Unterdrückung von ETTIN und ARF4 reguliert Heteroblastie in Arabidopsis. Development 133, 2973-2981. doi: 10.1242/dev.02491
PubMed Abstract | CrossRef Full Text | Google Scholar
Jia, X. L., Chen, Y. K., Xu, X. Z., Shen, F., Zheng, Q. B., Du, Z., et al. (2017). miR156 switches on vegetative phase change under the regulation of redox signals in apple seedlings. Sci. Rep. 7, 1-13. doi: 10.1038/s41598-017-14671-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Kenrick, P., and Crane, P. R. (1997). Der Ursprung und die frühe Evolution der Pflanzen an Land. Nature 389, 33-39. doi: 10.1038/37918
CrossRef Full Text | Google Scholar
Keyte, A. L., and Smith, K. K. (2014). Heterochronie und Mechanismen der Entwicklungszeit: wechselnde Ontogenien in der Evolution. Semin. Cell Dev. Biol. 34, 99-107. doi: 10.1016/j.semcdb.2014.06.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J. Y., Oh, J. E., Noh, Y. S., and Noh, B. (2015). Epigenetic control of juvenile-to-adult phase transition by the Arabidopsis SAGA-like complex. Plant J. 83, 537-545. doi: 10.1111/tpj.12908
PubMed Abstract | CrossRef Full Text | Google Scholar
Kostyun, J. L., Preston, J. C., and Moyle, L. C. (2017). Heterochronic developmental shifts underlie floral diversity within Jaltomata ( Solanaceae ). Evodevo 8:17. doi: 10.1186/s13227-017-0080-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Kyozuka, J., Tokunaga, H., and Yoshida, A. (2014). Kontrolle der Blütenstandsform von Gräsern durch die Feinabstimmung der Meristemphasenveränderung. Curr. Opin. Plant Biol. 17, 110-115. doi: 10.1016/j.pbi.2013.11.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemmon, Z. H., Park, S. J., Jiang, K., Van Eck, J., Schatz, M. C., and Lippman, Z. B. (2016). Die Evolution der Blütenstandsvielfalt bei den Nachtschattengewächsen und Heterochronie während der Meristemreifung. Genome Res. 26, 1676-1686. doi: 10.1101/gr.207837.116
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Wang, Z., Hu, Y., Cao, Y., and Ma, L. (2017). Polycomb group proteins RING1A and RING1B regulate the vegetative phase transition in Arabidopsis. Front. Plant Sci. 8:867. doi: 10.3389/fpls.2017.00867
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, P., and Johnston, M. O. (2000). Heterochronie in der Pflanzenevolution durch das zwanzigste Jahrhundert. Bot. Rev. 66, 57-88. doi: 10.1007/BF02857782
CrossRef Full Text | Google Scholar
Li, S., Liu, L., Zhuang, X., Yu, Y., Liu, X., Cui, X., et al. (2013). MicroRNAs hemmen die Translation von Ziel-mRNAs am endoplasmatischen Retikulum in Arabidopsis. Cell 153, 562-574. doi: 10.1016/j.cell.2013.04.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lippman, Z. B., Cohen, O., Alvarez, J. P., Abu-Abied, M., Pekker, I., Paran, I., et al. (2008). Die Bildung eines zusammengesetzten Blütenstandes bei der Tomate und verwandten Nachtschattengewächsen. PLoS Biol. 6:e288. doi: 10.1371/journal.pbio.0060288
PubMed Abstract | CrossRef Full Text | Google Scholar
Lord, E. M., and Hill, J. P. (1987). „Evidence for heterochrony in the evolution of plant form“, in Development as an Evolutionary Process, eds R. A. Raff and E. C. Raff (New York, NY: Alan R. Liss), 47-70.
Google Scholar
Maugarny-Calés, A., and Laufs, P. (2018). Getting leaves into shape: a molecular, cellular, environmental and evolutionary view. Development 145:dev161646. doi: 10.1242/dev.161646
PubMed Abstract | CrossRef Full Text | Google Scholar
Meinke, D. W. (1992). Eine homoetische Mutante von Arabidopsis thaliana mit blättrigen Keimblättern. Science 258, 1647-1649. doi: 10.1126/science.258.5088.1647
PubMed Abstract | CrossRef Full Text | Google Scholar
Naghiloo, S., and Claßen-Bockhoff, R. (2017). Developmental changes in time and space promote evolutionary diversification of flowers: a case study in Dipsacoideae. Front. Plant Sci. 8:1665. doi: 10.3389/fpls.2017.01665
PubMed Abstract | CrossRef Full Text | Google Scholar
Nikolov, L. A., Tomlinson, P. B., Manickam, S., Endress, P. K., Kramer, E. M., and Davis, C. C. (2014). Holoparasitische Rafflesiaceae besitzen die am stärksten reduzierten Endophyten und bringen dennoch die größten Blüten der Welt hervor. Ann. Bot. 114, 233-242. doi: 10.1093/aob/mcu114
PubMed Abstract | CrossRef Full Text | Google Scholar
Nodine, M. D., and Bartel, D. P. (2010). MicroRNAs verhindern frühzeitige Genexpression und ermöglichen Musterbildung während der Pflanzenembryogenese. Genes Dev. 24, 2678-2692. doi: 10.1101/gad.1986710
PubMed Abstract | CrossRef Full Text | Google Scholar
Ojeda, D. I., Jaén-Molina, R., Santos-Guerra, A., Caujape-Castells, J., und Cronk, Q. (2017). Zeitliche, aber nicht räumliche Veränderungen in den Expressionsmustern von Blütenblatt-Identitätsgenen stehen im Zusammenhang mit dem Verlust der papillösen Kegelzellen und der Umstellung auf Vogelbestäubung bei Makaronesischem Lotus (Leguminosae). Plant Biol. 19, 420-427. doi: 10.1111/plb.12551
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, S. J., Jiang, K., Schatz, M. C., and Lippman, Z. B. (2012). Die Geschwindigkeit der Meristemreifung bestimmt die Architektur der Blütenstände bei der Tomate. Proc. Natl. Acad. Sci. U.S.A. 109, 639-644. doi: 10.1073/pnas.1114963109
PubMed Abstract | CrossRef Full Text | Google Scholar
Peragine, A., Yoshikawa, M., Wu, G., Albrecht, H. L., and Poethig, R. S. (2004). SGS3 und SGS2/SDE1/RDR6 sind erforderlich für die Jugendentwicklung und die Produktion von trans-acting si RNAs in Arabidopsis. Genes Dev. 18, 2368-2379. doi: 10.1101/gad.1231804.nism
CrossRef Full Text | Google Scholar
Pham, T., Day, S. M., Glassford, W. J., Williams, T. M., and Rebeiz, M. (2017). Die evolutionäre Entstehung eines neuartigen Expressionsmusters durch eine extreme heterochrone Verschiebung. Evol. Dev. 19, 43-55. doi: 10.1111/ede.12215
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, N. D., and Dolan, L. (2012). Morphologische Evolution bei Landpflanzen: neue Designs mit alten Genen. Philos. Trans. R. Soc. B Biol. Sci. 367, 508-518. doi: 10.1098/rstb.2011.0252
PubMed Abstract | CrossRef Full Text | Google Scholar
Poethig, R. S. (2013). Vegetative Phase Change and Shoot Maturation in Plants, 1st Edn. New York, NY: Elsevier Inc. doi: 10.1016/B978-0-12-396968-2.00005-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Porras, R., and Muñoz, J. M. (2000). Cleistogamous capitulum in Centaurea (Asteraceae): heterochronic origin. Am. J. Bot. 87, 925-933. doi: 10.2307/2656991
PubMed Abstract | CrossRef Full Text | Google Scholar
Pryer, K. M., and Hearn, D. J. (2009). Evolution der Blattform bei Marsileaceen-Farnen: Hinweise auf Heterochronie. Evolution 63, 498-513. doi: 10.1111/j.1558-5646.2008.00562.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ronse de Craene, L. (2018). Die Rolle der Blütenentwicklung in der Evolution der Blüten von Angiospermen verstehen: Erläuterungen aus historischer und physikalisch-dynamischer Perspektive. J. Plant Res. 131, 367-393. doi: 10.1007/s10265-018-1021-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Rothwell, G. W., Wyatt, S. E., und Tomescu, A. M. F. (2014). Pflanzenevolution an der Schnittstelle von Paläontologie und Entwicklungsbiologie: ein organismuszentriertes Paradigma. Am. J. Bot. 101, 899-913. doi: 10.3732/ajb.1300451
PubMed Abstract | CrossRef Full Text | Google Scholar
Sablowski, R. (2016). Koordination von Wachstum und Teilung von Pflanzenzellen: kollektive Kontrolle oder gegenseitige Absprache? Curr. Opin. Plant Biol. 34, 54-60. doi: 10.1016/j.pbi.2016.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Sablowski, R., and Carnier Dornelas, M. (2014). Interplay between cell growth and cell cycle in plants. J. Exp. Bot. 65, 2703-2714. doi: 10.1093/jxb/ert354
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharbel, T. F., Voigt, M. L., Corral, J. M., Galla, G., Kumlehn, J., Klukas, C., et al. (2010). Apomiktische und sexuelle Eizellen von Boechera zeigen heterochrone globale Genexpressionsmuster. Plant Cell 22, 655-671. doi: 10.1105/tpc.109.072223
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, K. K. (2002). Sequenzheterochronie und die Evolution der Entwicklung. J. Morphol. 252, 82-97. doi: 10.1002/jmor.10014
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, K. K. (2003). Der Pfeil der Zeit: Heterochronie und die Evolution der Entwicklung. Int. J. Dev. Biol. 47, 613-621.
Google Scholar
Stone, S. L., Braybrook, S. A., Paula, S. L., Kwong, L. W., Meuser, J., Pelletier, J., et al. (2008). Arabidopsis leafy cotyledon2 induziert Reifungseigenschaften und Auxin-Aktivität: Auswirkungen auf die somatische Embryogenese. Proc. Natl. Acad. Sci. U.S.A. 105, 3151-3156. doi: 10.1073/pnas.0712364105
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, B., Looi, L. S., Guo, S., He, Z., Gan, E. S., Huang, J., et al. (2014). Ein von der Zellteilung abhängiger Timing-Mechanismus wird durch die Polycomb-Evakuierung in Pflanzenstammzellen ausgelöst. Science 343:1248559. doi: 10.1126/science.1248559
PubMed Abstract | CrossRef Full Text | Google Scholar
Tian, H. Q., Yuan, T., and Russell, S. D. (2005). Beziehung zwischen doppelter Befruchtung und dem Zellzyklus in männlichen und weiblichen Gameten des Tabaks. Sex. Plant Reprod. 17, 243-252. doi: 10.1007/s00497-004-0233-9
CrossRef Full Text | Google Scholar
Tomescu, A. M. F., Wyatt, S. E., Hasebe, M., and Rothwell, G. W. (2014). Die frühe Evolution des Körperbaus von Gefäßpflanzen – die fehlenden Mechanismen. Curr. Opin. Plant Biol. 17, 126-136. doi: 10.1016/j.pbi.2013.11.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsai, A. Y.-L., and Gazzarrini, S. (2014). Trehalose-6-Phosphat und SnRK1-Kinasen in der Pflanzenentwicklung und -signalgebung: ein neues Bild. Front. Plant Sci. 5:119. doi: 10.3389/fpls.2014.00119
PubMed Abstract | CrossRef Full Text | Google Scholar
Vasconcelos, T. N. C., Lucas, E. J., Faria, J. E. Q., and Prenner, G. (2018). Florale Heterochronie fördert die Flexibilität von Reproduktionsstrategien in der morphologisch homogenen Gattung Eugenia (Myrtaceae). Ann. Bot. 121, 161-174. doi: 10.1093/aob/mcx142
PubMed Abstract | CrossRef Full Text | Google Scholar
Wahl, V., Ponnu, J., Schlereth, A., Arrivault, S., Langenecker, T., Franke, A., et al. (2013). Regulation der Blüte durch Trehalose-6-Phosphat-Signalisierung in Arabidopsis thaliana. Science 339, 704-707. doi: 10.1126/science.1230406
PubMed Abstract | CrossRef Full Text | Google Scholar
Walcher-Chevillet, C. L., and Kramer, E. M. (2016). Breaking the mold: understanding the evolution and development of lateral organs in various plant models. Curr. Opin. Genet. Dev. 39, 79-84. doi: 10.1016/j.gde.2016.06.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J., Czech, B., and Weigel, D. (2009). miR156-regulated SPL transcription factors define an endogenous flowering pathway in Arabidopsis thaliana. Cell 138, 738-749. doi: 10.1016/j.cell.2009.06.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Willmann, M. R., Mehalick, A. J., Packer, R. L., and Jenik, P. D. (2011). MicroRNAs regulieren den Zeitpunkt der Embryoreifung in Arabidopsis. Plant Physiol. 155, 1871-1884. doi: 10.1104/pp.110.171355
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, G., Park, M. Y., Conway, S. R., Wang, J., Weigel, D., and Poethig, R. S. (2009). Die sequentielle Wirkung von miR156 und miR172 reguliert den Entwicklungszeitpunkt in Arabidopsis. Cell 138, 750-759. doi: 10.1016/j.cell.2009.06.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, G., and Poethig, R. S. (2006). Zeitliche Regulierung der Sprossentwicklung in Arabidopsis thaliana durch miR156 und sein Ziel SPL3. Development 133, 3539-3547. doi: 10.1242/dev.02521
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, M., Hu, T., Smith, M. R., and Poethig, R. S. (2016). Epigenetische Regulierung des vegetativen Phasenwechsels in Arabidopsis. Plant Cell 28, 28-41. doi: 10.1105/tpc.15.00854
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, Y., Guo, C., Zhou, B., Li, C., Wang, H., Zheng, B., et al. (2016). Regulation des vegetativen Phasenwechsels durch die SWI2/SNF2 Chromatin Remodeling ATPase BRAHMA. Plant Physiol. 172, 2416-2428. doi: 10.1104/pp.16.01588
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, M., Leichty, A. R., Hu, T., and Poethig, R. S. (2018). H2A.Z fördert die Transkription von MIR156A und MIR156C in Arabidopsis durch Erleichterung der Ablagerung von H3K4me3. Development 145:dev.152868. doi: 10.1242/dev.152868
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaguchi, N., Huang, J., Xu, Y., Tanoi, K., and Ito, T. (2017). Feinabstimmung der Auxin-Homöostase steuert den Übergang von der Erhaltung der Blütenstammzellen zur Bildung des Gynoeceums. Nat. Commun. 8:1125. doi: 10.1038/s41467-017-01252-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, L., Xu, M., Koo, Y., He, J., and Poethig, R. S. (2013). Sugar promotes vegetative phase change in Arabidopsis thaliana by repressing the expression of MIR156A and MIR156C. eLife 2:e00260. doi: 10.7554/eLife.00260
PubMed Abstract | CrossRef Full Text | Google Scholar
Yu, S., Li, C., Zhou, C. M., Zhang, T. Q., Lian, H., Sun, Y., et al. (2013). Sugar is an endogenous cue for juvenile-to-adult phase transition in plants. eLife 2:e00269. doi: 10.7554/eLife.00269
PubMed Abstract | CrossRef Full Text | Google Scholar
Yu, S., Zhang, Y., Horrer, D., Zhang, T., Hao, Y., Feng, Y., et al. (2012). Gibberellin reguliert den Blütenübergang bei Arabidopsis durch miR156-gezielte SQUAMOSA-Promotor-bindende -ähnliche Transkriptionsfaktoren. Plant Cell 24, 3320-3332. doi: 10.1105/tpc.112.101014
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply