Frontiers in Oncology
Hintergrund
Strahleninduzierte Osteoporose und daraus resultierende Insuffizienzfrakturen (IFs) sind sehr häufig. Die in der Literatur angegebene Inzidenz von IFs nach abdominalen oder pelvinen Bestrahlungen schwankt zwischen 7 und 45 % (1-8). In bestimmten onkologischen Situationen, wie z. B. bei der Hormonbehandlung von Brust- und Prostatakrebs, sind Kliniker mit dem behandlungsbedingten Osteoporose- und Frakturrisiko vertraut (9-13). Die Dual-Energy-Röntgenabsorptiometrie (DEXA) wird routinemäßig angeordnet, und vorbeugende Maßnahmen gegen Osteoporose wie Kalzium, Vitamin D oder Biphosphonate werden während der Nachsorge der Patienten prophylaktisch eingenommen. Es gibt jedoch keine routinemäßige Bewertung der Knochengesundheit und kein Bewusstsein für strahlenbedingte Knochentoxizität und IFs bei Strahlenonkologen. Obwohl IFs bei der Nachsorge von Patienten nach abdominalen oder pelvinen Bestrahlungen häufig anzutreffen sind und heutzutage sehr häufig nach stereotaktischen Bestrahlungen beobachtet werden, werden DEXA- oder andere alternative Messungen der Knochenmineraldichte (BMD) in der strahlenonkologischen Praxis nicht berücksichtigt (1-8, 14-16). Da die Strahlentherapeuten die IFs nicht kennen, werden diese IFs oft nicht erkannt oder manchmal als Knochenmetastasen des primären Krebses angesehen, was zu Kunstfehlern und unnötigen Untersuchungen und psychologischem Stress für die Patienten führt.
Wir haben kürzlich ein 9,6%iges Wirbelbruchrisiko bei Patienten nachgewiesen, die mit einer abdominalen Bestrahlung behandelt wurden (8). Wir sind der Meinung, dass der Knochen bei der Planung der Strahlentherapie als Risikoorgan betrachtet werden sollte, und die BMD sollte bei diesen Patienten vor und nach der Bestrahlung regelmäßig gemessen und überwacht werden. Strahlentherapeuten können die Knochengesundheit ihrer Patienten und unerkannte IFs mit Hilfe ihres wichtigsten Werkzeugs bestimmen: dem Planungssystem für die Strahlenbehandlung.
Die BMD ist das Maß für die Knochenmineral- und Kalziumdichte und wird durch DEXA bestimmt (17, 18). Die DEXA gilt derzeit als Goldstandardmethode für die BMD-Quantifizierung und korreliert nachweislich mit dem Frakturrisiko und der Wirksamkeit der Behandlung (17, 18). Mehrere Studien haben gezeigt, dass die aus der Computertomographie (CT) abgeleiteten Hounsfield-Einheiten (HUs) eine starke Korrelation mit der von der DEXA ermittelten BMD aufweisen (19-22). HU-Werte können eine zuverlässige Schätzung der regionalen Knochenstärke und BMD liefern und mit hoher Genauigkeit zum Ausschluss von Osteoporose verwendet werden (19-22). Darüber hinaus ermöglicht die CT-Untersuchung im Vergleich zur DEXA eine genauere Identifizierung von Wirbelbrüchen (23). CT-Scans zur Diagnostik und Bestrahlungsplanung werden entweder zur Stadieneinteilung, zur Planung der Strahlenbehandlung oder zur routinemäßigen Nachuntersuchung der Patienten angeordnet. Bei diesen Patienten können wir die von der CT abgeleiteten HUs zur Bestimmung und Überwachung der BMD nutzen und so zusätzliche Kosten und die zusätzliche Strahlenbelastung durch die DEXA-Messung vermeiden. Neben diesen Vorteilen können sagittale Wirbelansichten, die leicht aus CT-Scans rekonstruiert werden können, verwendet werden, um unerkannte und nicht symptomatische Knochenbrüche zu bewerten.
Das Ziel der vorliegenden Studie ist es, den Verlust der Knochenmineraldichte und nicht diagnostizierte Wirbelfrakturen durch die Messung der HUs und die sagittale Rekonstruktion der Wirbel aus den CT-Scans, die in das Behandlungsplanungssystem für Patienten importiert werden, die mit abdominaler Strahlentherapie behandelt werden, nachzuweisen.
Methoden
Siebenundfünfzig konsekutive Patienten, die wegen eines Adenokarzinoms des Magens operiert wurden und eine adjuvante abdominale Strahlentherapie erhielten, wurden in die Studiengruppe aufgenommen. Vierunddreißig konsekutive Patienten mit einer Erkrankung im Frühstadium, die nach der Operation keine adjuvante Behandlung benötigten, bildeten die Kontrollgruppe.
Bei den bestrahlten Patienten wurde die Bestrahlung mit 6 oder 15 MV-Photonen entweder mit konformer, intensitätsmodulierter oder volumetrisch modulierter Lichtbogen-Behandlungsplanung durchgeführt. Die verordnete Strahlendosis betrug 46 Gy in 23 Fraktionen mit 2 Gy pro Tag oder 45 Gy in 25 Fraktionen mit 1,8 Gy pro Tag, 5 Tage pro Woche, 5 Wochen lang. Alle Patienten erhielten entweder einen Bolus oder eine Infusion mit 5-Fluorouracil, einen Zyklus vor, zwei Zyklen gleichzeitig mit und einen Zyklus nach der Strahlenbehandlung. Von allen Patienten wurde eine Einverständniserklärung eingeholt, und die Studie wurde von der örtlichen Ethikkommission des Krankenhauses genehmigt.
Planungs- und Diagnosetomographien wurden mit Multidetektor-CT-Scannern (LightSpeed 16 slice oder VCT 64 slice; GE Healthcare, Waukesha, WI) mit einer Schichtdicke von entweder 3 oder 5 mm erstellt. Die Abdominal-Tomographien wurden aus dem Bildarchivierungs- und Kommunikationssystem der Radiologie in das Eclipse Treatment Planning System (TPS) (Varian Medical Systems, Palo Alto, CA) importiert. In der Studiengruppe befand sich die erste Tomographie bereits im Behandlungsplanungssystem für die Bestrahlungsplanung. Die zweite Aufnahme wurde 1 Jahr nach der Strahlentherapie erstellt und in das Behandlungsplanungssystem importiert. In der Kontrollgruppe wurden abdominale Tomographien, die unmittelbar nach der Operation und 1 Jahr später erstellt wurden, in das Planungssystem importiert. Die T12-L1-L2-Wirbelkörper wurden konturiert, um die mittlere Strahlendosis für jeden Wirbelkörper bei den bestrahlten Patienten durch einen Radioonkologen zu bestimmen. Anschließend ermittelte ein erfahrener Radiologe mit TPS die mittleren HU-Werte derselben Wirbel für alle Patienten. Die mittleren HU-Werte für beide Patientengruppen wurden 1 Jahr später erneut gemessen.
Die HU-Werte zu Beginn der Studie und die 1 Jahr später ermittelten Werte wurden für jeden Wirbelkörper in jeder Gruppe berechnet und die prozentuale Veränderung der HUs (Δ%HU) wurde bestimmt. Obwohl die Dauer der HU-Messungen zu Beginn und 1 Jahr später geplant war, verfolgten wir die Patienten regelmäßig für mindestens 5 Jahre nach der Behandlung, um das onkologische Ergebnis zu überprüfen. Falls sich Wirbelkompressionsfrakturen entwickelten, wurden diese anhand der sagittalen Rekonstruktion der Wirbel aus den Computertomographien während der Nachuntersuchungen ermittelt.
HU-Messverfahren
Die HU wurde an den axialen Querschnitten der trabekulären Regionen der Wirbelkörper von T12, L1 und L2 gemessen. Jeder Wirbelkörper wurde in drei axiale Segmente unterteilt und die HUs wurden berechnet, indem eine rechteckige Region of Interest (ROI) über einen Bereich des trabekulären Knochens auf dem Wirbelkörper gelegt wurde. Wir haben versucht, den basivertebralen Venenplexus im hinteren Bereich und den subchondralen sklerotischen Knochen zu vermeiden. Die Messungen sind in der ergänzenden Abbildung 1 dargestellt. Die mittleren HU-Werte von drei axialen Segmenten in jedem Wirbel wurden gemittelt, um den endgültigen HU-Wert für jeden Wirbelkörper zu bestimmen. HUpre steht für den HU-Wert, der beim ersten CT für die Studien- und die Kontrollgruppe gemessen wurde, während HUpost den HU-Wert definiert, der nach einem Jahr gemessen wurde.
Statistische Analysen
Die prozentuale Abnahme der Knochenschwächung (Δ%HU) für jeden Wirbel wurde mit der folgenden Gleichung berechnet:
Die Chi-Quadrat-Analysen wurden durchgeführt, um die Unterschiede zwischen Alter, Geschlecht und Tumormerkmalen der Gruppen aufzuzeigen. Der t-Test für Studenten wurde verwendet, um die Unterschiede zwischen den HU-Werten vor und nach der Bestrahlung in jeder Gruppe und zwischen zwei Gruppen sowie für drei Strahlungsdosisstufen (<20 Gy, 20-40 Gy und >40 Gy) in der Studiengruppe zu ermitteln. Zur direkten Bewertung der Auswirkung der Strahlendosis auf die Veränderung von Δ%HU wurde eine Pearson-Korrelationsanalyse für Δ%HU und Strahlendosis durchgeführt. Wir betrachteten einen p-Wert von < 0,05 als signifikant. Die statistische Analyse wurde mit der Software Statistical Package for Social Sciences (SPSS) 17.0 durchgeführt.
Ergebnisse
Die Patienten- und Behandlungsdaten sind in Tabelle 1 dargestellt. Es gab keinen statistisch signifikanten Unterschied zwischen den Gruppen in Bezug auf Alter, Geschlecht, Art der chirurgischen Resektion und Tumorlokalisation. Die mittleren HU-Werte der Wirbel T12, L1 und L2 wurden in beiden Gruppen gemessen. Zu Beginn der Studie gab es keinen statistisch signifikanten Unterschied in den gemessenen HU-Werten für alle Wirbel zwischen der Studien- und der Kontrollgruppe. Während die mittleren HU-Werte der Wirbel T12, L1 und L2 in der Studiengruppe nach einem Jahr signifikant abnahmen (p < 0,001 für jeden Wirbel), wurde in der Kontrollgruppe im gleichen Zeitraum keine signifikante Veränderung der HU-Werte festgestellt (p: 0,09-0,08-0,24). Tabelle 2 fasst die Veränderungen der HU-Werte für die Studien- und die Kontrollgruppe zusammen.
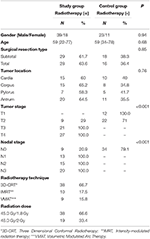
Tabelle 1. Patienten- und Behandlungsmerkmale.

Tabelle 2. Vergleich der HUs in beiden Gruppen selbst und zwischen den beiden Gruppen für jeden Wirbel.
Die mittleren Strahlendosen für die Wirbel T12, L1 und L2 in der Studiengruppe betrugen 34,55 ± 11,1; 31,82 ± 12,4; 30,37 ± 13,6 Gy. Es wurde ein negativer und signifikanter Zusammenhang zwischen der Δ%HU und der von den einzelnen Wirbeln erhaltenen Strahlendosis festgestellt. Mit zunehmender Bestrahlungsdosis nahmen die HUs in jedem Wirbel ab. Dies ist in den Abbildungen 1-3 zusammengefasst.
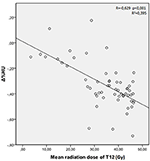
Abbildung 1. Korrelation zwischen Δ%HU und der vom T12-Wirbel empfangenen Strahlendosis.
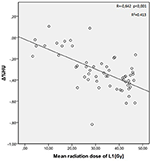
Abbildung 2. Korrelation zwischen Δ%HU und der vom L1-Wirbel empfangenen Strahlendosis.
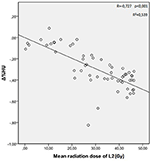
Abbildung 3. Korrelation zwischen Δ%HU und der vom L2-Wirbel erhaltenen Strahlendosis.
Die Beziehung zwischen der vom Wirbel erhaltenen Strahlendosis und der HU-Veränderung wurde in Tabelle 3 zusammengefasst. Obwohl die Abnahme der HU-Werte bei Strahlendosen über 20 Gy statistisch signifikant war, wurden die HU-Werte bei Strahlendosen unter 20 Gy nicht signifikant verändert, mit Ausnahme der L2-Wirbel.

Tabelle 3. Veränderung der HUs in Bezug auf die Bestrahlungsdosisgruppen.
Frakturen
Während kein Patient in der Kontrollgruppe Frakturen hatte, entwickelten 4 von 57 Patienten (%7) in der bestrahlten Gruppe während des Studienverlaufs Wirbelfrakturen. Während zwei der Wirbelfrakturen bei Frauen beobachtet wurden, waren es bei den Männern zwei. Die Frakturen wurden im 16., 18., 20. und 26. Monat nach der Bestrahlung festgestellt, mit einer medianen Nachbeobachtungszeit von 24 Monaten (Bereich: 12-36 Monate). Bei drei Patienten wurden Frakturen am L1-Wirbel und bei einem Patienten am L2-Wirbel beobachtet. Jeder gebrochene Wirbel erhielt im Mittel folgende Strahlendosen: 39, 28,5, 22,3 und 31 Gy. Die Merkmale der Patienten mit Wirbelfrakturen sind in der ergänzenden Tabelle 1 und der ergänzenden Abbildung 2 zusammengefasst.
Diskussion
Die Strahlentherapie führt durch direkte und indirekte Mechanismen zu Osteoporose, und in der klinischen Praxis treten nach Becken- oder Bauchbestrahlungen häufig IFs auf (1-8). IFs in der Wirbelsäule und im Beckenbereich sind häufig und stellen eine wichtige späte Nebenwirkung der Strahlentherapie dar. Strahlenonkologen sind sich jedoch der strahleninduzierten Osteoporose und Knochentoxizität nicht bewusst. Aufgrund der Unkenntnis der strahleninduzierten Knochentoxizität wird dieser wichtigen Spätkomplikation keine besondere Aufmerksamkeit geschenkt. Wir haben in unserer früheren Studie (8) versucht, die Bedeutung dieses Problems hervorzuheben, und berichteten über eine sehr hohe Inzidenz von Wirbelbrüchen nach abdominalen Bestrahlungen wie bei Patienten, die wegen Beckentumoren bestrahlt wurden (1-7).
Die Strahlenonkologen achten bei der Planung der Strahlenbehandlung sehr auf die Strahlendosis, die jedes gefährdete Organ erhält. Obwohl die Grad III/IV-Spättoxizitätsraten für diese sehr genau verfolgten Komplikationen nicht über bestimmte Prozentsätze hinausgehen, sind die mit der Strahlentherapie des Abdomens oder des Beckens verbundenen Knochentoxizitäten und die daraus resultierenden Frakturen tatsächlich höher als die bekannten Grad III/IV-Spättoxizitäten. Während Dosisbeschränkungen für bekanntermaßen gefährdete Organe genau definiert sind und für die endgültige Genehmigung des Plans ausschlaggebend sind, ist dies für Knochengewebe nicht der Fall.
Selbst in der neuesten Version der Common Terminology Criteria for Adverse Events (CTCAE) Version 5.0 gibt es keine spezifische Definition für Knochentoxizität infolge von Bestrahlung (24). In der strahlenonkologischen Praxis gibt es keine Kriterien zur Bewertung der Knochentoxizität. Weder in den LENT-SOMA-Tabellen zur Bewertung der späten Toxizität noch im Bericht Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC) wurde der Knochen als Risikoorgan definiert, und für dieses Gewebe wurden keine Dosis- und Volumenbeschränkungen festgelegt (25, 26). Die früheren Studien und unsere kürzlich veröffentlichte Studie haben jedoch gezeigt, dass das Osteoporose- und Frakturrisiko ernsthaft in Betracht gezogen werden sollte und dass bei der Nachsorge von bestrahlten Patienten die notwendigen Vorsichtsmaßnahmen getroffen werden sollten, um strahlenbedingte Frakturen zu verhindern (1-8).
DEXA ist die Goldstandardmethode für die BMD-Quantifizierung und das Routine-Screening auf Osteoporose. Strahlenonkologen ordnen für ihre Patienten, die eine Becken- oder Bauchbestrahlung erhalten, keine DEXA an. Sie konsultieren diese Patienten nicht mit dem Endokrinologen, um das Frakturrisiko und das Vorhandensein von Osteoporose vor einer Strahlenbehandlung zu beurteilen. Als Radioonkologen können wir jedoch unser Planungssystem nutzen, um die BMD und das Osteoporoserisiko zu bestimmen. Diese Bewertungen lassen sich leicht mit Hilfe von CT-Scans vornehmen, die entweder für die Stadieneinteilung der Krankheit oder für die Planung der Strahlenbehandlung und für die Nachsorge der Patienten angeordnet werden. Wir können BMD-Abnahme, Osteoporose und unbemerkte Frakturen bestimmen, indem wir HU-Werte des Knochens aus den in das Planungssystem importierten CT-Scans der Patienten messen und sagittale Bilder der bestrahlten Knochenbereiche erstellen.
Kürzlich wurde vorgeschlagen, dass CT-abgeleitete HU-Werte des Knochens verwendet werden können, um Patienten mit verminderter BMD und Osteoporose zu identifizieren (19-22, 27-30). Pickhardt et al. (22) haben klar definiert, wie Knochen-HU-Werte gemessen und als Alternative zur DEXA zur Feststellung von BMD und Osteoporose verwendet werden können. In diesen Studien gelten HU-Werte unter 100 als Anzeichen für Osteoporose, HU-Werte zwischen 100 und 160 als Anzeichen für Osteopenie und HU-Werte über 160 für eine normale Knochenmineraldichte (19-22). Patienten mit HU-Werten über 160 haben eine normale Knochendichte, so dass keine DEXA-Messung und keine Sorge um die Knochengesundheit erforderlich ist. Patienten mit HU-Werten zwischen 100 und 160 können als osteopenisch angesehen werden und benötigen ein frühzeitiges Eingreifen zur Vorbeugung von Osteoporose und Frakturrisiko in der Zukunft. Patienten mit HU-Werten unter 100 sollten als osteoporotisch eingestuft werden. Niedrige HU-Werte sollten den Radioonkologen auf ein erhöhtes Frakturrisiko in den Knochenbereichen aufmerksam machen, die der Strahlung ausgesetzt werden. Diese Patienten sollten vor einer Strahlenbehandlung mit dem Endokrinologen konsultiert werden. In Studien, in denen die HU mit der DEXA zur Bestimmung der Knochenmineraldichte und der Osteoporose verglichen wurde, wurden bei einigen Patienten, die bei der DEXA in die Gruppe der Nicht-Osteoporose-Patienten fielen, während der Bestimmung der HU anhand von CT-Scans Wirbelbrüche festgestellt (22, 29-31).
In unserer Studie haben wir versucht, einen einfachen Weg für Strahlentherapeuten zur Diagnose von Osteoporose und zur Bestimmung des Frakturrisikos zu finden. Wenn wir diese Messungen bei der Planung der Strahlentherapie in die tägliche Routine einbauen, können wir Osteopenie, Osteoporose und das Frakturrisiko bei Patienten, die eine abdominale oder pelvine Strahlentherapie erhalten, bestimmen und frühzeitig eingreifen, um eine späte Knochentoxizität durch die Strahlung zu verhindern.
Während es keinen statistisch signifikanten Unterschied zwischen den HU-Werten der Wirbel T12, L1 und L2 gab, die zu Beginn und ein Jahr später in der Kontrollgruppe ermittelt wurden, sanken die HU-Werte bei den bestrahlten Patienten deutlich. Wir fanden Wirbelfrakturen nur bei den bestrahlten Patienten. Vier von 57 Patienten hatten nach einer medianen Nachbeobachtungszeit von 24 Monaten Wirbelbrüche, was einer kumulativen Inzidenzrate von 7 % entspricht. Obwohl die Nachbeobachtungszeit kurz war und die meisten Frakturen asymptomatisch waren, berichteten wir in unserer früheren Studie mit einer längeren Nachbeobachtungszeit über eine Frakturrate von 9,6 %, wobei die meisten dieser Frakturen symptomatisch waren (8). Das hohe Risiko von Knochenbrüchen bei diesen Patienten verdient Aufmerksamkeit, und die Knochen sollten als Risikoorgan betrachtet werden. Die berichtete Zeit für die Entwicklung von Frakturen nach der Strahlentherapie lag zwischen 2 und 63 Monaten (2, 14). Interessanterweise werden Frakturen als Grad IV der späten Strahlentoxizität häufiger beobachtet als andere bekannte späte Strahlentoxizitäten wie Strahlenfibrose, Zystitis, Proktitis usw.
Die Abnahme der HU war dosisabhängig. Das Risiko einer Abnahme der HU-Werte im Knochen war höher, wenn die Wirbel eine höhere Strahlendosis erhielten. Wir stellten jedoch fest, dass die Abnahme der HU-Werte bei den Wirbelkörpern, die Strahlendosen unter 20 Gy ausgesetzt waren, nicht signifikant war.
In der Literatur gibt es widersprüchliche Ergebnisse in Bezug auf die Strahlendosis, bei der ein BMD-Verlust beobachtet wird. Während eine Studie bei Patienten, die mit 22,5 Gy Beckenbestrahlung behandelt wurden, einen BMD-Verlust nachwies, zeigte eine andere Studie keine Korrelation zwischen Strahlendosis und Insuffizienzfrakturrisiko (32, 33). Wei et al. (33) berichteten, dass selbst eine Strahlendosis von 5 Gy für die Wirbelsäule bei Patienten, die mit einer abdominalen Strahlentherapie behandelt wurden, zu einer signifikanten Verringerung der BMD und zu Insuffizienzfrakturen führt. Sie empfahlen auch, die Strahlendosen für Wirbelkörper zu begrenzen, insbesondere bei Patienten mit niedrigen HU-Werten, die bei der Planung der Strahlentherapie festgestellt wurden. Daher sollten wir eine Dosisbegrenzung für die Wirbel im Bestrahlungsfeld festlegen. Die Dosisbegrenzungen können je nach den bei der Bestrahlungsplanung gemessenen HU-Werten variieren. Wir sollten versuchen, die mittlere Strahlendosis für die Wirbelknochen im Bestrahlungsfeld zu verringern, insbesondere bei älteren und bereits osteoporotischen Patienten.
Schlussfolgerungen
Strahleninduzierte Osteoporose und daraus resultierende Insuffizienzfrakturen (IF) sind sehr häufig. BMD-Abnahme, Osteoporose und unbemerkte Frakturen können durch Messung der HU-Werte des Knochens aus den in das Planungssystem importierten CT-Scans der Patienten und durch Rekonstruktion sagittaler Bilder der bestrahlten Knochenbereiche erkannt werden. Bei Patienten mit bereits niedrigen HU-Werten des Knochens, die bei der Bestrahlungsplanung festgestellt werden, kann frühzeitig eingegriffen werden, um die Knochengesundheit wiederherzustellen und zukünftige strahlenbedingte Frakturen zu verhindern. Um die strahlenbedingte Knochentoxizität zu vermeiden, sollte die Strahlendosis für Wirbelknochen mit bereits niedrigen HU-Werten zum Zeitpunkt der Behandlungsplanung auf unter 20 Gy begrenzt werden.
Erklärung zur Datenverfügbarkeit
Das in diesem Artikel beschriebene Material, einschließlich aller relevanten Rohdaten, kann jedem Wissenschaftler, der es für nicht-kommerzielle Zwecke verwenden möchte, frei zur Verfügung gestellt werden, ohne die Vertraulichkeit der Teilnehmer zu verletzen, und kann beim entsprechenden Autor angefordert werden.
Erklärung zur Ethik
Unsere Studie wurde in Übereinstimmung mit der Deklaration von Helsinki durchgeführt. Die Studie wurde von der Ethikkommission des Dr. Lutfi Kirdar Kartal Education and Research Hospital genehmigt (2017/514/109/2). Von allen Studienteilnehmern wurde eine schriftliche Einverständniserklärung eingeholt.
Autorenbeiträge
GY: Garant für die Integrität der gesamten Studie. GY und CG: Konzepte und Design der Studie. NC: Literaturrecherche. GY, CG, IK, OS, und NC: klinische Studien. GY: statistische Auswertung. OS: Erstellung des Manuskripts. CG: Manuskriptbearbeitung. Alle Autoren haben das endgültige Manuskript gelesen und genehmigt.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Ergänzendes Material
Das ergänzende Material zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/articles/10.3389/fonc.2020.00742/full#supplementary-material
Abkürzungen
IFs, Insuffizienzfrakturen; DEXA, Dual energy x-ray absorptiometry; BMD, Knochenmineraldichte; CT, Computertomographie; HU, Hounsfield-Einheit; Δ%HU, prozentuale Veränderung in HU; ROI, Region of interest; SPSS, Statistical package for the social sciences; CTCAE, Common terminology criteria for adverse event; QUANTEC, Quantitative analyses of normal tissue effects in the clinic.
1. Oh D, Huh SJ. Insuffizienzfraktur nach einer Strahlentherapie. Radiat Oncol J. (2014) 32:213-20. doi: 10.3857/roj.2014.32.4.213
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Higham CE, Faithfull SJ. Knochengesundheit und pelvine Strahlentherapie. Clin Oncol. (2015) 11:668-78. doi: 10.1016/j.clon.2015.07.006
CrossRef Full Text | Google Scholar
3. Shih KK, Folkert MR, Kollmeier MA, Abu-Rustum NR, Sonoda Y, Leitao MM Jr, et al. Pelvic insufficiency fractures in patients with cervical and endometrial cancer treated with postoperative pelvic radiation. Gynecol Oncol. (2013) 128:540-3. doi: 10.1016/j.ygyno.2012.12.021
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Uezono H, Tsujino K, Moriki K, Nagano F, Ota Y, Sasaki R, et al. Beckeninsuffizienzfraktur nach definitiver Strahlentherapie bei Gebärmutterhalskrebs: retrospektive Analyse von Risikofaktoren. J Radiat Res. (2013) 54:1102-9. doi: 10.1093/jrr/rrt055
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Igdem S, Alco G, Ercan T, Barlan M, Ganiyusufoglu K, Unalan B, et al. Insuffizienzfrakturen nach pelviner Strahlentherapie bei Patienten mit Prostatakrebs. Int J Radiat Oncol Biol Phys. (2010) 77:818-23. doi: 10.1016/j.ijrobp.2009.05.059
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Schmeler KM, Jhingram A, Iyer RB, Sun CC, Eifel PJ, Soliman PT, et al. Beckenfrakturen nach Strahlentherapie bei Gebärmutterhalskrebs: Auswirkungen für Überlebende. Cancer. (2010) 116:625-30. doi: 10.1002/cncr.24811
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Kim HJ, Boland PJ, Meredith DS, Lis E, Zhang Z, Shi W, et al. Fractures of the sacrum after chemoradiation for rectal carcinoma: incidence, risk factors, and radiographic evaluation. Int J Radiat Oncol. (2012) 84:694-9. doi: 10.1016/j.ijrobp.2012.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Yaprak G, Gemici C, Temizkan S, Ozdemir S, Dogan BC, Seseogullari OO. Osteoporoseentwicklung und Wirbelfrakturen nach abdominaler Bestrahlung bei Patienten mit Magenkrebs. BMC Cancer. (2018) 18:972. doi: 10.1186/s12885-018-4899-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lustberg MB, Reinbolt RE, Shapiro CL. Bone health in adult cancer survivorship. J Clin Oncol. (2012) 30:3665-74. doi: 10.1200/JCO.2012.42.2097
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, ESMO Guidelines Working Group. Bone health in cancer patients: ESMO clinical practice guidelines. Ann Oncol. (2014) 25:124-37. doi: 10.1093/annonc/mdu103
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Pfeilschifter J, Diel IJ. Osteoporose als Folge einer Krebsbehandlung: Pathogenese und Management. J Clin Oncol. (2000) 18:1570-93. doi: 10.1200/JCO.2000.18.7.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Hadji P, Gnant M, Body JJ, Bundred NJ, Brufsky A, Coleman RE, et al. Cancer treatment-induced bone loss in premenopausal women: a need for therapeutic intervention? Cancer Treat Rev. (2012) 38:798-806. doi: 10.1016/j.ctrv.2012.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Skolarus TA, Caram MV, Shahinian VB. Androgen-Entzug-assoziierte Knochenerkrankungen. Curr Opin Urol. (2014) 24:601-7. doi: 10.1097/MOU.0000000000000101
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Boehling NS, Grosshans DR, Allen PK, McAleer MF, Burton AW, Azeem S, et al. Vertebrales Kompressionsfrakturrisiko nach stereotaktischer Körperbestrahlung für spinale Metastasen. J Neurosurg Spine. (2012) 16:379-86. doi: 10.3171/2011.11.SPINE116
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cunha MV, Al-Omair A, Atenafu EG, Masucci GL, Letourneau D, Korol R, et al. Vertebral compression fracture (VCF) after spine stereotactic body radiation therapy (SBRT): analysis of predictive factors. Int J Radiat Oncol Biol Phys. (2012) 84:343-9. doi: 10.1016/j.ijrobp.2012.04.034
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jawad MS, Fahim DK, Gerszten PC, Flickinger JC, Sahgal A, Grills IS, et al. Vertebrale Kompressionsfrakturen nach stereotaktischer Körperbestrahlungstherapie: eine große, multi-institutionelle, multinationale Auswertung. J Neurosurg Spine. (2016) 24:928-36. doi: 10.3171/2015.10.SPINE141261
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Marshall D, Johnell O, Wedel H. Meta-Analyse zur Vorhersage des Auftretens von osteoporotischen Frakturen durch die Messung der Knochenmineraldichte. BMJ. (1996) 312:1254-9. doi: 10.1136/bmj.312.7041.1254
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. A reference standard for the description of osteoporosis. Bone. (2008) 42:467-75. doi: 10.1016/j.bone.2007.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schreiber JJ, Anderson PA, Rosas HG, Buchholz AL, Au AG. Hounsfield-Einheiten zur Bewertung der Knochenmineraldichte und -festigkeit: ein Instrument für das Osteoporose-Management. J Bone Joint Surg Am. (2011) 93:1057-63. doi: 10.2106/JBJS.J.00160
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Schreiber JJ, Anderson PA, Hsu WK. Einsatz der Computertomographie zur Beurteilung der Knochenmineraldichte. Neurosurg Focus. (2014) 37:E4. doi: 10.3171/2014.5.FOCUS1483
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Batawil N, Sabiq S. Hounsfield unit for the diagnosis of bone mineral density disease: a proof of concept study. Radiography. (2016) 22:93-8. doi: 10.1016/j.radi.2015.11.004
CrossRef Full Text | Google Scholar
22. Pickhardt PJ, Pooler BD, Lauder T, del Rio AM, Bruce RJ, Binkley N. Opportunistic screening for osteoporosis using abdominal computed tomography scans obtained for other indications. Ann Intern Med. (2013) 158:588-95. doi: 10.7326/0003-4819-158-8-201304160-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Lenchik L, Shi R, Register TC, Beck SR, Beck SR, Langefeld CD, et al. Measurement of trabecular bone mineral density in the thoracic spine using cardiac gated quantitative computed tomography. J Comput Assist Tomogr. (2004) 28:134-9. doi: 10.1097/00004728-200401000-00023
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Common Terminology Criteria for Adverse Events (CTCAE). Version 5.0. U.S. Department of Health and Human Services, National Institutes of Health National Cancer Institute. Maryland (2017).
25. Overgaard J, Bartelink H. Late effects Consensus Conference: RTOG/EORTC. Radiother Oncol. (1995) 35:1-82. doi: 10.1016/0167-8140(95)01548-U
CrossRef Full Text | Google Scholar
26. Bentzen SM, Constine LS, Deasy JO, Eisbruch A, Jackson A, Marks LB. Quantitative Analysen des Normalgewebeeffekts in der Klinik (QUANTEC): eine Einführung in die wissenschaftlichen Fragen. Int J Radiat Oncol Biol. Phys. (2010) 76(3 Suppl):S3-S9. doi: 10.1016/j.ijrobp.2009.09.040
CrossRef Full Text | Google Scholar
27. Buckens CF, Dijkhuis G, de Keizer B, Verhaar HJ, de Jong PA. Opportunistisches Screening auf Osteoporose in der Routine-Computertomographie? Eine externe Validierungsstudie. Eur Radiol. (2015) 25:2074-9. doi: 10.1007/s00330-014-3584-0
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Emohare O, Cagan A, Morgan R, Davis R, Asis M, Switzer J, et al. The use of computed tomography attenuation to evaluate osteoporosis following acute fractures of the thoracic and lumbar vertebra. Geriatr Orthop Surg Rehabil. (2014) 5:50-5. doi: 10.1177/2151458514525042
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Alacreu E, Moratal D, Arana E. Opportunistic screening for osteoporosis by routine CT in Southern Europe. Osteoporos Int. (2017) 28:983-90. doi: 10.1007/s00198-016-3804-3
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Lee S, Chung CK, Oh SH, Park SB. Korrelation zwischen der mittels Dual-Energy-Röntgenabsorptiometrie gemessenen Knochenmineraldichte und den mittels diagnostischer CT gemessenen Hunsfeldeinheiten in der Lendenwirbelsäule. Korean Neurosurg Soc. (2013) 54:384-9. doi: 10.3340/jkns.2013.54.5.384
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Miyabara Y, Holmes D, Camp J, Miller VM, Kearns AE. Vergleich der kalibrierten und unkalibrierten Knochenmineraldichte mittels CT und DEXA bei Frauen in den Wechseljahren. Climacteric. (2012) 15:374-81. doi: 10.3109/13697137.2011.618566
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Park SH, Kim JC, Lee JE, Park IK. Beckeninsuffizienzfrakturen nach Strahlentherapie bei Patientinnen mit Gebärmutterhalskrebs in der Ära von PET/CT. Radiat Oncol J. (2011) 29:269-76. doi: 10.3857/roj.2011.29.4.269
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Wei RL, Jung BC, Manzano W, Sehgal V, Klempner SJ, Lee SP, et al. Bone mineral density loss in thoracic and lumbar vertebrae following radiation for abdominal cancers. Radiother Oncol. (2016) 118:430-6. doi: 10.1016/j.radonc.2016.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply