Qu’est-ce que l’électronégativité ?
ELECTRONÉGATIVITÉ
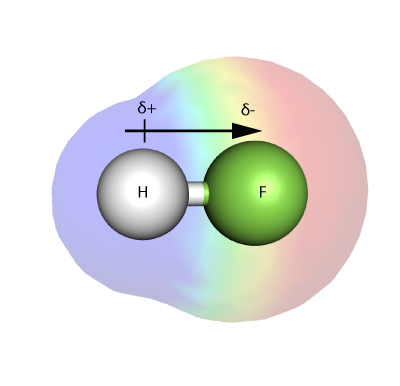
L’électronégativité est une mesure de la force avec laquelle un atome – dans une molécule – est capable d’attirer à lui les électrons d’une liaison.
Facteurs affectant l’électronégativité :
1) Le numéro atomique
Le numéro atomique est le nombre de protons dans le noyau d’un atome.
Il détermine les propriétés chimiques d’un élément et sa place dans le tableau périodique.
Plus le numéro atomique est élevé, plus l’électronégativité est forte.
2) Le rayon atomique
Le rayon atomique d’un élément chimique est généralement mesuré par la distance entre le centre du noyau et la limite de la couche la plus externe d’électrons.
Plus les rayons atomiques sont grands, plus l’électronégativité est faible.
Exemple de rayon atomique d’un atome d’oxygène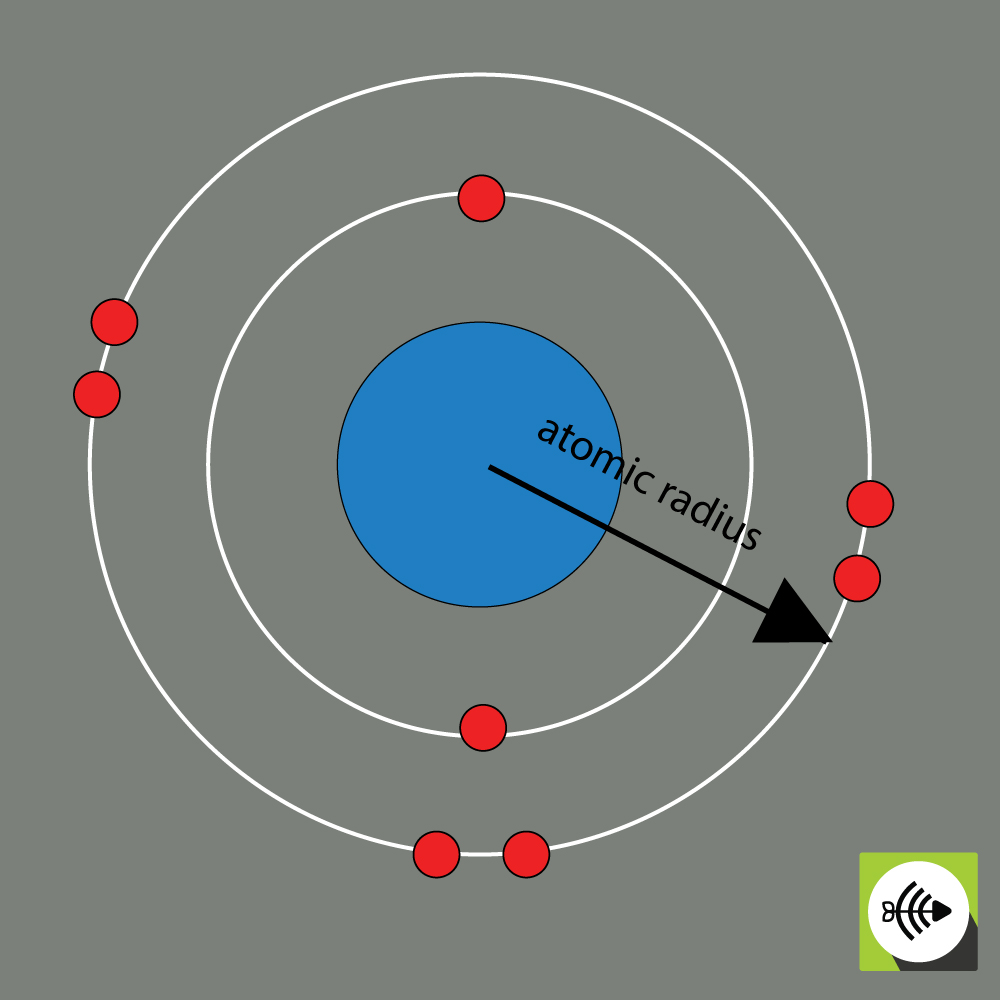
En quoi l’électronégativité est-elle mesurée ?
La mesure la plus courante de l’électronégativité est l’échelle de Pauling, conçue par le double prix Nobel Linus Pauling. L’échelle d’électronégativité des éléments indique la force avec laquelle chaque élément (par rapport aux autres) peut attirer les électrons de liaison vers lui. Plus le nombre d’électronégativité est élevé, plus l’atome tentera d’attirer les électrons vers lui.
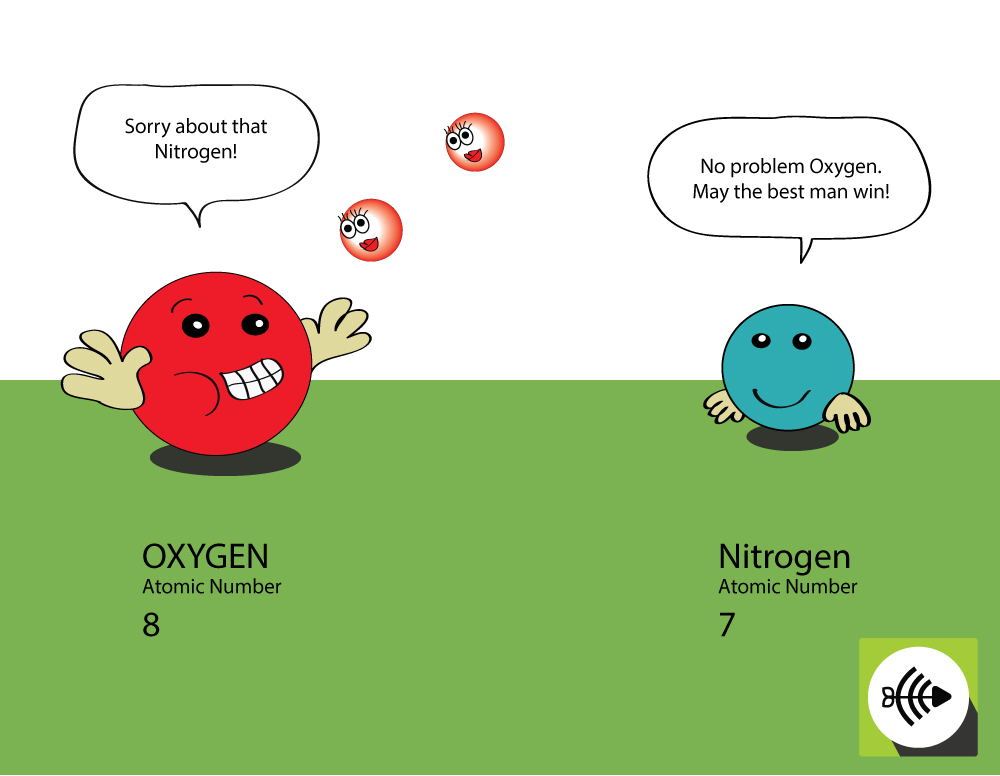
Pourquoi l’oxygène est-il plus électronégatif que l’azote ?
L’oxygène a un numéro atomique plus élevé
- L’oxygène a 8 protons dans le noyau alors que l’azote n’en a que 7.
- Une paire d’électrons de liaison subira plus d’attraction de la part du noyau de l’oxygène que de celui de l’azote, ainsi l’électronégativité de l’oxygène est plus grande.
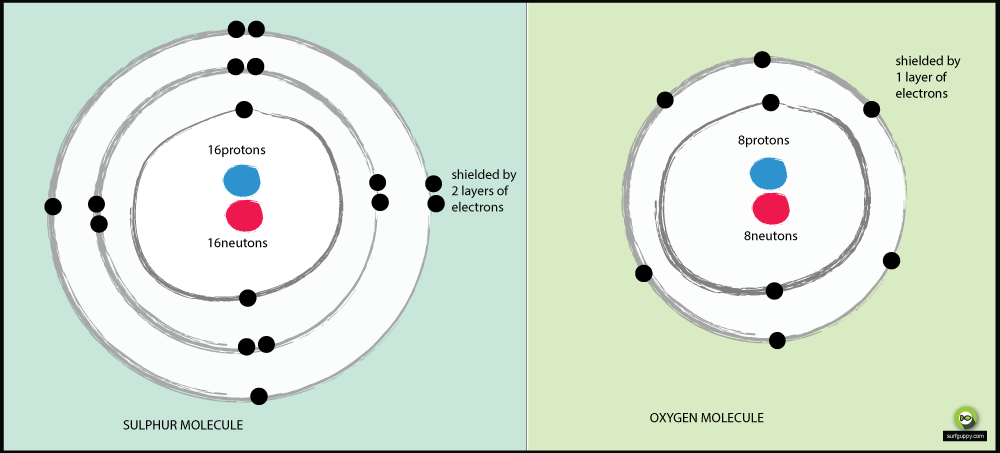
Pourquoi le soufre est-il moins électronégatif que l’oxygène ?
Raisons pour lesquelles l’oxygène est plus électronégatif que le soufre :
- L’oxygène a 2 niveaux d’énergie, le soufre en a 3
- Les électrons de liaison du soufre sont plus éloignés du noyau de l’atome
- Lorsque les électrons de liaison sont plus éloignés du noyau de l’atome, il y a moins d’attraction du noyau
- La paire d’électrons de liaison de l’oxygène subira plus d’attraction de son noyau que les électrons de liaison du soufre
- Par conséquent, l’oxygène est un atome plus électronégatif
Veuillez vous renseigner sur les électrons de valence avant de poursuivre. Electrons de valence

L’atome le plus petit a une électronégativité plus élevée
Des tendances d’électronégativité présentes dans le tableau périodique
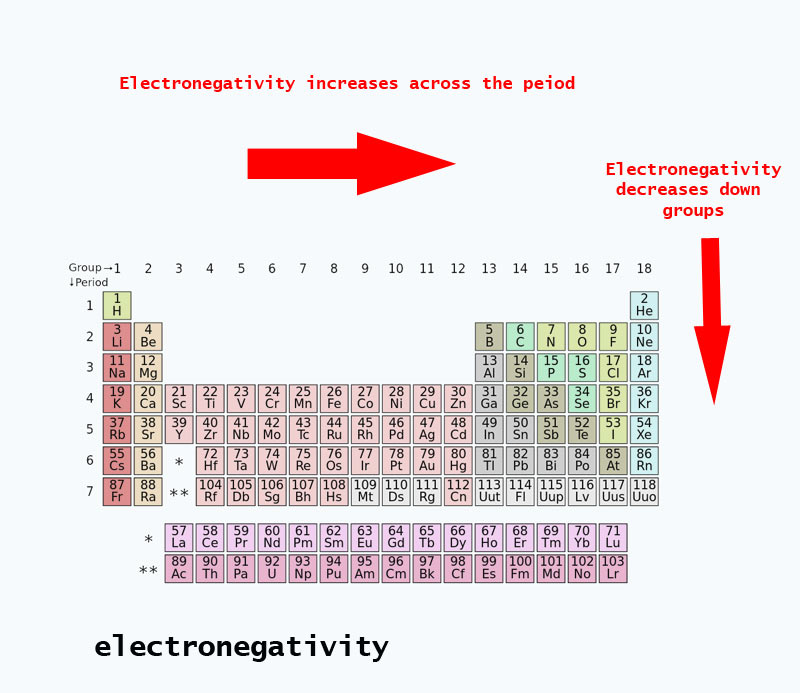
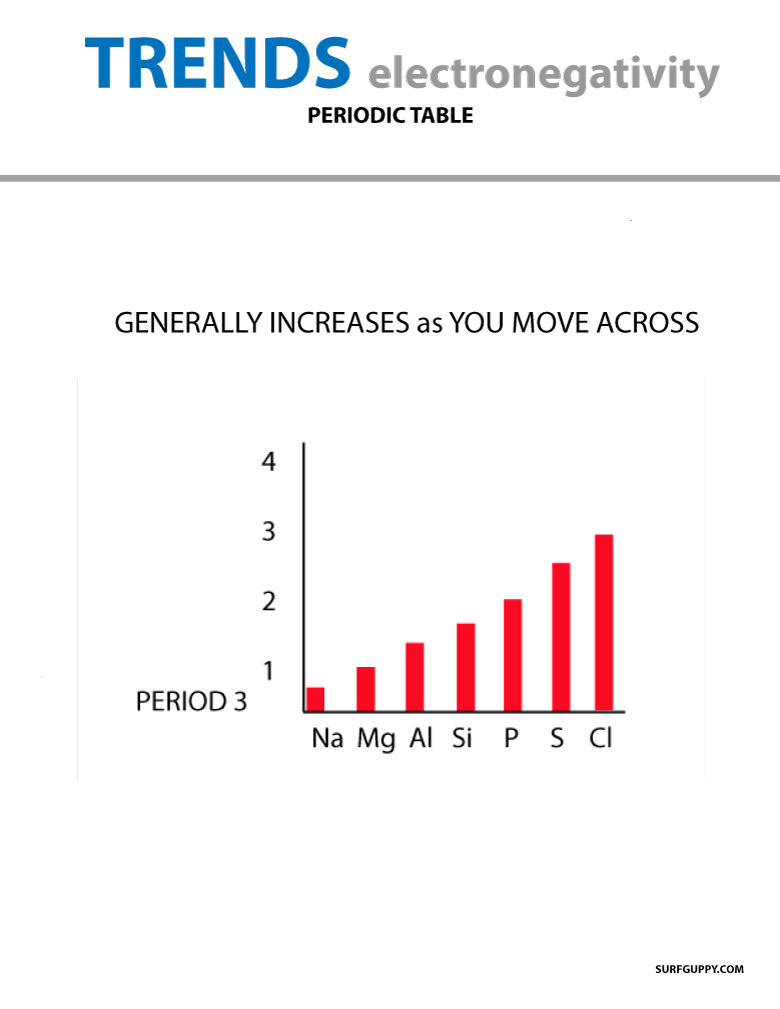
Lorsque vous vous déplacez dans le tableau périodique, le nombre de protons dans le noyau augmente (sans augmentation du niveau d’énergie), donc l’électronégativité augmente.
Lorsque le numéro atomique augmente vers le bas d’un groupe, il y a aussi une augmentation des niveaux d’énergie. Le rayon atomique est plus grand donc l’électronégativité diminue.
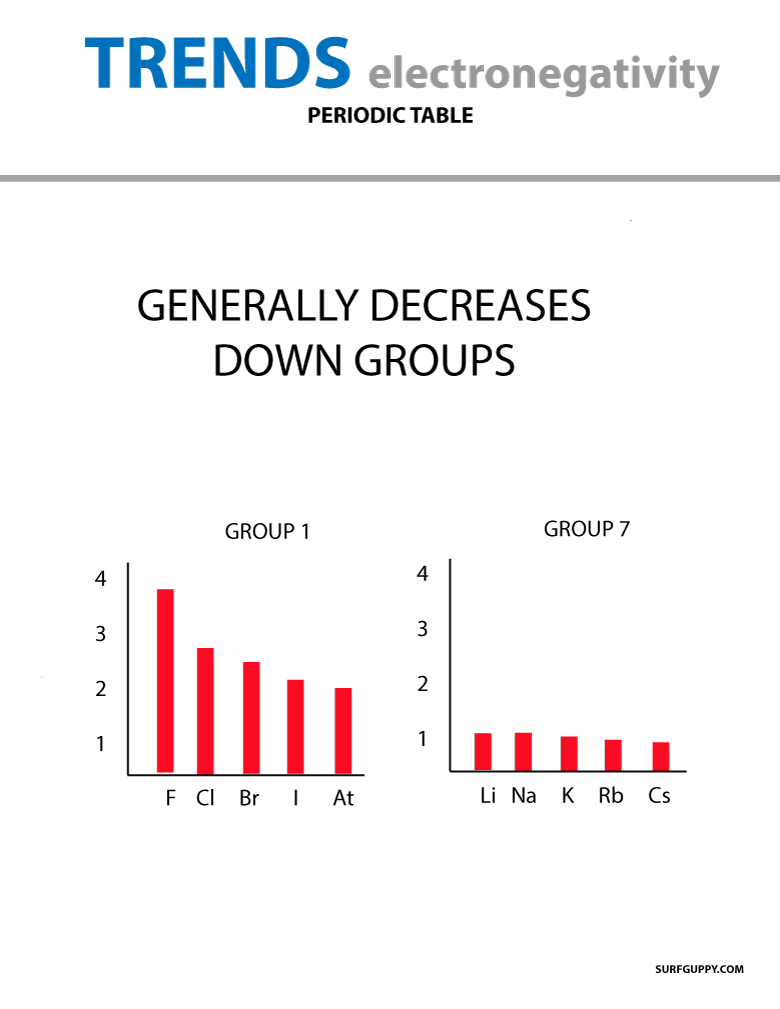
Tableau périodique de l’électronégativité
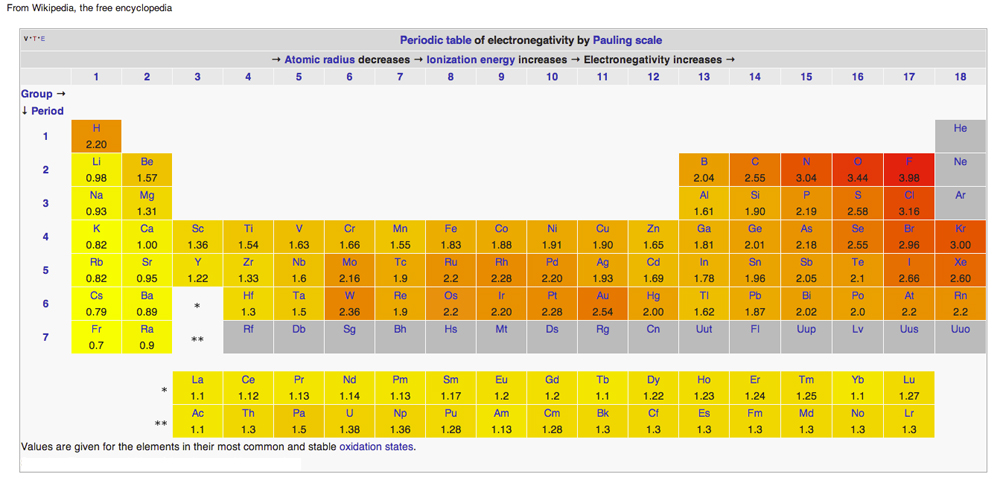 Diagramme de Wikipedia émis sous licences Creative Common
Diagramme de Wikipedia émis sous licences Creative Common
.
Leave a Reply