Pourquoi # »HF « # a-t-il un point d’ébullition plus bas que l’eau même si # »F « # est plus électronégatif que # »O « #?
Il y a beaucoup de facteurs compliqués. Voici ce que j’ai pu trouver :
- L’eau peut faire un réseau de liaison hydrogène plus équilibré (deux accepteurs et deux donneurs, au lieu d’un donneur et trois accepteurs), rendant le système en vrac plus uniformément interactif et donc plus fort dans son ensemble.
- L’eau forme un réseau de liaison hydrogène plus étendu (un environnement local tétraédrique tridimensionnel, au lieu d’un environnement en zigzag bidimensionnel), rendant le système en vrac moins facilement vaporisable.
- L’eau a généralement un angle d’interaction plus optimal, car il correspond plus étroitement à la géométrie électronique de la molécule et aligne les interactions le long du dipôle moléculaire, alors que # »HF « # aurait des liaisons hydrogène plus fortes (en termes de nombres bruts) si les interactions étaient linéaires.
DISCLAIMER : LONGUE RÉPONSE ! Aussi très visuelle.
La liaison hydrogène est la force intermoléculaire la plus forte à la fois dans # »HF « # et # »H »_2 « O « #. La force d’interaction dépend de la distance d’interaction, de l’angle d’interaction et de l’extensivité du réseau.
Lorsque nous tirons toutes les interactions de liaison hydrogène, et que nous supposons l’eau pure et le # »HF « # pur, nous obtenons (en isolant un ensemble choisi de molécules d’une matrice infinie)# » »^()## » »^()#:
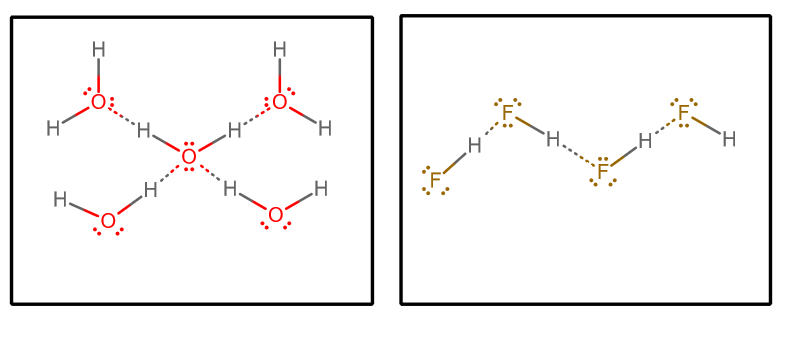
Nous pourrions alors considérer quelques facteurs :
- Nombre de donneurs et d’accepteurs de liaisons hydrogène
Chaque molécule d’eau peut accepter deux interactions de liaison hydrogène (via les paires solitaires) et donner deux interactions de liaison hydrogène (via les hydrogènes).
En revanche, chaque molécule de # »HF « # accepte trois interactions de liaison hydrogène (via les paires solitaires) et n’en donne qu’une (via l’hydrogène).
On pourrait alors avancer que l’eau possède un réseau de liaison hydrogène plus équilibré, ce qui rend le système global moins apte à se vaporiser. Cela soutiendrait le point d’ébullition plus élevé de l’eau par rapport à # »HF « #.
- Electronégativités de #bb(« F »)# et de #bb(« O »)#
# »F « # est plus électronégatif, il retient donc plus facilement sa densité électronique ; ainsi, on s’attend à ce que les paires solitaires soient des donneurs d’interactions de liaison hydrogène plus faibles que les paires solitaires sur # »O « #.
Cela semblerait prédire que chaque interaction individuelle de liaison hydrogène est plus faible, ce qui soutiendrait le point d’ébullition plus élevé de l’eau par rapport à # »HF « #, MAIS ceci est contredit par le point suivant.
- Forces brutes moyennes de liaison hydrogène dans #bb(« HF »)# vs. eau
# »O »-« H « cdotcdot : « O »-#, #DeltaH_(« H »-« bond ») ~~ « 21 kJ/mol « #
# »F »-« H « cdotcdot : « F »-#, #DeltaH_(« H »-« bond ») ~~ « 161.5 kJ/mol « #
Cette donnée de Wikipedia suggère que # »HF « # a des interactions de liaison hydrogène plus fortes entre les molécules de # »HF « # que dans l’eau.
Cela ne soutiendrait pas la preuve expérimentale que # »HF « # a un point d’ébullition beaucoup plus bas, mais c’est aussi juste un nombre brut et ne prend pas en compte, par exemple, les angles d’interaction dans le système global.
- Angles de liaison hydrogène observés et dimensions de l’interaction
# »HF « #, étant une molécule linéaire, a été vu pour avoir des interactions de liaison hydrogène en zigzag, dans deux dimensions, avec des angles de #116^@#. Un angle plus optimal serait de 180^@#, car cela donnerait des interactions dipolaires plus directes. Cela limite la force de liaison hydrogène de # »HF « #.
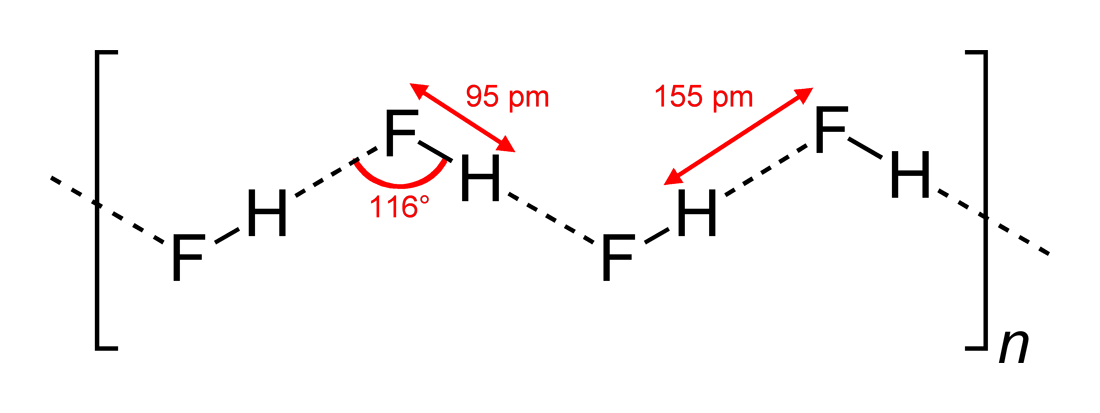
L’eau, étant une molécule courbée avec une géométrie électronique tétraédrique, peut se lier à l’hydrogène en trois dimensions.
Voici un exemple de l’amas tétraédrique que l’on trouve dans l’environnement local d’une interaction de liaison hydrogène dans l’eau :
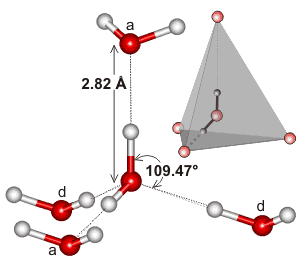
Il se peut que l’extensivité du réseau de liaison hydrogène, et la façon dont il tend à correspondre à la géométrie électronique de l’eau, soit ce qui rend le point d’ébullition de l’eau si élevé. Cela soutiendrait le point d’ébullition plus élevé de l’eau par rapport à # »HF « #.
Dans l’ensemble, ce sont les facteurs les moins contestés auxquels j’ai pu penser :
- L’eau peut faire un réseau de liaison hydrogène plus équilibré (deux accepteurs et deux donneurs, au lieu d’un donneur et de trois accepteurs), ce qui rend le système global plus uniformément interactif et donc plus fort dans son ensemble.
- L’eau forme un réseau de liaison hydrogène plus étendu (un environnement local tétraédrique tridimensionnel, plutôt qu’un environnement en zigzag bidimensionnel), rendant le système en vrac moins facilement vaporisable.
- L’eau a généralement un angle d’interaction plus optimal, car il correspond davantage à la géométrie électronique de la molécule et aligne les interactions le long du dipôle moléculaire, alors que # »HF « # aurait des liaisons hydrogène plus fortes (en termes de nombres bruts) si les interactions étaient linéaires.
Leave a Reply