Pharmacologie de l’héparine non fractionnée
Ce médicament est un élément de base de l’anticoagulation en soins intensifs, et on a intérêt à bien connaître ses propriétés.
Propriétés chimiques et structure moléculaire
L’héparine est un mélange hétérogène de mucopolysaccharides, appelés glycosaminoglycanes.
C’est essentiellement un disaccharide polymérisé, un amidon.
Chaque disaccharide répété est variablement sulfaté. Voici une image que j’ai arrachée à Wikipedia:
Parce que les polymères disaccharidiques sont de longueurs variables, l’héparine a un poids moléculaire moyen de 3 à 30 kDa. Sauf si elle est fractionnée, auquel cas on peut contrôler pour n’avoir que la version de faible poids moléculaire.
Sa longueur de polymère est vraiment très très aléatoire, principalement parce que l’héparine de votre hôpital est issue du poumon bovin ou de l’intestin porcin, et que ces animaux sont largement désintéressés par le contrôle qualité de la chimie industrielle. La première héparine a en fait été dérivée de cellules de foie canin en 1916, par un étudiant en deuxième année de médecine.
Qu’est-ce que c’est qu’une « unité » d’héparine ?
Une unité d’héparine est la quantité nécessaire pour garder 1ml de sang de chat liquide pendant 24 heures à 0 degré Celsius. Cette définition inhabituellement peu respectueuse des animaux provient d’un certain WH Howell, qui a laissé du sang de chat toute la nuit dans le réfrigérateur. Il n’a pas coagulé – il a à moitié coagulé – mais il est resté liquide malgré tout. De nos jours, la norme internationale sur l’héparine utilise du plasma de mouton, probablement parce que les moutons sont plus faciles à capturer et à exsanguiner.
Relations chimiques
Je suppose que ce serait les héparines fractionnées (par exemple, l’énoxaparine).
Les apparentés fonctionnels sont tous les autres inhibiteurs indirects de la thrombine parmi lesquels le Fondaparinux
Administration et absorption
Il est généralement administré par voie intraveineuse, ou sous-cutanée (d’où il se dissocie progressivement).
-
- La voie d’administration sous-cutanée met 1 à 2 heures pour atteindre le pic d’effet.
Par la suite, son volume de distribution est de 40 à 70ml/kg, essentiellement confiné au volume intravasculaire.
Elle ne pénètre pas le placenta, ce qui la rend particulièrement utile pendant la grossesse.
Et si je la buvais ?
L’héparine orale a une très mauvaise biodisponibilité. C’est une molécule trop grosse, et sa charge est trop négative pour être absorbée facilement. C’est pourquoi elle se distribue presque uniquement dans le volume circulant. Des hommes courageux ont essayé de cuisiner avec de l’héparine pour la rendre plus biodisponible par voie orale. En outre, 45 personnes courageuses ont bu 20 000 unités d’héparine et ont ensuite laissé leur TCA être testé – il s’avère qu’il augmente de 2,3 secondes en moyenne, ce qui n’est pas beaucoup, mais qui démontre qu’il y a une certaine absorption. L’étude n’est pas à ma disposition, mais j’aimerais bien qu’un volontaire me dise quel goût avait l’héparine.
Métabolisme et clairance
Il existe 2 mécanismes : la clairance rapide saturable et la clairance lente de premier ordre.
La demi-vie dépend de la dose.
Demi-vie de 25 unités par Kg = 30 minutes
Demi-vie de 100 unités par Kg = 60 minutes
Demi-vie de 400 unités par Kg = 150 minutes
A des doses plus faibles, la demi-vie est très courte (parce que la plupart de l’héparine que vous perfusez se lie directement aux macrophages et aux cellules endothéliales, où elle est dépolymérisée). Ce mécanisme devient saturé à des doses plus élevées, et l’élimination devient plus lente, avec une vitesse qui est liée à la dose.
La clairance zéro-ordre saturable rapide :
- En raison de la liaison aux protéines de liaison à l’héparine, aux macrophages et aux cellules endothéliales.
- Ainsi liée, l’héparine devient inutile et finit par être dépolymérisée.
- C’est l’élimination linéaire d’ordre zéro observée à faible dose.
La faible clairance de premier ordre:
- L’excrétion rénale… peut-être ? Pour être honnête, ce n’est probablement pas rénal. Après des doses énormes, une petite quantité est excrétée dans l’urine.
- Actuellement, le MIMS admet que « le devenir métabolique de l’héparine est mal compris », mais mentionne que le système réticulo-endothélial peut jouer un rôle dans la séquestration et la destruction de l’héparine.
Mécanisme d’action
L’héparine est présente dans l’organisme dans les granules sécrétoires des mastocytes. On la trouve également chez de nombreux animaux, dont divers invertébrés qui n’ont rien qui ressemble de près ou de loin à la cascade de coagulation humaine. Ce qui est bizarre.
Donc personne ne sait vraiment à quoi elle sert exactement.
Mais, chez l’homme…
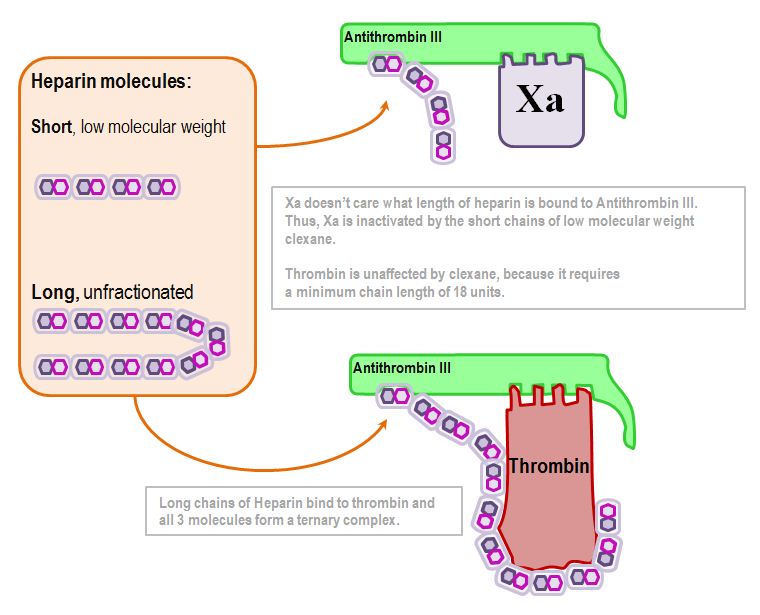
L’héparine augmente l’activité de l’antithrombine-III par un facteur 1000.
Elle le fait en se liant à l’antithrombine III et en provoquant un changement de conformation du site actif.
Dans mon schéma enfantin, le flicage de la queue moléculaire de l’Antithrombine-III représente la disponibilité accrue du site actif.
Ainsi activée, l’Antithrombine III inactive plusieurs facteurs – mais surtout Xa et IIa (Thrombine).
Nous arrivons maintenant à un point important.
L’inactivation de la thrombine dépend de la longueur de la molécule d’héparine :
18 unités disaccharidiques est le nombre clé (environ 5kDa)
L’inactivation de Xa est indépendante de la longueur : tant qu’une quelconque héparine lui est liée, l’antithrombine-III inactive Xa.
Cela sous-tend la différence de pharmacocinétique entre l’héparine de bas poids moléculaire et l’héparine non fractionnée.
Donc, en résumé, l’héparine non fractionnée affecte la thrombine, alors que l’héparine de bas poids moléculaire n’affecte que Xa.
Cela explique aussi pourquoi la mesure du TCA ne va pas vous dire si votre dose de clexane est thérapeutique.
L’héparine non fractionnée affecte également l’activité du facteur 9, mais pas celle du facteur 7. Ainsi, les voies intrinsèque et commune sont affectées, ce qui augmente le TCA. La voie extrinsèque n’est pas affectée, et le TAP n’augmente pas beaucoup. Comme la thrombine n’est pas affectée par l’héparine de bas poids moléculaire, le TCA reste essentiellement inchangé.
Indications d’utilisation
- Bien, son anticoagulation, qui est un sujet beaucoup plus vaste. La surveillance du TCA est la question clé.
- En bref, l’héparine est utilisée dans la prophylaxie de la TVP, le traitement de la thrombose et de la thromboembolie, dans les syndromes coronariens aigus et dans le maintien des circuits de dialyse à débit lent.
- La prise en charge pharmacologique de la TVP pendant la grossesse reposait auparavant sur l’héparine non fractionnée. L’étude PROTECT, qui a comparé l’héparine non fractionnée à l’HBPM, n’a pas trouvé beaucoup de différence dans le taux de TVP (toujours autour de 5,6 %), mais le groupe HBPM a eu moins d’EP et il y avait une tendance à moins de HITS.
Contra-indications
- Si cela provoque des saignements, cela vous fait repenser l’héparine. Ceci résume largement les contre-indications d’un point de vue pratique. La menace imminente de procédures invasives est la principale contre-indication.
- La seule contre-indication absolue est un antécédent de TIH ou de TIH.
Interactions
En dehors de la tendance stupidement évidente à augmenter le risque de saignement chez les personnes qui sont également anticoagulées par une autre sorte de médicaments anticoagulants, l’héparine présente peu de véritables interactions pharmacologiques :
| Les effets de l’héparine sont potentialisés par | Les effets de l’héparine sont antagonisés par |
| Hydroxycholoroquine | Antihistaminiques |
| Probénécide | Digoxine |
| Valproate de sodium | Tétracyclines |
| Vitamine C | |
| Nicotine |
Complications chroniques
Héparine-…Induced Thrombocytopenia Syndrome (HITS) plus Heparin-Induced Thrombocytopenia and Thrombosis Syndrome (HITTS)
-
- Trombocytopénie à médiation immunitaire bien discutée par Franchini en 2005
-
-
- Plus fréquemment associée à l’héparine non fractionnée
- Plus fréquente chez les personnes âgées ; inédite chez les enfants
- Les patients en chirurgie cardiaque et orthopédique sont plus à risque
- Typiquement, elle survient 5 à 10 jours après le début de l’héparine
-
-
- Trombocytopénie à médiation immunitaire bien discutée par Franchini en 2005
-
- Elle existe en 2 saveurs : type 1 et type 2.
Touche le type 1 :
- Trombocytopénie transitoire légère, numération plaquettaire supérieure à 100
- Totalement réversible par l’arrêt de l’héparine
- S’observe dans jusqu’à 10% des brevets
- Non associée à un risque accru de thrombose
- Probablement même pas d’origine immunitaire
HITS de type 2 :
- Une méchante thrombocytopénie sévère, la numération plaquettaire pourrait tomber à zéro
- S’observe dans quelque chose comme 1% des brevets
- Associé à une thrombose dans 30% des cas
- Dû à la formation d’anticorps contre le complexe composé du facteur plaquettaire 4 (PF4) et de l’héparine ; ce complexe se forme à la surface des plaquettes.
- Lorsque l’anticorps de la TIH se lie à ce complexe, il provoque l’activation et l’agrégation des plaquettes, et il y a donc une tendance à la coagulation (car toutes les plaquettes sont activées) ainsi qu’une tendance simultanée aux saignements (car il y a une destruction des plaquettes recouvertes d’anticorps dans le système réticulo-endothélial)
Une fois que votre patient a une TIH, il doit toujours être anticoagulé.
Les inhibiteurs directs de la thrombine sont le traitement de choix.
Autres effets de l’utilisation chronique de l’héparine
- Ostéopénie
- L’héparine pour une raison quelconque active les ostéoclastes, et la résorption osseuse augmente.
- Déficience minéralocorticoïde
- L’héparine semble antagoniser les effets de l’ACTH
- Effets secondaires bizarres
- Alopécie- qui sait comment.
- Élévation de l’AST et de l’ALT – qui sait pourquoi.
Toxicité aiguë et surdosage
- Le principal effet indésirable aigu est le saignement. Très peu de personnes sont véritablement allergiques à l’héparine.
- Une nécrose cutanée peut survenir aux sites d’injection sous-cutanée en raison d’une thrombose des petits vaisseaux.
Gestion de la toxicité aiguë
Si l’on a surdosé son héparinisation, le TCA va augmenter de façon spectaculaire et l’on mya des complications hémorragiques. On peut se surprendre à penser : « J’aimerais pouvoir remettre la cascade de coagulation en place ». Ceci peut être accompli avec la protamine.
Réversion de l’héparinisation avec le sulfate de protamine
- 1mg inverse 100 unités
- Pas plus de 50mg à la fois
- Il est administré LENTEMENT en perfusion IV
Les dangers de la protamine
Le sulfate de protamine est loin d’être bénin. Il s’agit d’une substance étrangère et inhabituelle – un polypeptide fortement alcalin qui se lie à l’héparine fortement acide de manière irréversible, et diminue ainsi son effet anticoagulant sur l’antithrombine-3. Cependant, à des doses ridicules, la protamine elle-même agira comme un anticoagulant.
Parmi ses nombreux effets indésirables, on peut citer :
- Hypotension catastrophique due à la vasodilatation, qui est heureusement brève (seulement environ 3-4 min) – cela semble être le résultat de la libération systémique d’histamine, déclenchée d’une sorte de manière directement complémentaire-activante par la circulation des complexes héparine-protamine
- Hypertension pulmonaire due à l’activité vasoconstrictrice localisée du thromboxane, activée par une réaction anaphylactoïde à la protamine
- Anaphylaxie (c’est après tout un produit du poisson)
Résistance à l’héparinothérapie
Il existe des situations dans lesquelles de grandes quantités d’héparine IV ne parviennent pas à augmenter le TCA malgré tous vos efforts. On pourrait appeler cela « résistance à l’héparine », ou « insensibilité à l’héparine ».
Il y a plusieurs raisons pour lesquelles on peut être résistant à l’héparine :
- Augmentation des taux de protéines liant l’héparine (toutes sont des réactifs de phase aiguë)
- Faible taux d’antithrombine-III (c. à d. rien pour l’héparine de se lier à l’héparine).c’est-à-dire rien pour que l’héparine se lie)
- Une augmentation de la clairance de l’héparine (par exemple en cas de maladie du foie)
- Des taux élevés de facteur VIII
UpToDate propose un bon article sur le déficit en antithrombine III. Soit vous ne parvenez pas, de manière héréditaire, à en synthétiser suffisamment, soit votre foie est tellement endommagé qu’il ne peut en produire suffisamment. Ou encore, elle a été utilisée d’une manière ou d’une autre, par exemple dans le cadre d’une CIVD, d’une MAHA ou d’un circuit de dérivation. Enfin, il est possible que vous le perdiez avec d’autres protéines via vos reins néphrotiques qui fuient.
La prise en charge de la déficience en AT-III est, de manière prévisible, la supplémentation en AT-III.
Si le facteur purifié coûteux n’est pas disponible, le FFP suffira.
Coagulation efficace du patient résistant à l’héparine
Il existe plusieurs stratégies que l’on peut employer. Le choix spécifique repose sur ce qui cause exactement la résistance à l’héparine.
Il existe de bons articles à ce sujet. La plupart d’entre eux n’abordent pas l’anticoagulation de routine d’un patient aléatoire qui se trouve avoir des doses croissantes d’héparine ; je suppose que l’on suppose généralement que l’on continuera à augmenter la dose jusqu’à ce que les objectifs thérapeutiques soient atteints. Cependant, il y a des situations où l’anticoagulation est d’une importance critique, et l’un de ces scénarios est le circuit de pontage cardio-pulmonaire.
– Passer à l’héparine de bas poids moléculaire, au lieu de l’héparine non fractionnée
– Donner du cryoprécipité et/ou du plasma frais congelé (si le déficit en ATIII est confirmé )
– Donner du concentré d’antithrombine III
Ou, vous pourriez envisager d’utiliser autre chose, comme un inhibiteur direct de la thrombine (hirudine ou argobatran)
.




Leave a Reply