Moustiques autodestructeurs et rongeurs stérilisés : la promesse des drives génétiques
Austin Burt et Andrea Crisanti tentaient depuis huit ans de détourner le génome du moustique. Ils voulaient contourner la sélection naturelle et brancher un gène qui se répandrait dans la population plus rapidement qu’une mutation transmise par le processus habituel de l’héritage. Dans le fond de leur esprit, il y avait un moyen de prévenir le paludisme en diffusant un gène pour assommer les populations de moustiques afin qu’ils ne puissent pas transmettre la maladie.
Crisanti se souvient avoir échoué encore et encore. Mais finalement, en 2011, les deux généticiens de l’Imperial College London ont reçu les résultats d’ADN qu’ils espéraient : un gène qu’ils avaient inséré dans le génome du moustique avait rayonné dans la population, atteignant plus de 85 % des descendants des insectes1.
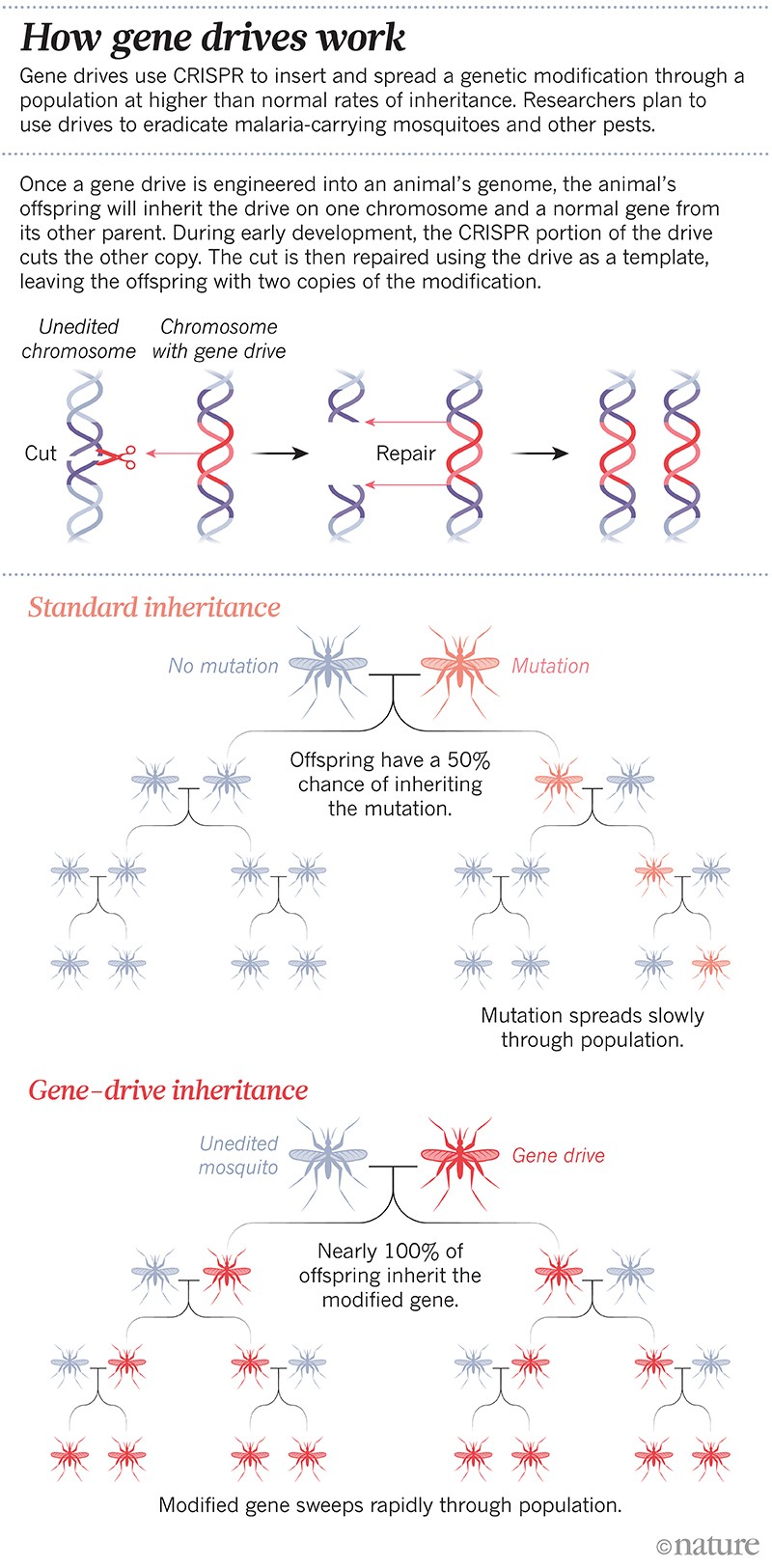
C’était le premier « gene drive » conçu : une modification génétique conçue pour se propager dans une population à des taux d’hérédité supérieurs à la normale. Le « gene drive » est rapidement devenu une technologie de routine dans certains laboratoires ; les scientifiques peuvent maintenant le mettre au point en quelques mois. La technique s’appuie sur l’outil d’édition de gènes CRISPR et sur quelques morceaux d’ARN pour modifier ou réduire au silence un gène spécifique, ou en insérer un nouveau. Dans la génération suivante, l’ensemble du mécanisme se copie sur son chromosome partenaire, de sorte que le génome ne possède plus la version naturelle du gène choisi, mais deux copies du mécanisme. De cette façon, le changement est transmis jusqu’à 100 % de la progéniture, plutôt qu’environ 50 % (voir « Comment fonctionnent les drives génétiques »).
Depuis 2014, les scientifiques ont conçu des systèmes de drive génique basés sur CRISPR chez les moustiques, les mouches à fruits et les champignons, et les développent actuellement chez les souris. Mais ce n’est que le début de l’histoire. La question de savoir si le gene drive est possible a été supplantée par d’autres inconnues : l’efficacité de ces systèmes, la manière de les tester et la question de savoir qui doit réglementer cette technologie. Les manipulations génétiques ont été proposées comme un moyen de réduire ou d’éliminer les maladies transmises par les insectes, de contrôler les espèces envahissantes et même d’inverser la résistance des parasites aux insecticides. Aucune commande génétique n’a encore été libérée dans la nature, mais la technologie pourrait en principe être prête d’ici trois ans, déclare Crisanti. Il collabore avec Target Malaria, un consortium de recherche international à but non lucratif qui cherche à utiliser des moustiques à commande génétique pour lutter contre le paludisme en Afrique. Le 1er juillet, le groupe a lâché un lot test de moustiques – génétiquement modifiés mais pas encore équipés de lecteurs de gènes – dans un village du Burkina Faso.
Les lecteurs de gènes ne ressemblent à aucune fixation écologique jamais testée auparavant, déclare Fredros Okumu, directeur scientifique de l’Institut de santé Ifakara à Dar es Salaam, en Tanzanie. « Les lecteurs de gènes se répandront d’eux-mêmes », dit-il. « Nous devons préparer les gens et partager les informations ouvertement avec tous les pays concernés. »
Les défis techniques ne sont pas aussi redoutables que les défis sociaux et diplomatiques, affirme le bio-ingénieur Kevin Esvelt du Massachusetts Institute of Technology (MIT) Media Lab à Cambridge, qui a été parmi les premiers à construire un lecteur de gènes basé sur CRISPR. « Des technologies comme celle-ci ont des conséquences réelles sur la vie des gens qui peuvent être presque immédiates. »
Compte tenu des préoccupations potentielles concernant les lecteurs de gènes, Nature explore cinq questions clés sur la technologie et ses applications.
Les lecteurs de gènes fonctionneront-ils même ?
Construire un lecteur de gènes pour manipuler ou éradiquer une population revient à choisir un combat avec la sélection naturelle, et ce combat pourrait ne pas être facile à gagner.
Dès que les chercheurs ont commencé à fabriquer régulièrement des lecteurs de gènes en laboratoire, les animaux ont développé une résistance contre eux – accumulant des mutations qui empêchent les lecteurs de se propager. Dans les tests de deux drives insérés dans des mouches à fruits, par exemple, des variants génétiques conférant une résistance se sont formés fréquemment2. Le plus souvent, les mutations modifient une séquence que CRISPR est censé reconnaître, empêchant la modification du gène. Lors d’expériences avec des moustiques en cage, Crisanti et Tony Nolan, chercheur de Target Malaria, ont observé la diminution progressive de la fréquence d’une commande génétique sur plusieurs générations en raison de mutations résistantes au niveau du gène cible3. Les résultats ont bouleversé le domaine. La résistance rendrait-elle les lecteurs de gènes impuissants ?
Pas nécessairement – si les chercheurs choisissent la bonne cible. Certains gènes sont hautement conservés, ce qui signifie que tout changement est susceptible de tuer leurs propriétaires. Choisir ces gènes comme cible d’entraînement signifie moins de mutations et moins de résistance. En septembre 2018, Crisanti et son équipe ont écrasé une population de moustiques Anopheles gambiae en cage avec une efficacité de 100 %4 en fabriquant un drive qui perturbe un gène de fertilité appelé doublesex. Avec le drive en place, les moustiques femelles ne peuvent pas piquer et ne pondent pas d’œufs ; en 8 à 12 générations, les populations en cage n’ont produit aucun œuf. Et parce qu’il est crucial pour la procréation, le doublex est résistant aux mutations, y compris celles qui conféreraient une résistance à une construction de drive.
L’équipe a mené neuf expériences en cage de plus d’un million d’insertions de drive ciblant le doublex et n’a vu aucune résistance, dit Crisanti. Maintenant, l’équipe adapte le drive pour couper non pas un mais deux loci sur le gène doublex, comme pour traiter une maladie avec une combinaison de médicaments. « Je veux m’assurer que la probabilité de développer une résistance est très, très faible avant de dire que la technologie est prête pour le terrain », dit Crisanti.
Chez les mammifères, les scientifiques ont des défis beaucoup plus fondamentaux que la résistance à gérer. L’année dernière, Kim Cooper et ses collègues de l’Université de Californie, San Diego (UCSD), ont conçu les débuts d’un entraînement génique chez un mammifère – un entraînement qui interrompt un gène de souris, Tyr, et rend le pelage des animaux blanc5. Le mécanisme d’entraînement n’a été efficace qu’à 72 % pour se copier dans le génome et n’a pas bien fonctionné dans la lignée germinale mâle, explique Cooper. Elle soupçonne que c’est parce que la division cellulaire se produit à des moments différents dans la formation des œufs et des spermatozoïdes, ce qui semble affecter la capacité de la commande à se copier avec succès d’un chromosome à l’autre.
Dans cette expérience, la commande ne s’est pas autopropagée et Cooper n’a pas suivi le trait sur plusieurs générations, elle souligne donc qu’elle ne peut techniquement pas être considérée comme une commande de gènes. « Il y a encore tellement de travail à faire pour montrer que quelque chose comme cela est même faisable », ajoute-t-elle.
À quoi d’autre les lecteurs de gènes sont-ils bons ?
Bien que les applications de moustiques dominent le domaine, les utilisations proposées des lecteurs de gènes comprennent également la conservation des écosystèmes délicats et l’accélération du travail de laboratoire.
Certains organismes ont des génomes qui sont difficiles à manipuler, mais le faire pourrait aider les chercheurs à les étudier. Prenez Candida albicans, un champignon pathogène humain souvent résistant aux médicaments. En tant que chercheuse postdoctorale au Broad Institute et au MIT à Cambridge (Massachusetts), Rebecca Shapiro a mis au point un système6 permettant d’introduire des mutations dans le champignon avec une efficacité proche de 100 %. Elle peut désormais élever le champignon de manière à réduire au silence deux gènes indépendants et léguer ces mutations à la descendance. « Cela fonctionne de manière incroyablement efficace », déclare Shapiro, qui travaille désormais à l’université de Guelph, au Canada. À l’UCSD, Cooper utilise les lecteurs de gènes dans un but similaire, pour créer et étudier des traits complexes chez les souris.
Le programme Genetic Biocontrol of Invasive Rodents (GBIRd) veut faire plus avec les souris à lecteurs de gènes que les étudier en laboratoire. GBIRd, un partenariat d’universités, de gouvernements et d’organisations non gouvernementales géré par le groupe à but non lucratif Island Conservation, veut utiliser cette technologie pour éliminer les rongeurs envahissants des îles, où ils font des ravages sur la faune indigène. Des pesticides sont actuellement utilisés à cette fin, mais ils sont coûteux et difficiles à utiliser sur les grandes îles à population humaine. Ils ne sont réalisables que sur environ 15 % des îles, explique Royden Saah, responsable du programme GBIRd. « Nous essayons d’examiner les technologies qui permettraient de s’occuper des 85 % restants. »
Les membres du GBIRd, David Threadgill de l’Université A&M du Texas à College Station et Paul Thomas de l’Université d’Adélaïde en Australie, développent des technologies d’entraînement génétique chez la souris, bien que Saah estime qu’il faudra plusieurs années avant que ces entraînements fonctionnent avec succès.
En attendant, certains chercheurs sur les moustiques espèrent essayer quelque chose de plus subtil que l’élimination complète des populations d’insectes comme moyen de prévenir les maladies. Dans une préimpression de mai7, Omar Akbari et ses collègues de l’UCSD ont modifié des moustiques Aedes aegypti pour qu’ils expriment un anticorps qui protège les insectes contre les quatre principales souches de dengue. Ils attachent maintenant cet anticorps à un disque pour voir s’il se propage. Akbari construit également un lecteur de gènes polyvalent qui active une toxine lorsque n’importe quel virus, et pas seulement la dengue, infecte A. aegypti. « Nous voulons construire un cheval de Troie dans le moustique », explique Akbari. « Lorsqu’un moustique est infecté par un virus – qu’il s’agisse de la dengue, de Zika, du chikungunya, de la fièvre jaune, peu importe – il active notre système, qui tue le moustique. »
Les lecteurs de gènes peuvent-ils être contrôlés ?
Avant que Kevin Esvelt ne construise un seul lecteur de gènes basé sur CRISPR, il se réveillait avec des sueurs froides en pensant aux ramifications. « J’ai réalisé, oh hey, cela ne va pas seulement concerner la malaria, cela va potentiellement être quelque chose que n’importe quel individu capable de fabriquer une mouche à fruits transgénique pourrait construire pour modifier toutes les mouches à fruits. »
Il n’est donc pas surprenant qu’en 2014, lorsqu’Esvelt et le généticien George Church ont construit leur premier lecteur de gènes à la Harvard Medical School à Boston, Massachusetts, ils ont simultanément construit un lecteur d’inversion pour écraser le lecteur original sur commande8.
Le reste du domaine a suivi, développant des lecteurs de gènes avec des contrôles intégrés, des dérogations externes ou les deux. Le financement de la plupart de ces efforts est assuré par la Defense Advanced Research Projects Agency (DARPA), l’organe de recherche du ministère américain de la défense. En 2017, le programme Safe Genes de la DARPA a annoncé qu’il dépensait 65 millions de dollars américains dans sept équipes de recherche américaines pour étudier comment contrôler, contrer et inverser les lecteurs de gènes. « Nous atténuons le potentiel d’utilisation abusive, qu’elle soit accidentelle ou infâme », explique Renee Wegrzyn, responsable du programme Safe Genes.
Esvelt, financé dans la phase initiale du programme, a conçu un lecteur auto-épuisant connu sous le nom de lecteur de marguerite. L’entraînement est conçu pour perdre un maillon à la fois, comme si l’on arrachait une fleur d’une chaîne reliée de la tête à la tige, jusqu’à ce qu’il s’épuise sur plusieurs générations9.
À l’UCSD, l’équipe d’Akbari financée par la DARPA développe des entraînements génétiques qui ne devraient pas pouvoir se propager au-delà d’une population cible de moustiques ou de mouches. L’une de ces commandes nécessite une libération continue pendant de nombreuses générations. Lorsque ces libérations cessent, il se dilue avec les versions sauvages du gène et s’élimine de lui-même en quatre ans. Selon M. Akbari, cela pourrait être suffisant pour éliminer un virus tel que le Zika ou la dengue d’une population de moustiques. « C’est quelque chose qui est, à mon avis, un peu plus sûr et qui reste assez efficace ». L’équipe a déjà produit plusieurs versions de ces lecteurs pour A. aegypti, le principal vecteur du virus de la dengue10.
L’équipe Target Malaria développe également une contre-mesure, financée par la DARPA, pour arrêter la propagation du lecteur doublex dans une population.
Comment peut-on tester les lecteurs de gènes ?
Au lieu d’un test sur le terrain – que le contrat Safe Genes de la DARPA interdit expressément et pour lequel les chercheurs s’accordent à dire que la technologie n’est pas prête – les équipes mettent à l’échelle les expériences en cage et construisent des modèles écologiques pour explorer les avantages et les risques d’une libération sauvage en toute sécurité.
Dans la ville de Terni, dans le centre de l’Italie, Crisanti et Nolan ont enrichi leurs cages à moustiques avec des conditions environnementales changeantes. « Nous voulons passer à l’échelle supérieure afin de le tester sur différents fonds génétiques, dans des scénarios plus réalistes », explique Nolan, qui dirige désormais un laboratoire à la Liverpool School of Tropical Medicine, au Royaume-Uni. Lui et Crisanti veulent reproduire le comportement d’accouplement naturel – comme les mâles formant des essaims pour attirer les femelles – pour voir comment cela affecte la propagation d’un entraînement génétique.
La dynamique de la propagation de l’entraînement dans ces cages jusqu’à présent est « prometteuse », dit Crisanti – l’entraînement est transmis efficacement sans signes de résistance. Si aucun problème ne survient dans les expériences en cage de plus grande envergure, l’équipe remettra la technologie à des groupes indépendants pour qu’ils la testent, en vue d’obtenir l’approbation réglementaire dans environ trois ans, dit-il.
L’équipe de Target Malaria construit également des modèles écologiques des lieux de lâcher potentiels pour élaborer la dynamique sur le terrain. L’étude la plus récente11 modélise les populations de moustiques dans plus de 40 000 localités du Burkina Faso et des pays voisins. Elle tient compte des rivières, des lacs et des précipitations, ainsi que des données de terrain sur le déplacement des moustiques. Les résultats11 montrent que l’introduction répétée, plutôt qu’un seul lâcher, de moustiques modifiés sur quelques années à travers les villages sera nécessaire pour réduire le nombre global des insectes.
« La théorie dit qu’en principe, si vous relâchez une fois, cela se répandrait à l’échelle du continent. En réalité, cela se produirait très lentement », explique le biologiste des populations Charles Godfray de l’Université d’Oxford, au Royaume-Uni, collaborateur de Target Malaria et chercheur principal de l’étude.
Une autre préoccupation est que les lecteurs de gènes ont le potentiel de modifier des populations entières et donc des écosystèmes entiers. Ils pourraient aussi, en théorie, avoir un impact négatif sur la santé humaine en faisant évoluer le parasite du paludisme pour qu’il soit plus virulent ou qu’il soit porté par un autre hôte, explique la biologiste moléculaire et bioéthicienne Natalie Kofler. Elle est la directrice fondatrice du groupe Editing Nature de l’université de Yale à New Haven, dans le Connecticut, qui a pour objectif de s’attaquer aux technologies génétiques environnementales dans le monde entier. « Cette technologie a le potentiel d’être immensément puissante et de changer le cours des choses que nous ne sommes peut-être pas en mesure de prédire », dit Kofler.
Qui décide quand utiliser un drive génétique ?
Pour les essais de médicaments, une entreprise peut commencer à préparer un test sur le terrain seulement un an ou deux à l’avance. Les lecteurs de gènes auront besoin de plus de temps, dit Okumu. L’année dernière, il a fait partie d’un groupe de travail scientifique de 15 membres, organisé par la Fondation pour les Instituts nationaux de la santé, qui a présenté une série de recommandations12 pour l’utilisation de moustiques à commande génétique en Afrique subsaharienne.
Le rapport souligne que les gouvernements, les communautés et les scientifiques locaux auront besoin de temps pour absorber la science et être habilités à réglementer la technologie. « Je le dis avec toute ma conviction – en fin de compte, les meilleures personnes pour prendre ces décisions sont les pays eux-mêmes », dit Okumu.
En 2017, Kofler a réuni un groupe de scientifiques et d’éthiciens pour s’attaquer aux questions sociétales entourant les lecteurs de gènes13. « Les principales questions tournent autour de la justice », explique Kofler. Dans les discussions sur la libération d’un organisme génétiquement modifié dans un environnement africain, les groupes qui ont été historiquement marginalisés ont le droit de faire partie du processus de décision, dit-elle.
Okumu veut que les scientifiques africains développent et testent la technologie du gene drive localement, ce qui nécessitera le respect et la volonté des bailleurs de fonds de soutenir de tels efforts. « Les gens ont peur de l’inconnu, et l’inconnu en ce moment est présenté d’un point de vue occidental », dit Okumu. « J’attends avec impatience le jour où nous pourrons construire ces constructions dans nos propres laboratoires et, de cette façon, établir une confiance locale. »
En août 2018, l’Agence nationale de biosécurité du Burkina Faso a autorisé Target Malaria à libérer une souche de moustique mâle stérile génétiquement modifiée, la première de ce type sur le continent africain. La semaine dernière, l’équipe a libéré environ 6 400 moustiques qui ont été génétiquement modifiés mais qui n’hébergent pas de lecteurs de gènes. Les scientifiques espèrent que cette libération améliorera la perception de la recherche et fournira des données pour de futures libérations.
Et bien que les souris à commande génétique soient loin d’être prêtes à être libérées, le GBIRd travaille déjà avec des évaluateurs de risques, des éthiciens et des écologistes pour identifier une île pour un premier essai sur le terrain. « Nous voulons être sûrs de bien faire les choses », déclare M. Saah. « Peu importe la vitesse à laquelle les technologies évoluent, nous pouvons faire progresser les sciences sociales et l’éthique dès maintenant. »
Leave a Reply