Les taux de FT3 peuvent-ils faciliter la détection de l’inflammation ou du catabolisme et de la malnutrition chez les patients dialysés ? | Nefrología
INTRODUCTION
L’altération de la fonction thyroïdienne affectant les patients euthyroïdiens avec des conditions sévères a été associée à une diminution de la survie. Nous parlons de syndrome de la T3 basse pour décrire les altérations de la fonction thyroïdienne qui affectent un pourcentage élevé de la population (jusqu’à 75% des patients hospitalisés)1 et impliquent une diminution de la FT3, une T4 libre (FT4) normale ou légèrement basse et une thyrotropine (TSH) normale. Ces changements sont interprétés comme un mécanisme d’adaptation de l’organisme face à la maladie et se produisent lorsqu’il y a une diminution de la conversion périphérique de la T4 et de la FT3, sans qu’il y ait de maladie spécifique de la thyroïde. Une prévalence élevée de faibles taux de FT3 a également été décrite chez les patients atteints de maladie rénale chronique (MRC) sans antécédents de maladie thyroïdienne,2 et les taux de FT3 ont été identifiés comme des prédicteurs indépendants de la mortalité à la fois chez les patients sous hémodialyse (HD)3 et sous dialyse péritonéale (DP)4. On ne sait pas si la cause de cette réduction de la FT3 est simplement le mécanisme d’adaptation physiologique qui réduit le métabolisme de base en présence d’une maladie, ou s’il s’agit d’une altération associée à l’IRC ou à la dialyse et dont la correction pourrait contribuer à améliorer la survie de ces patients. Les niveaux de FT3 peuvent être bas chez les patients atteints d’IRC en raison de divers mécanismes, tels que : 1) la malnutrition : Une diminution de l’apport alimentaire pourrait entraîner une réduction de la conversion de la T4 en FT3 et finalement diminuer la production d’énergie et arrêter le catabolisme des protéines ; 2) l’inflammation : Dans l’IRC, il se produit une inflammation chronique qui peut également être associée à la diminution de la FT3 pendant la dialyse;4,5 3) l’insuffisance rénale proprement dite : Elle est causée par l’accumulation de toxines urémiques qui altèrent la fonction thyroïdienne, comme une acidose métabolique ou une diminution de l’excrétion d’iode ; ou des altérations associées aux techniques de dialyse comme l’utilisation d’héparine pendant l’HD ou de petites pertes de T4 ou de T3 dans l’effluent péritonéal2. Par conséquent, la réduction de la fonction thyroïdienne chez les patients dialysés pourrait être un marqueur de malnutrition-inflammation, ou être secondaire à l’insuffisance rénale chronique ou à la technique de dialyse particulière utilisée.
Le but principal de cette étude était d’évaluer l’incidence du syndrome de basse T3 affectant les patients stables sous dialyse (HD et PD) et son association avec les différents marqueurs de malnutrition et d’inflammation.
MATERIEL ET METHODE
Il s’agit d’une étude descriptive, transversale, impliquant des patients en dialyse chronique (32 en HD et 11 en PD) à l’hôpital général de Ségovie durant le mois d’avril 2008. Tous les patients étaient en dialyse chronique depuis au moins 3 mois et étaient stables d’un point de vue clinique. « Stable » était défini comme l’absence d’admission à l’hôpital, d’infections intercurrentes ou de maladies enregistrées au cours du mois précédant l’étude. Onze patients ont ensuite été exclus de l’étude : Quatre en raison d’une maladie thyroïdienne précédemment identifiée et sept qui prenaient des médicaments susceptibles d’affecter la fonction thyroïdienne.
La TSH, la FT4 et la FT3 de la section transversale ont été mesurées par immunoanalyse basée sur l’électrochimioluminescence (ECLIA), à l’aide d’un analyseur E170 (Roche Diagnostics, Mannheim, Allemagne). La sensibilité des tests TSH, FT4 et FT3 était de 0,005mcU/l, 0,3pmol/l et 0,4pmol/l, respectivement. Les valeurs de référence étaient : TSH 0,4-5mcU/l, FT4 11-23pmol/l et FT3 3,9-6,8pmol/l. Nous avons mesuré les anticorps antithyroïdiens (anti-TPO et anti-TG) à l’aide d’un test d’immunoabsorption (Aeskulisa Aesku Diagnostics, Allemagne) afin d’exclure les maladies auto-immunes (les valeurs supérieures à 150U/ml pour les anti-TPO ou 50U/ml pour les TG étaient considérées comme positives). En même temps, les paramètres biochimiques et hématologiques associés à la nutrition et à l’inflammation ont été testés : albumine, préalbumine, transferrine, cholestérol, hématocrite, créatinine, pH, bicarbonate et protéine C-réactive (CRP), en utilisant les méthodes de laboratoire de routine de notre hôpital. Les taux de l’hormone de croissance (GH) et du facteur de croissance analogue à l’insuline (IGF-1) ont également été établis par dosage radio-immunologique dans un laboratoire de référence. Les valeurs sont exprimées en ng/ml. Les tests ont été effectués avant la première séance de dialyse de la semaine ; les patients devant subir une dialyse l’après-midi avaient pour consigne de rester à jeun au moins quatre heures avant.
L’apport calorique et protéique quotidien moyen a été établi à l’aide de l’enquête alimentaire sur trois jours (logiciel Dietsource 3.0 NovartisÆ) et a été corrigé en fonction du poids idéal du patient. Le pourcentage de lipides et de glucides a été enregistré, ainsi que les apports en sodium, potassium et phosphore.
L’état nutritionnel du patient a été évalué à l’aide de mesures anthropométriques réalisées en milieu de semaine après la dialyse selon des techniques standard6 et comprenant : la taille, le poids, l’indice de masse corporelle (IMC), le pli cutané du triceps (TSF), la circonférence du bras (AC) et la circonférence musculaire du bras (AMC). Les résultats ont été standardisés en calculant le pourcentage pour chaque cas par rapport au 50e percentile des données obtenues à partir d’une population d’adultes espagnols normaux du même âge et du même sexe,7,8 en considérant comme déficits modérés-sévères les cas qui étaient supérieurs à 80% de la population normale.
Afin d’obtenir une évaluation plus précise de l’état nutritionnel et de la composition corporelle, une analyse vectorielle de bioimpédance (BIVA) a été réalisée en milieu de semaine après la dialyse (Vectorial BIA 101 ; Akern, Florencia, Italie), qui a mesuré la résistance (R), la réactance (Xc), l’angle de phase (PA), l’échange sodium-potassium (I Na/K), l’eau corporelle totale (TBW), l’eau extracellulaire (ECW), l’eau intracellulaire (ICW), la masse cellulaire, l’indice de masse cellulaire (masse cellulaire/taille2) (BCMI), la masse grasse (FM), la masse sans graisse (FFM) et la masse musculaire. Ces données ont été comparées aux valeurs de sujets normaux de même âge et de même poids.9
La comorbidité a été estimée à l’aide de l’indice de Charlson, modifié par Beddhu.10 La dose de dialyse a été mesurée en calculant le KT/V, et l’apport protéique a été estimé sur la base du taux catabolique protéique normalisé pour le poids actuel (nPCR).
Analyse statistique
L’analyse statistique a été réalisée à l’aide du progiciel SPSS, version 11.0 pour Windows. Les valeurs ont été exprimées en pourcentages ou en moyennes ± SD ; une valeur de p
RESULTATS
Les caractéristiques cliniques des 32 patients figurent dans le tableau 1. Le KT/V moyen dans l’HD était de1,6 ± 0,27, et dans le PD, le KT/V hebdomadaire moyen était de 2,07 ± 0,27.
Les valeurs moyennes des hormones thyroïdiennes étaient les suivantes : TSH 2,2 ± 1,5mcU/ml, FT4 14,7 ± 2,3pmol/l et FT3 4,0 ± 0,71pmol/l. Seuls deux patients (6,3 %) présentaient de faibles valeurs de FT4 et deux autres patients présentaient une augmentation de la TSH, tandis que 17 patients (53,1 %) présentaient de faibles niveaux de FT3. Nous n’avons trouvé aucune corrélation entre les niveaux de FT3, FT4 et TSH. Aucun patient ne présentait d’anticorps antithyroïdiens. Il n’y avait pas de différences significatives entre les niveaux de FT3 selon le sexe (4,2 ± 0,7 pour les hommes vs. 3,8 ± 0,6 pour les femmes ; ns) ; les niveaux de FT3 étaient significativement plus élevés en DP qu’en HD (4,5 ± 0,4 vs. 3,8 ± 0,7 ; p = 0,016). Il n’y avait pas de différences dans les niveaux de FT3 en fonction du type de dialyse. Cependant, les patients PD présentaient des concentrations plus élevées de TSH (3,5 ± 1,3 vs 1,7 ± 1,3mcU/ml ; p = 0,002), et l’IMC était également plus élevé chez les patients PD (30,6 ± 3,3 vs 24,8 ± 4,4 ; p = 0,002) par rapport aux patients HD.
Afin de déterminer à quoi était associée la diminution de la FT3 en dialyse, nous avons comparé les données cliniques, sociodémographiques, analytiques, anthropométriques et BIVA des patients ayant une faible FT3 avec les valeurs normales obtenues dans notre laboratoire (
DISCUSSION
Récemment, de faibles niveaux de FT32-4 qui ne sont pas causés par une maladie thyroïdienne mais sont le résultat d’une détérioration de la conversion périphérique de la FT4 en FT3 ont été décrits chez un pourcentage élevé de patients dialysés. Ce phénomène peut être comparable à d’autres incidences décrites dans des cas de diverses maladies chroniques ou aiguës,1 et est connu sous le nom de syndrome de maladie euthyroïdienne ou de syndrome de T3 basse. Cependant, l’IRC se distingue du reste des cas de syndrome euthyroïdien car il ne s’accompagne pas d’une augmentation de la T3 inverse (rT3).11 En effet, bien que la clairance de la rT3 soit plus faible chez les patients rénaux, il semble y avoir une redistribution de la rT3 de l’espace vasculaire à l’espace extravasculaire et une augmentation de la captation cellulaire de la rT3.
Nos données confirment l’incidence élevée de patients ayant un faible taux de FT3 (53%) sous dialyse et sans aucune maladie thyroïdienne connue, ce qui est probablement dû à une conversion périphérique déficiente de la T4 et de la FT3, étant donné que les taux de FT3 n’étaient pas corrélés aux taux de FT4 ou de TSH. Il a été suggéré que l’accumulation de toxines urémiques ou l’acidose métabolique peuvent contribuer à une diminution de la FT3.12 Nous n’avons trouvé aucun lien entre les niveaux de pH et de bicarbonate et les niveaux de FT3. Nous n’avons pas non plus trouvé de corrélation avec la dose de dialyse mesurée par KT/V ou avec le temps que les patients avaient passé en dialyse. Il convient de considérer qu’en général, les doses de dialyse de nos patients étaient élevées (le KT/V moyen des patients en HD était de 1,6 ± 0,27 et le KT/V hebdomadaire moyen en DP était de 2,07 ± 0,27) et que l’acidose était relativement bien corrigée (pH 7,34 ± 0,6 et bicarbonate 22,7 ± 2,8). En ce qui concerne le type de dialyse, nous avons constaté que les patients dialysés PD présentaient des niveaux plus élevés de FT3, ce qui contredit légèrement les résultats escomptés étant donné qu’en PD, on peut s’attendre à des pertes plus importantes de T4 et de T3 dans l’effluent.13 Cependant, il a également été démontré que ces pertes sont minimes : Moins de 10μg de T4 et moins de 0,1μg de T3 par jour, soit moins de 10 % et 1 % respectivement concernant le taux de production de T4 et T3. Par conséquent, nos résultats confirment que le manque de conversion périphérique en réponse à la malnutrition est beaucoup plus important que la perte péritonéale, et dans le cas de cette étude, les patients PD ont enregistré de meilleurs résultats nutritionnels, y compris un IMC plus élevé. Nous coïncidons avec les conclusions d’autres auteurs et pensons que la diminution de la FT3 chez les patients dialysés est principalement la réponse adaptative de l’organisme à la maladie dans le but de réduire le métabolisme de base et d’éviter les catabolismes.2 Dans le cas des maladies chroniques, il est parfois difficile de déterminer si la diminution de la FT3 est due à l’activité de la maladie ou à la malnutrition associée à l’activité de la maladie. La fonction thyroïdienne n’est pas seulement altérée par le jeûne, mais aussi par la composition du régime alimentaire ; ainsi, une diminution de l’apport en glucides entraîne une réduction plus importante de la FT3 qu’une diminution de l’apport en protéines. Un apport calorique insuffisant, même avec un apport protéique adéquat, peut provoquer un « syndrome de maladie euthyroïdienne ».14 Nous n’avons trouvé aucune corrélation entre les niveaux de FT3 et l’apport calorique total (kcal/jour) ou l’apport calorique corrigé selon le poids idéal ou réel. Nous n’avons pas non plus trouvé de différences dans la composition du régime alimentaire entre les patients dont le taux de FT3 est normal et ceux dont le taux de FT3 est réduit, et pour cette raison, nous hésitons à soutenir l’hypothèse selon laquelle une diminution du taux de FT3 chez les patients dialysés est due à un apport insuffisant. Cependant, nous avons trouvé une association entre les niveaux de FT3 et certains paramètres biochimiques et anthropométriques de la malnutrition, tels que la préalbumine, la transferrine, l’IMC, l’AC, l’AMC ou la masse musculaire mesurée par bioimpédance. Il semble donc que les niveaux de FT3 soient associés à la malnutrition mais pas à un manque d’apport calorique. De plus, nous avons trouvé une corrélation inverse avec les niveaux de CRP. Au cours d’une infection ou d’une septicémie, il y a une réduction des hormones thyroïdiennes par différents mécanismes, cependant, elle se produit fondamentalement à cause d’une diminution de la conversion périphérique de la FT4 en T3. La réduction des hormones thyroïdiennes est associée à la gravité du processus15 et semble, au moins en partie, être médiée par les cytokines.16,17 L’inflammation chronique qui se produit dans l’IRC semble également être associée à une diminution de la FT3 dans l’HD.4,5 Dans les études de Zocalli et al. une diminution des niveaux de FT3 a été trouvée dans les deux types de patients dialysés par rapport aux sujets sains ; ils indiquent également que les niveaux de FT3 sont inversement corrélés avec les niveaux d’interleukine 6 et de CRP. La possibilité que la diminution de la FT3 soit le résultat d’une maladie ou de l’âge qui est associé à une réduction du métabolisme énergétique de base doit également être considérée, cependant dans notre étude nous n’avons trouvé aucune corrélation entre la FT3 et l’âge ou la comorbidité en général, cependant, il y avait une corrélation avec les paramètres d’inflammation.
Récemment, l’International Society of Renal Nutrition and Metabolism (ISRNM)18 a suggéré de remplacer le terme « malnutrition » par « perte de protéines et d’énergie » (PEW) afin de définir cette situation affectant les patients dialysés, étant donné que la « malnutrition » au sens strict du terme signifie « apport insuffisant » et que la situation souvent observée chez ces patients est une altération du métabolisme (métabolisme excessif ou absence d’anabolisme), favorisée par les cytokines inflammatoires, qui conduit à la perte des réserves protéiques ou énergétiques. Nous pensons qu’une diminution de la FT3 est un mécanisme adaptatif de l’organisme pour se défendre contre la perte de protéines qui n’est pas causée par un manque d’apport mais plutôt par l’inflammation ou le manque de substances anabolisantes qui sont associées à l’IRC. En prenant cela en considération, les résultats d’une étude menée par Lim et al.2 sont intéressants car, bien que des doses de FT3 administrées à des sujets normaux n’aient pas modifié l’équilibre protéique, les patients HD ayant de faibles niveaux de FT3 ont connu un catabolisme accru. Ces données suggèrent que les patients qui connaissent une diminution de la conversion périphérique de T4 en FT3 se défendent contre une situation catabolique et que la T3 aggraverait la malnutrition protéique en augmentant le catabolisme.
À l’heure actuelle, il n’existe toujours pas de marqueur fiable de la masse musculaire et du catabolisme protéique chez les patients dialysés, étant donné que la production de créatinine ou d’urée sériques peut être affectée par la dose de dialyse. Selon les recommandations de l’ISRNM18, la perte de masse musculaire devrait être incluse dans les critères du PEW étant donné qu’elle peut être très importante tant sur le plan clinique que pronostique. Compte tenu de la bonne corrélation trouvée dans notre étude entre les niveaux de FT3 et la masse musculaire, et en prenant en considération le fait que la FT3 varie probablement rapidement dans les maladies cataboliques, nous suggérons que les niveaux de FT3 devraient être utilisés comme un indicateur précoce du catabolisme et comme un marqueur pour mesurer la réponse à certaines thérapies qui visent à traiter cela, par exemple, pour évaluer la réponse aux suppléments nutritionnels ou aux substances anabolisantes.
CONCLUSION
La moitié de nos patients dialysés présentaient une diminution du taux de FT3 dans le sérum sans altération de la TSH ou de la FT4 (syndrome de faible FT3). Cette réduction semble être causée par une altération de la conversion périphérique de la FT4 en FT3. Ces niveaux sont fondamentalement corrélés avec les paramètres de malnutrition et d’inflammation et pourraient être considérés comme un marqueur précoce de catabolisme ou de PEW.
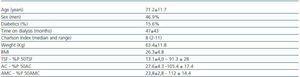
Tableau 1. Caractéristiques sociodémographiques et anthropométriques
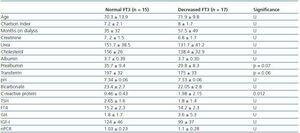
Tableau 2. Différences sociodémographiques et analytiques entre les patients ayant une FT3 normale (>3,95) et les patients ayant une FT3 diminuée
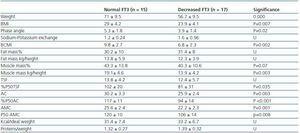
Tableau 3. Différences anthropométriques et BIVA entre les patients ayant une FT3 normale (> 3,95) et les patients ayant une FT3 diminuée
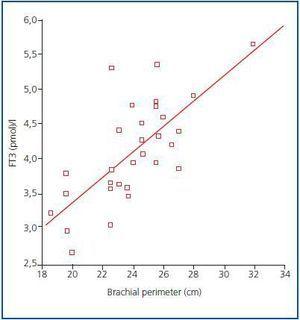
Figure 1.
Leave a Reply