Frontières en oncologie
Contexte
L’ostéoporose induite par l’irradiation et les fractures d’insuffisance (FI) qui en résultent sont très fréquentes. L’incidence des FI rapportée dans la littérature après des irradiations abdominales ou pelviennes varie entre 7 et 45% (1-8). Dans certaines situations oncologiques telles que le traitement hormonal du cancer du sein et de la prostate, les cliniciens connaissent bien l’ostéoporose liée au traitement et le risque de fracture (9-13). L’absorptiométrie à rayons X à double énergie (DEXA) est demandée systématiquement et des mesures préventives contre l’ostéoporose telles que le calcium, la vitamine D ou les biphosphonates sont prises à titre prophylactique pendant le suivi des patients. Cependant, il n’y a pas d’évaluation de routine de la santé osseuse, et les radio-oncologues ne sont pas sensibilisés à la toxicité osseuse liée aux rayonnements et aux IF. Bien que les IF soient souvent rencontrés dans le suivi des patients après des irradiations abdominales ou pelviennes et observés de nos jours avec une fréquence très élevée après des irradiations stéréotaxiques, la DEXA ou d’autres mesures alternatives de la densité minérale osseuse (DMO) ne sont pas prises en compte dans la pratique de la radio-oncologie (1-8, 14-16). En raison de la méconnaissance des IF par les radio-oncologues, ces IF sont souvent non reconnues ou parfois peuvent être considérées comme les métastases osseuses du cancer primaire, ce qui entraîne des fautes professionnelles et des examens inutiles et un stress psychologique pour les patients.
Nous avons récemment démontré un risque de fracture vertébrale de 9,6% chez les patients qui ont été traités par irradiation abdominale (8). Nous pensons que l’os devrait être considéré comme un organe à risque pour la planification de la radiothérapie et la DMO devrait être mesurée et suivie régulièrement chez ces patients avant et après l’irradiation. Les radio-oncologues peuvent déterminer la santé osseuse de leurs patients et les IF non reconnus en utilisant leur outil le plus important : le système de planification de la radiothérapie.
La DMO est la mesure de la densité minérale osseuse et calcique et elle est déterminée par DEXA (17, 18). La DEXA est actuellement considérée comme la méthode de référence pour la quantification de la DMO et il a été démontré qu’elle est en corrélation avec le risque de fracture et l’efficacité du traitement (17, 18). Plusieurs études ont démontré que les unités Hounsfield (HU) dérivées de la tomographie informatisée (CT) présentent une forte corrélation avec la DMO fournie par la DEXA (19-22). Les valeurs HU peuvent fournir une estimation fiable de la force osseuse régionale et de la DMO, et peuvent être utilisées pour exclure l’ostéoporose avec une grande précision (19-22). De plus, le scanner, comparé à la DEXA, permet une identification plus précise des fractures vertébrales (23). Les tomodensitométries de diagnostic et de planification de la radiothérapie sont demandées soit pour mettre en place le stade de la maladie, soit pour planifier la radiothérapie, soit pour suivre les patients de façon routinière. Nous pouvons utiliser les UH dérivées de la tomodensitométrie chez ces patients pour déterminer et surveiller la DMO, et ainsi éviter les coûts supplémentaires et l’exposition supplémentaire aux radiations de la mesure DEXA. Outre ces avantages, les vues sagittales des vertèbres reconstruites facilement à partir des tomodensitogrammes peuvent être utilisées pour évaluer les fractures osseuses non reconnues et non symptomatiques.
Le but de la présente étude est de mettre en évidence la perte de densité minérale osseuse et les fractures vertébrales non diagnostiquées en mesurant les UH et la reconstruction sagittale des vertèbres à partir des tomodensitogrammes importés dans le système de planification du traitement pour les patients qui sont traités par radiothérapie abdominale.
Méthodes
Fifty-sept patients consécutifs opérés pour un adénocarcinome gastrique et ayant reçu une radiothérapie abdominale adjuvante ont été inclus dans le groupe d’étude. Trente-quatre patients consécutifs présentant une maladie à un stade précoce et n’ayant pas besoin d’un traitement adjuvant après la chirurgie constituaient le groupe témoin.
Chez les patients irradiés, le rayonnement a été délivré avec des photons de 6 ou 15 MV par une planification de traitement conforme, à modulation d’intensité ou à arc modulé volumétrique. La dose de rayonnement prescrite était de 46 Gy en 23 fractions à raison de 2 Gy par jour, ou de 45 Gy en 25 fractions à raison de 1, 8 Gy par jour, 5 jours par semaine, pendant 5 semaines. Tous les patients ont reçu du 5-fluorouracile en bolus ou en perfusion, un cycle avant, deux cycles en même temps et un cycle après la radiothérapie. Le consentement éclairé a été obtenu de tous les patients et l’étude a été approuvée par le comité d’éthique local de l’hôpital.
Les tomographies de planification et de diagnostic ont été obtenues à l’aide de scanners CT multidétecteurs (LightSpeed 16 tranches ou VCT 64 tranches ; GE Healthcare, Waukesha, WI) par des épaisseurs de tranches de 3 ou 5 mm. Les tomographies abdominales ont été importées du système d’archivage et de communication des images radiologiques vers le système de planification des traitements Eclipse (TPS) (Varian Medical Systems, Palo Alto, CA). Dans le groupe d’étude, la première tomographie était déjà dans le système de planification du traitement pour la planification des radiations. La seconde a été obtenue 1 an après la radiothérapie et importée dans le système de planification du traitement. Dans le groupe témoin, les tomographies abdominales obtenues juste après la chirurgie et 1 an plus tard ont été importées dans le système de planification. Les corps vertébraux T12-L1-L2 ont été profilés par un radio-oncologue afin de déterminer la dose moyenne de rayonnement pour chaque corps vertébral chez les patients irradiés. Ensuite, un radiologue expérimenté utilisant le TPS a déterminé les valeurs HU moyennes des mêmes vertèbres pour tous les patients. Les valeurs HU moyennes des deux groupes de patients ont été remesurées 1 an plus tard.
Les valeurs HU au début de l’étude et celles obtenues 1 an plus tard ont été calculées pour chaque corps vertébral de chaque groupe et le pourcentage de changement des HU (Δ%HU) a été déterminé. Bien que la durée des mesures d’UH ait été prévue au début et 1 an plus tard, nous avons continué à suivre régulièrement les patients pendant au moins 5 ans après le traitement pour connaître les résultats oncologiques. Les fractures de compression vertébrale, si elles se sont développées, ont été déterminées à partir de la reconstruction sagittale des vertèbres à partir des tomographies informatisées pendant les suivis.
Technique de mesure de l’UH
Les UH ont été mesurées au niveau des sections transversales axiales des régions trabéculaires des corps vertébraux T12, L1, L2. Chaque corps vertébral a été divisé en trois segments axiaux et les UH ont été calculées en plaçant une région d’intérêt (ROI) rectangulaire sur une zone d’os trabéculaire sur le corps vertébral. Nous avons essayé d’éviter le plexus veineux basivertébral en arrière et l’os scléreux sous-chondral. Les mesures ont été détaillées dans la figure supplémentaire 1. Les valeurs HU moyennes de trois segments axiaux dans chaque vertèbre ont été moyennées pour déterminer la valeur HU finale pour chaque corps vertébral. HUpre représente la valeur HU mesurée lors du CT initial pour les groupes d’étude et de contrôle tandis que, HUpost définit la valeur HU mesurée après 1 an.
Analyses statistiques
Le pourcentage de diminution de l’atténuation osseuse (Δ%HU) pour chaque vertèbre a été calculé avec l’équation suivante :
Des analyses chi-carré ont été effectuées pour démontrer les différences entre l’âge, le sexe et les caractéristiques tumorales des groupes. Le test t de Students a été utilisé pour déterminer les différences entre les valeurs HU pré et post dans chaque groupe et entre deux groupes, et pour trois niveaux de dose de rayonnement (<20 Gy, 20-40 Gy, et >40 Gy) dans le groupe d’étude. Pour évaluer directement l’effet de la dose de rayonnement sur la variation de Δ%HU, une analyse de corrélation de Pearson a été réalisée sur Δ%HU et la dose de rayonnement. Nous avons considéré qu’une valeur p de < 0,05 était significative. L’analyse statistique a été réalisée à l’aide du logiciel SPSS (Statistical Package for Social Sciences) 17,0.
Résultats
Les détails sur les patients et les traitements sont présentés dans le tableau 1. Il n’y avait pas de différence statistiquement significative entre les groupes en ce qui concerne l’âge, le sexe, le type de résection chirurgicale et la localisation de la tumeur. Les valeurs HU moyennes des vertèbres T12, L1 et L2 ont été mesurées dans les deux groupes. Au début de l’étude, il n’y avait pas de différence statistiquement significative dans les valeurs HU mesurées pour toutes les vertèbres entre le groupe étudié et le groupe témoin. Alors que les valeurs HU moyennes des vertèbres T12, L1, L2 ont diminué de manière significative dans le groupe d’étude (p < 0,001 pour chaque vertèbre) après 1 an, aucun changement significatif des valeurs HU n’a été trouvé dans le groupe de contrôle (p : 0,09-0,08-0,24, respectivement) pendant la même période. Le tableau 2 résume les changements d’UH pour le groupe d’étude et le groupe témoin.
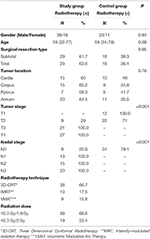
Tableau 1. Caractéristiques des patients et des traitements.

Tableau 2. Comparaison des HU dans les deux groupes eux-mêmes et entre les deux groupes pour chaque vertèbre.
Les doses moyennes de rayonnement pour les vertèbres T12, L1 et L2 dans le groupe d’étude étaient de 34,55 ± 11,1 ; 31,82 ± 12,4 ; 30,37 ± 13,6 Gy, respectivement. Une corrélation négative et significative a été trouvée entre Δ%HU et la dose de rayonnement reçue par chaque vertèbre. Au fur et à mesure que la dose de rayonnement augmentait, les UH diminuaient dans chaque vertèbre. Ceci est résumé dans les figures 1-3.
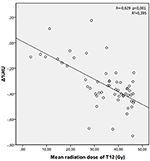
Figure 1. Corrélation entre Δ%HU et la dose de rayonnement reçue par la vertèbre T12.
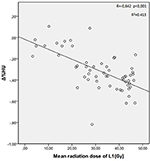
Figure 2. Corrélation entre Δ%HU et la dose de rayonnement reçue par la vertèbre L1.
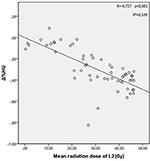
Figure 3. Corrélation entre Δ%HU et la dose de rayonnement reçue par la vertèbre L2.
La relation entre la dose de rayonnement reçue par la vertèbre et le changement d’HU a été résumée dans le tableau 3. Bien que la diminution des valeurs HU ait été statistiquement significative aux niveaux de dose de rayonnement supérieurs à 20 Gy, les valeurs HU n’ont pas été modifiées de manière significative dans les doses de rayonnement inférieures à 20 Gy, sauf pour les vertèbres L2.

Tableau 3. Changement des UH par rapport aux groupes de dose de rayonnement.
Fractures
Alors qu’aucun patient du groupe témoin n’a eu de fractures, 4 des 57 patients (%7) du groupe irradié ont développé des fractures vertébrales tout au long de l’étude. Alors que deux des fractures vertébrales ont été observées chez les femmes, deux d’entre elles ont été observées chez les hommes. Les fractures ont été identifiées aux 16e, 18e, 20e et 26e mois après l’irradiation, avec une durée médiane de suivi de 24 mois (fourchette : 12-36 mois). Des fractures ont été observées dans la vertèbre L1 chez trois patients, et dans la vertèbre L2 chez un patient. Les doses moyennes de rayonnement reçues par chaque vertèbre fracturée étaient les suivantes : 39, 28,5, 22,3, 31 Gy. Les caractéristiques des patients présentant des fractures vertébrales sont résumées dans le tableau supplémentaire 1 et la figure supplémentaire 2.
Discussion
La radiothérapie entraîne une ostéoporose par des mécanismes directs et indirects et des IF se développent fréquemment après des irradiations pelviennes ou abdominales dans la pratique clinique (1-8). Les IF dans la colonne vertébrale et la région pelvienne sont fréquentes et représentent un important effet secondaire tardif de la radiothérapie. Cependant, les radio-oncologues ne sont pas conscients de l’ostéoporose et de la toxicité osseuse induites par les radiations. En raison de cette méconnaissance de la toxicité osseuse radio-induite, aucune attention particulière n’est accordée à la prévention de cette importante complication tardive. Nous, dans notre étude précédente (8), avons essayé de souligner l’importance de ce problème et avons rapporté une incidence très élevée de fractures vertébrales après des irradiations abdominales comme chez les patients irradiés pour des tumeurs pelviennes (1-7).
Les radio-oncologues pendant la planification de la radiothérapie accordent beaucoup d’attention à la dose de rayonnement reçue par chaque organe à risque. Bien que les taux de toxicité tardive de grade III/IV pour ces complications très étroitement suivies ne dépassent pas certains pourcentages, la toxicité osseuse liée à la radiothérapie abdominale ou pelvienne et les fractures qui en résultent sont effectivement plus élevées que les toxicités tardives de grade III/IV bien connues. Alors que les contraintes de dose sont bien définies pour les organes connus pour être à risque et qu’elles sont déterminantes pour l’approbation du plan final, ce n’est pas le cas pour le tissu osseux.
Même dans la dernière version des critères de terminologie commune pour les événements indésirables (CTCAE) version 5.0, il n’y a pas de définition spécifique de la toxicité osseuse résultant de l’irradiation (24). Il n’existe aucun critère d’évaluation de la toxicité osseuse dans la pratique de la radio-oncologie. Ni dans les tableaux d’évaluation de la toxicité tardive LENT-SOMA, ni dans le rapport Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC), l’os n’a été défini comme un organe à risque, et aucune contrainte de dose et de volume n’a été définie pour ce tissu (25, 26). Cependant, les études précédentes et notre étude récemment publiée ont démontré que l’ostéoporose et le risque de fracture doivent être pris en considération sérieusement, et que les précautions nécessaires doivent être prises pendant le suivi des patients irradiés pour prévenir les fractures liées aux rayonnements (1-8).
La méthodeDEXA est la méthode de référence pour la quantification de la DMO et le dépistage systématique de l’ostéoporose. Les radio-oncologues ne demandent pas de DEXA pour leurs patients qui reçoivent une irradiation pelvienne ou abdominale. Ils ne consultent pas ces patients avec l’endocrinologue pour évaluer le risque de fracture et la présence d’ostéoporose avant toute radiothérapie. Cependant, en tant que radio-oncologues, nous pouvons utiliser notre système de planification afin de déterminer la DMO et le risque d’ostéoporose. Ces évaluations peuvent être réalisées facilement par le biais de scanners commandés soit pour la stadification de la maladie, soit pour la planification de la radiothérapie et pour le suivi des patients. Nous pouvons déterminer la diminution de la DMO, l’ostéoporose et les fractures inaperçues en mesurant les valeurs HU de l’os à partir des tomodensitométries des patients importées dans le système de planification, et en construisant des images sagittales des zones osseuses irradiées.
Il a été récemment suggéré que les valeurs HU de l’os dérivées de la tomodensitométrie peuvent être utilisées pour identifier les patients présentant une diminution de la DMO et une ostéoporose (19-22, 27-30). Pickhardt et al. (22) ont clairement défini comment les valeurs HU osseuses peuvent être mesurées et utilisées comme alternative à la DEXA pour établir des diagnostics de DMO et d’ostéoporose. Dans ces études, alors que les valeurs HU osseuses inférieures à 100 sont considérées comme indicatives d’ostéoporose, les valeurs HU comprises entre 100 et 160 sont considérées comme indicatives d’ostéopénie, et les valeurs HU supérieures à 160 démontrent une densité minérale osseuse normale (19-22). Les patients dont les valeurs HU sont supérieures à 160 ont une densité osseuse normale et il n’est donc pas nécessaire de procéder à une mesure DEXA ni de se préoccuper de la santé osseuse. Les patients dont les valeurs HU sont comprises entre 100 et 160 peuvent être considérés comme ostéopéniques et nécessitent une intervention précoce pour prévenir l’ostéoporose et le risque de fracture à l’avenir. Les patients dont les valeurs HU sont inférieures à 100 doivent être considérés comme ostéoporotiques. Des valeurs HU basses doivent alerter le radio-oncologue sur un risque ultérieur de fracture dans les zones osseuses qui seront exposées aux rayonnements. Ces patients doivent être consultés avec l’endocrinologue avant d’administrer toute radiothérapie. Dans les études comparant les UH avec la DEXA pour la densité minérale osseuse et la détermination de l’ostéoporose, certains patients appartenant au groupe non ostéoporotique par la DEXA ont été détectés avec des fractures vertébrales pendant la détermination des UH à partir de la tomodensitométrie (22, 29-31).
Dans notre étude, nous avons essayé de trouver un moyen facile pour les radio-oncologues de diagnostiquer l’ostéoporose et de déterminer le risque de fracture. Si nous appliquons ces mesures dans la routine quotidienne pendant la planification de la radiothérapie, nous pouvons déterminer l’ostéopénie, l’ostéoporose et le risque de fracture chez les patients qui vont recevoir une radiothérapie abdominale ou pelvienne et intervenir tôt pour prévenir la toxicité osseuse tardive de la radiation.
Bien qu’il n’y ait pas de différence statistiquement significative dans les valeurs HU des vertèbres T12, L1, L2 obtenues au départ et 1 an plus tard dans le groupe de contrôle, les valeurs HU ont diminué de manière significative chez les patients irradiés. Nous avons trouvé des fractures vertébrales uniquement chez les patients irradiés. Quatre patients sur 57 ont eu des fractures vertébrales après un suivi médian de 24 mois, avec un taux d’incidence cumulée des fractures de 7 %. Bien que la durée du suivi ait été courte et que la plupart des fractures aient été asymptomatiques, nous avons signalé un taux de fractures de 9,6 % dans notre étude précédente, avec une durée de suivi plus longue, et la plupart de ces fractures étaient symptomatiques (8). Le risque élevé de fracture osseuse chez ces patients mérite l’attention et l’os doit être considéré comme un organe à risque. Le délai d’apparition des fractures après la radiothérapie varie entre 2 et 63 mois (2, 14). Il est intéressant de noter que les fractures, en tant que toxicité tardive de grade IV, sont observées à une incidence plus élevée que d’autres toxicités tardives bien connues telles que la fibrose radique, la cystite, la proctite, etc.
La diminution de l’UH dépendait de la dose. Il y avait un risque plus élevé de diminution des valeurs HU osseuses avec des doses de rayonnement plus élevées reçues par les vertèbres. Cependant, nous avons constaté que la diminution des valeurs HU n’était pas significative pour les corps vertébraux qui ont été exposés à des doses de rayonnement inférieures à 20 Gy.
Dans la littérature, il existe des résultats contradictoires en termes de dose de rayonnement où la perte de DMO est observée. Alors qu’une étude a démontré une perte de DMO chez les patients traités par irradiation pelvienne à 22,5 Gy, une autre étude n’a démontré aucune corrélation entre la dose de rayonnement et le risque de fracture d’insuffisance (32, 33). Wei et al. (33) ont signalé que même des doses d’irradiation vertébrale de 5 Gy entraînent une réduction significative de la DMO et des FI chez les patients traités par radiothérapie abdominale. Ils ont également recommandé de limiter les doses d’irradiation des corps vertébraux, en particulier chez les patients présentant des valeurs HU faibles détectées lors de la planification de la radiothérapie. Nous devons donc définir une contrainte de dose pour les vertèbres situées dans le champ de rayonnement. Les contraintes de dose peuvent varier en fonction des valeurs HU mesurées pendant la planification de la radiothérapie. Nous devrions essayer de diminuer les doses moyennes de rayonnement pour les os vertébraux dans le champ de rayonnement, en particulier chez les personnes âgées, et les patients déjà ostéoporotiques.
Conclusions
L’ostéoporose radio-induite et les fractures d’insuffisance (FI) qui en résultent sont très fréquentes. La diminution de la DMO, l’ostéoporose et les fractures passées inaperçues peuvent être détectées en mesurant les valeurs HU de l’os à partir des tomodensitométries des patients importées dans le système de planification, et en reconstruisant les images sagittales des zones osseuses irradiées. Chez les patients dont les valeurs HU de l’os sont déjà faibles et qui ont été détectées lors de la planification de l’irradiation, il est possible d’intervenir rapidement pour rétablir la santé de l’os et prévenir de futures fractures liées à l’irradiation. Afin de prévenir la toxicité osseuse liée à l’irradiation, la dose d’irradiation des os vertébraux présentant des valeurs HU déjà faibles au moment de la planification du traitement doit être limitée à moins de 20 Gy.
Data Availability Statement
Les matériaux décrits dans l’article, y compris toutes les données brutes pertinentes, peuvent être librement disponibles pour tout scientifique souhaitant les utiliser à des fins non commerciales, sans rompre la confidentialité des participants et peuvent être obtenus auprès de l’auteur correspondant.
Ethics Statement
Notre étude a été réalisée conformément à la Déclaration d’Helsinki. L’étude a été approuvée par le comité d’éthique de l’hôpital d’éducation et de recherche Dr Lutfi Kirdar Kartal (2017/514/109/2). Un consentement éclairé écrit a été obtenu de tous les participants à l’étude.
Contributions des auteurs
GY : garant de l’intégrité de l’ensemble de l’étude. GY et CG : concepts et conception de l’étude. NC : recherche documentaire. GY, CG, IK, OS, et NC : études cliniques. GY : analyse statistique. OS : préparation du manuscrit. CG : édition du manuscrit. Tous les auteurs ont lu et approuvé le manuscrit final.
Conflit d’intérêt
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêt potentiel.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fonc.2020.00742/full#supplementary-material
Abréviations
IFs, fractures d’insuffisance ; DEXA, absorptiométrie à rayons X à double énergie ; DMO, densité minérale osseuse ; CT, tomographie informatisée ; HU, unité Hounsfield ; Δ%HU, pourcentage de changement en HU ; ROI, région d’intérêt ; SPSS, progiciel statistique pour les sciences sociales ; CTCAE, Common terminology criteria for adverse event ; QUANTEC, Quantitative analyses of normal tissue effects in the clinic.
1. Oh D, Huh SJ. Fracture d’insuffisance après une radiothérapie. Radiat Oncol J. (2014) 32:213-20. doi : 10.3857/roj.2014.32.4.213
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Higham CE, Faithfull SJ. Santé osseuse et radiothérapie pelvienne. Clin Oncol. (2015) 11:668-78. doi : 10.1016/j.clon.2015.07.006
CrossRef Full Text | Google Scholar
3. Shih KK, Folkert MR, Kollmeier MA, Abu-Rustum NR, Sonoda Y, Leitao MM Jr, et al. Fractures d’insuffisance pelvienne chez les patients atteints de cancer du col de l’utérus et de l’endomètre traités par radiothérapie pelvienne postopératoire. Gynecol Oncol. (2013) 128:540-3. doi : 10.1016/j.ygyno.2012.12.021
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Uezono H, Tsujino K, Moriki K, Nagano F, Ota Y, Sasaki R, et al. Fracture d’insuffisance pelvienne après radiothérapie définitive pour cancer du col utérin : analyse rétrospective des facteurs de risque. J Radiat Res. (2013) 54:1102-9. doi : 10.1093/jrr/rrt055
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Igdem S, Alco G, Ercan T, Barlan M, Ganiyusufoglu K, Unalan B, et al. Insufficiency fractures after pelvic radiotherapy in patients with prostate cancer. Int J Radiat Oncol Biol Phys. (2010) 77:818-23. doi : 10.1016/j.ijrobp.2009.05.059
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Schmeler KM, Jhingram A, Iyer RB, Sun CC, Eifel PJ, Soliman PT, et al. Pelvic fractures after radiotherapy for cervical cancer : implications for survivors. Cancer. (2010) 116:625-30. doi : 10.1002/cncr.24811
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Kim HJ, Boland PJ, Meredith DS, Lis E, Zhang Z, Shi W, et al. Fractures du sacrum après chimioradiation pour un carcinome rectal : incidence, facteurs de risque et évaluation radiographique. Int J Radiat Oncol. (2012) 84:694-9. doi : 10.1016/j.ijrobp.2012.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Yaprak G, Gemici C, Temizkan S, Ozdemir S, Dogan BC, Seseogullari OO. Développement de l’ostéoporose et fractures vertébrales après irradiation abdominale chez les patients atteints de cancer gastrique. BMC Cancer. (2018) 18:972. doi : 10.1186/s12885-018-4899-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lustberg MB, Reinbolt RE, Shapiro CL. La santé osseuse chez les adultes survivants du cancer. J Clin Oncol. (2012) 30:3665-74. doi : 10.1200/JCO.2012.42.2097
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, ESMO Guidelines Working Group. La santé osseuse chez les patients atteints de cancer : Directives de pratique clinique de l’ESMO. Ann Oncol. (2014) 25:124-37. doi : 10.1093/annonc/mdu103
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Pfeilschifter J, Diel IJ. Ostéoporose due au traitement du cancer : pathogenèse et gestion. J Clin Oncol. (2000) 18:1570-93. doi : 10.1200/JCO.2000.18.7.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Hadji P, Gnant M, Body JJ, Bundred NJ, Brufsky A, Coleman RE, et al. Cancer treatment-induced bone loss in premenopausal women : a need for therapeutic intervention ? Cancer Treat Rev. (2012) 38:798-806. doi : 10.1016/j.ctrv.2012.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Skolarus TA, Caram MV, Shahinian VB. Maladie osseuse associée à la privation d’androgènes. Curr Opin Urol. (2014) 24:601-7. doi : 10.1097/MOU.0000000000000101
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Boehling NS, Grosshans DR, Allen PK, McAleer MF, Burton AW, Azeem S, et al. Risque de fracture par compression vertébrale après radiothérapie par corps stéréotaxique pour les métastases spinales. J Neurosurg Spine. (2012) 16:379-86. doi : 10.3171/2011.11.SPINE116
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cunha MV, Al-Omair A, Atenafu EG, Masucci GL, Letourneau D, Korol R, et al. Vertebral compression fracture (VCF) after spine stereotactic body radiation therapy (SBRT) : analysis of predictive factors. Int J Radiat Oncol Biol Phys. (2012) 84:343-9. doi : 10.1016/j.ijrobp.2012.04.034
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jawad MS, Fahim DK, Gerszten PC, Flickinger JC, Sahgal A, Grills IS, et al. Fractures de compression vertébrale après la radiothérapie corporelle stéréotaxique : une grande évaluation multinationale et multi-institutionnelle. J Neurosurg Spine. (2016) 24:928-36. doi : 10.3171/2015.10.SPINE141261
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ. (1996) 312:1254-9. doi : 10.1136/bmj.312.7041.1254
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. A reference standard for the description of osteoporosis. Bone. (2008) 42:467-75. doi : 10.1016/j.bone.2007.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schreiber JJ, Anderson PA, Rosas HG, Buchholz AL, Au AG. Unités Hounsfield pour l’évaluation de la densité minérale osseuse et de la force : un outil pour la gestion de l’ostéoporose. J Bone Joint Surg Am. (2011) 93:1057-63. doi : 10.2106/JBJS.J.00160
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Schreiber JJ, Anderson PA, Hsu WK. Utilisation de la tomographie assistée par ordinateur pour évaluer la densité minérale osseuse. Neurosurg Focus. (2014) 37:E4. doi : 10.3171/2014.5.FOCUS1483
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Batawil N, Sabiq S. Unité Hounsfield pour le diagnostic de la maladie de la densité minérale osseuse : une étude de preuve de concept. Radiographie. (2016) 22:93-8. doi : 10.1016/j.radi.2015.11.004
CrossRef Full Text | Google Scholar
22. Pickhardt PJ, Pooler BD, Lauder T, del Rio AM, Bruce RJ, Binkley N. Dépistage opportuniste de l’ostéoporose à l’aide de tomodensitométries abdominales obtenues pour d’autres indications. Ann Intern Med. (2013) 158:588-95. doi : 10.7326/0003-4819-158-8-201304160-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Lenchik L, Shi R, Register TC, Beck SR, Langefeld CD, et al. Measurement of trabecular bone mineral density in the thoracic spine using cardiac gated quantitative computed tomography. J Comput Assist Tomogr. (2004) 28:134-9. doi : 10.1097/00004728-200401000-00023
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Critères de terminologie commune pour les événements indésirables (CTCAE). Version 5.0. Département américain de la santé et des services sociaux, Institut national du cancer des instituts de la santé. Maryland (2017).
25. Overgaard J, Bartelink H. Conférence de consensus sur les effets tardifs : RTOG/EORTC. Radiother Oncol. (1995) 35:1-82. doi : 10.1016/0167-8140(95)01548-U
CrossRef Full Text | Google Scholar
26. Bentzen SM, Constine LS, Deasy JO, Eisbruch A, Jackson A, Marks LB. Quantitative analyses of normal tissue effect in the clinic (QUANTEC) : an introduction to the scientific issues. Int J Radiat Oncol Biol. Phys. (2010) 76(3 Suppl):S3-S9. doi : 10.1016/j.ijrobp.2009.09.040
CrossRef Full Text | Google Scholar
27. Buckens CF, Dijkhuis G, de Keizer B, Verhaar HJ, de Jong PA. Dépistage opportuniste de l’ostéoporose sur la tomodensitométrie de routine ? Une étude de validation externe. Eur Radiol. (2015) 25:2074-9. doi : 10.1007/s00330-014-3584-0
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Emohare O, Cagan A, Morgan R, Davis R, Asis M, Switzer J, et al. The use of computed tomography attenuation to evaluate osteoporosis following acute fractures of the thoracic and lumbar vertebra. Geriatr Orthop Surg Rehabil. (2014) 5:50-5. doi : 10.1177/2151458514525042
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Alacreu E, Moratal D, Arana E. Opportunistic screening for osteoporosis by routine CT in Southern Europe. Osteoporos Int. (2017) 28:983-90. doi : 10.1007/s00198-016-3804-3
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Lee S, Chung CK, Oh SH, Park SB. Corrélation entre la densité minérale osseuse mesurée par absorptiométrie à rayons X à double énergie et les unités hounsfield mesurées par tomographie diagnostique dans la colonne lombaire. Korean Neurosurg Soc. (2013) 54:384-9. doi : 10.3340/jkns.2013.54.5.384
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Miyabara Y, Holmes D, Camp J, Miller VM, Kearns AE. Comparaison de la densité minérale osseuse calibrée et non calibrée par CT à DEXA chez les femmes ménopausées. Climactérique. (2012) 15:374-81. doi : 10.3109/13697137.2011.618566
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Park SH, Kim JC, Lee JE, Park IK. Fracture d’insuffisance pelvienne après radiothérapie chez les patients atteints de cancer du col de l’utérus à l’ère de la TEP/CT. Radiat Oncol J. (2011) 29:269-76. doi : 10.3857/roj.2011.29.4.269
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Wei RL, Jung BC, Manzano W, Sehgal V, Klempner SJ, Lee SP, et al. Perte de densité minérale osseuse dans les vertèbres thoraciques et lombaires après une irradiation pour des cancers abdominaux. Radiother Oncol. (2016) 118:430-6. doi : 10.1016/j.radonc.2016.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Leave a Reply