Chaleur
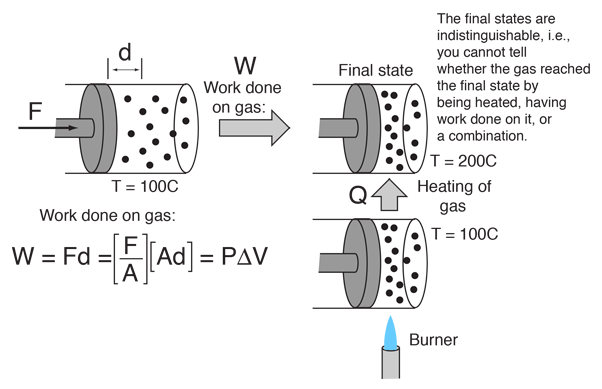
Cet exemple d’interchangeabilité de la chaleur et du travail comme agents d’ajout d’énergie à un système peut aider à dissiper certaines idées fausses sur la chaleur. J’ai trouvé cette idée dans un petit article de Mark Zemansky intitulé « L’utilisation et l’abus du mot « chaleur » dans l’enseignement de la physique ». Une idée clé de cet exemple est que si l’on vous présente un gaz à haute température, vous ne pouvez pas dire s’il a atteint cette haute température en étant chauffé, ou en subissant un travail sur lui, ou une combinaison des deux.
Pour décrire l’énergie que possède un objet à haute température, ce n’est pas une utilisation correcte du mot chaleur que de dire que l’objet « possède de la chaleur » – il est préférable de dire qu’il possède une énergie interne résultant de son mouvement moléculaire. Le mot chaleur est mieux réservé à la description du processus de transfert d’énergie d’un objet à haute température à un objet à plus basse température. Vous pouvez certainement prendre un objet à faible énergie interne et le faire passer à une énergie interne plus élevée en le chauffant. Mais vous pouvez aussi augmenter son énergie interne en lui faisant un travail, et comme l’énergie interne d’un objet à haute température réside dans le mouvement aléatoire des molécules, vous ne pouvez pas dire quel mécanisme a été utilisé pour lui donner cette énergie.
Pour mettre en garde les enseignants et les étudiants contre les pièges d’une mauvaise utilisation du mot « chaleur », Mark Zemansky conseille de réfléchir sur le jingle :
« Enseigner la physique thermique |
Ne faites pas référence à la « chaleur dans un corps », ou dites « cet objet a deux fois plus de chaleur que ce corps ». Il s’oppose également à l’utilisation du terme vague « énergie thermique » et à l’utilisation du mot « chaleur » comme verbe, car ils alimentent les idées fausses, mais il est difficile d’éviter ces termes. Il conseillerait l’introduction et l’utilisation du concept d’énergie interne le plus rapidement possible. |
Zemansky pointe du doigt la première loi de la thermodynamique comme relation clarifiante. La première loi identifie à la fois la chaleur et le travail comme des méthodes de transfert d’énergie qui peuvent entraîner un changement dans l’énergie interne d’un système. Après cela, ni les mots travail ou chaleur n’ont d’utilité pour décrire l’état final du système – on ne peut parler que de l’énergie interne du système.
| Equivalent mécanique de la chaleur | Première loi de la thermodynamique | Calcul |
Leave a Reply