Anatomie des ganglions cardiaques et du système de conduction spécialisé auriculo-ventriculaire | Revista Española de Cardiología
INTRODUCTION
Les études classiques de Stannius1 en 1852 ont été les premières à proposer que la conduction cardiaque était myogénique. Il y a environ un siècle, il a été démontré que le tissu musculaire spécialisé était responsable de l’initiation et de la propagation du battement cardiaque. En 1906, Sunao Tawara2 a confirmé l’existence d’un faisceau musculaire décrit par His3 en 1893. Toujours en 1906, Keith et Flack4 ont confirmé l’existence du système His-Tawara. Un an plus tard, ils décrivaient la structure du nœud sinusal (SA).5
Bien que Purkinje6 ait été le premier à décrire des fibres ventriculaires spécialisées, il ignorait leur importance dans la structure du cœur, et c’est Tawara2 qui a montré que le faisceau musculaire décrit par His était continu avec les fibres ventriculaires de Purkinje6. Les études de Tawara ont récemment été traduites en anglais7, bien que la première traduction d’une partie de ses travaux dans cette langue ait été réalisée par Robb8 dans son manuel de 1965. Ces travaux constituent une lecture de base pour tous les chercheurs qui voudraient étudier le système de conduction cardiaque (SC).
COMPONENTS DU SYSTÈME DE CONDUCTION ATRIOVENTRICULAIRE SPÉCIFIQUE
Le faisceau musculaire reliant les oreillettes aux ventricules a été décrit par His3 comme un « faisceau pénétrant ». Cependant, His n’a pas observé la continuation histologique de ce faisceau dans l’oreillette droite avec le nœud auriculo-ventriculaire (AV), les ventricules ou les cellules de Purkinje ventriculaires. C’est Tawara2 qui a reconnu cette connexion alors qu’il travaillait pour son doctorat sous la direction d’Aschoff. Auparavant, en 1893, Kent9 et His3 avaient tous deux décrit des connexions AV musculaires qui ont été la cause d’une grande confusion pendant de nombreuses années.10 Plus tard, on a observé que ces connexions ne se trouvaient pas dans les cœurs sains, mais dans ceux qui étaient malades.
Suite aux découvertes de Kent et His, les cardiologues cliniciens et les physiologistes ont cherché la structure responsable de la génération de l’impulsion cardiaque. On soupçonnait qu’elle était située dans la zone où la veine cave supérieure et l’oreillette droite se rejoignent ; dans des conditions expérimentales, c’est la dernière partie du cœur à s’arrêter de battre (ce qu’on appelle l’ultimum moriens). En 1907, Keith et Flack5 ont distingué le SA ou nœud sinusal chez tous les mammifères qu’ils ont étudiés, y compris l’homme. Les cellules qui le composent étaient considérées comme le site d’origine de l’impulsion cardiaque.
La CS naît dans le nœud SA, qui se trouve dans l’oreillette droite antérieure supérieure (figure 1). Le nœud AV se trouve dans une position inférieure et postérieure de l’oreillette. Le CS s’étend du nœud AV jusqu’au faisceau pénétrant de His, puis se divise en deux branches, la gauche et la droite, qui descendent à travers le septum interventriculaire, enveloppées dans une gaine de tissu conjonctif qui les isole du tissu musculaire environnant. A l’intérieur du myocarde, elles sont en continuité avec le réseau de Purkinje (figure 1).
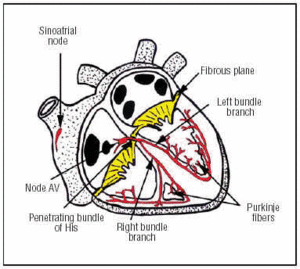
Fig. 1. Représentation schématique du système de conduction cardiaque (en rouge). Le Bundle of His pénétrant perfore le plan atrio-ventriculaire (AV) fibreux.
Zones d’intérêt morphologico-macroscopiques
Plusieurs zones d’intérêt macroscopiques permettent de localiser le CS cardiaque. Le nœud SA, sous-épicardique (figure 2a), est calé dans la jonction entre la musculature de la veine cave supérieure et celle de l’appendice auriculaire. Sa base est opposée à la crête terminale. La distance entre le nœud SA et l’épicarde est de 0,3±0,1 mm.11 Chez environ 10 % des personnes, le nœud ne s’étend pas vers la veine cave inférieure mais se trouve en forme de fer à cheval autour de la partie inférieure de l’orifice de la veine cave supérieure.12 Le nœud AV se trouve à la base du septum auriculaire, au sommet d’une zone triangulaire illustrée pour la première fois par Koch.13 Ce triangle est situé sur la surface endocardique de l’oreillette droite (Figures 2b et c), est bordé en avant par l’insertion du feuillet septal de la valve tricuspide, et en arrière par un tendon fibreux appelé tendon de Todaro. Ce tendon est le prolongement fibreux sous-endocardique de la valve d’Eustache et s’insère dans la musculature auriculaire séparant l’orifice du sinus coronaire de la fosse ovale. Le sommet de ce triangle est formé en haut par la jonction des bords antérieur et postérieur mentionnés ci-dessus, correspondant au corps fibreux central (CFB) du cœur. La base du triangle est formée par l’orifice du sinus coronaire ainsi que par le vestibule de l’oreillette droite supportant le feuillet septal de la valve tricuspide. Cette base est connue des électrophysiologistes sous le nom d’isthme septal, et c’est là que l’ablation par radiofréquence de la voie lente est effectuée chez les patients souffrant de tachycardie réentrante du nœud AV.14
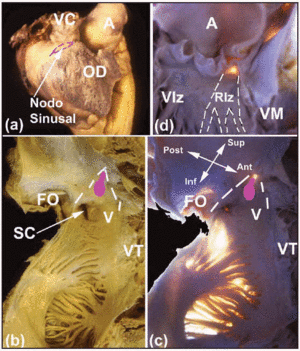
Fig. 2. A : vue épicardique latérale de l’oreillette droite avec le site du nœud SA représenté par la ligne rose pointillée. B et C : vues endocardiques (normale et avec transillumination) des parois postérieure et septale de l’oreillette droite pour montrer la fosse ovale (OF) et les limites du triangle de Koch (lignes blanches en pointillés), le tendon de Todazo (TT) et l’insertion de la cuspide septale de la valve tricuspide (TV). Le vestibule (V) de l’oreillette droite et l’orifice du sinus coronaire (CS) forment la limite inférieure. L’emplacement du nœud AV est indiqué par un nodule ovale (rose). D : vue du ventricule gauche pour montrer le septum membraneux (transillumination). C’est le point d’émergence du faisceau de His et sa continuité avec les branches du faisceau droit et du faisceau gauche. La branche bundle gauche (LBB) est marquée par des lignes blanches pointillées. A indique l’aorte ; AA, appendice auriculaire ; VC, veine cave supérieure ; VR, ventricule droit ; VG, ventricule gauche ; MV, valve mitrale.
La poursuite de la conduction AV se fait par le faisceau de His pénétrant, seule partie de l’axe conducteur qui perfore la BFC. La BFC est formée par l’union du tissu conjonctif des feuillets des valvules cardiaques aortique et mitrale avec le feuillet septal de la valvule tricuspide – le fameux trigone fibreux droit – et la partie membraneuse du septum interventriculaire. Dans de nombreux cœurs de mammifères, le trigone est fibreux, mais les cœurs de bovins présentent une masse centrale d’os ou de cartilage (l’os cordis). En revanche, le tissu fibreux du BFC du cachalot est très lâche. La partie membraneuse ou septum, dont la longueur peut varier, est un bon guide pour localiser le faisceau AV de His. Celui-ci apparaît au-dessus de cette portion membraneuse après avoir traversé le trigone fibreux droit (Figure 2d), et se divise ensuite en branches de faisceau gauche et droite. La branche droite traverse la musculature septale à la base du muscle papillaire médial du ventricule droit. Elle devient ensuite un mince cordon qui pénètre profondément dans la trabéculation septomarginale ou bande modératrice reliant les muscles papillaires médial et antérieur. L’origine de la branche gauche se situe sous la commissure entre les cuspides droite et non-coronaire de la valve aortique ; elle descend ensuite à travers le sous-endocarde du septum interventriculaire (figure 2d). Son trajet est parfois visible en raison de la lamelle fibreuse brillante qui la recouvre. La partie proximale de la branche gauche est beaucoup plus longue que celle de la branche droite. Occasionnellement, une troisième branche appelée » tractus cul-de-sac « 15 est observée dans les cœurs de fœtus ou de nourrissons, et celle-ci poursuit le faisceau de His dans une direction antéro-supérieure vers la racine de l’aorte.
Structure des nœuds et du système de conduction auriculo-ventriculaire
Des études dans lesquelles les techniques histologiques employées étaient similaires à celles utilisées par Tawara2 et des travailleurs ultérieurs tels que Davies16 et Truex et al17 (pour n’en citer que quelques-uns) ont montré que le CS de l’homme est disposé d’une manière tout à fait similaire à celui des autres mammifères (avec de légères variations entre les espèces et entre les cœurs). Tawara2 a signalé la séparation des myocytes spécialisés des myocytes normaux ou de travail par une fine feuille de tissu conjonctif visible au microscope optique, et c’est sur cette base que sont fondés les critères proposés par Aschoff18 et Mönckeberg19 pour l’identification histologique du myocarde spécialisé. En termes simples, les myocytes spécialisés se distinguent des myocytes actifs lorsqu’ils sont observés au microscope optique, et peuvent être « suivis » d’une section histologique à l’autre. Dans sa monographie, Robb8 préférait définir le tissu conducteur avec le terme de système de « connexion » plutôt que de système « conducteur », car les préparations histologiques définissent mieux la morphologie des cellules que leur fonction. Il a également observé des différences dans la texture du myocarde spécialisé en fonction de la fraîcheur du matériel d’autopsie et des méthodes de fixation et de coloration utilisées. Tawara2 était conscient de cela et a souligné l’hétérogénéité de la morphologie des myocytes spécialisés, même dans les sections histologiques du cœur. Au sein d’une espèce donnée, les différences les plus évidentes sont liées à l’âge des individus examinés.20 Ces dernières années, différents marqueurs moléculaires et immunohistochimiques ont été utilisés pour localiser le tissu conducteur dans les cœurs embryonnaires de l’homme et d’autres mammifères. Cependant, aucun marqueur spécifique n’a été trouvé qui puisse mettre en évidence ce tissu chez l’homme adulte.
Dans le cœur humain normal, les nœuds SA et AV ne répondent pas aux critères d’Aschoff et Mönckeberg18,19 car ils ne sont pas isolés électriquement du myocarde environnant par du tissu conjonctif ou graisseux. Au contraire, ils entrent en contact avec les fibres de travail auriculaires après une petite zone composée de cellules transitionnelles. Dans le nœud SA, Keith et Flack5 ont fait la distinction entre les cellules sinusales et les cellules de travail. Tawara2 a cependant indiqué les difficultés qu’il rencontrait pour différencier les cellules du nœud AV de celles du faisceau de His. Il a donc proposé que la différence entre elles soit purement anatomique. Sur la base de cette définition, la portion du CS entièrement gainée par la BFC est appelée faisceau pénétrant ou faisceau de His (figure 3a). La partie auriculaire allant du système de conduction proximal au faisceau de His est appelée le nœud AV (figure 3b). Cette distinction anatomique est logique car l’isolation du faisceau de His pénétrant l’empêche d’entrer en contact direct avec l’activité électrique de l’oreillette afférente. Toute activité auriculaire doit donc être préalablement dirigée par le nœud AV.
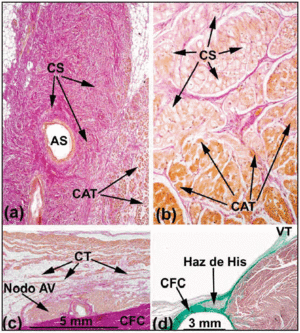
Fig. 3. Coupes histologiques sagittales du nœud sinusal (SA) du cœur humain (a;x10) et du cœur de porc (b;x40) colorées avec la méthode de van Gieson. Notez le contact entre les cellules sinusales (SC) et les cellules auriculaires actives (WAC). Les cellules sinusales sont caractérisées par leur clarté et leur inclusion dans une plus grande quantité de tissu conjonctif (rouge). c : coupe colorée par la méthode de van Gieson de la zone médiane du triangle de Koch. Notez la forme du nœud AV compact et les cellules transitionnelles (CT) en contact avec la surface convexe du nœud compact. d : Coupe colorée au trichrome de Masson montrant le faisceau de His pénétrant entouré de tissu fibreux (vert) provenant du BFC. SNA indique l’artère du nœud sinusal ; CFB, corps fibreux central ; TV, valve tricuspide.
La fonction intrinsèque du nœud SA est d’être la source de l’impulsion cardiaque. Le nœud SA chez l’homme est une structure arquée ou fusiforme. Histologiquement, il est composé de cellules légèrement plus petites que les cellules de travail normales, qui sont disposées en faisceaux. Celles-ci se mélangent sans ordre spatial, se colorent faiblement et sont noyées dans une matrice de tissu conjonctif dense (figures 3 a et b). Avec l’âge, la quantité de tissu conjonctif augmente par rapport à la surface occupée par les cellules nodales.21 A la périphérie du nœud, des cellules spécialisées sont mélangées à celles du myocarde de travail (Figures 3a et b). En outre, de multiples radiations ou extensions interdigitées avec le myocarde auriculaire actif ont été décrites. Ils pénètrent par voie intramyocardique dans la crête terminale et dans les veines caves supérieures et inférieures. Le nœud SA est disposé autour d’une artère appelée artère du nœud sinusal, qui peut être centrale ou excentrée à l’intérieur du nœud. Dans 29 % des cœurs humains, cette artère se ramifie à l’intérieur du nœud.11 Le nœud SA est aussi intimement associé au système nerveux autonome. Il a été suggéré que la majorité de ces fibres nerveuses sont parasympathiques, les fibres sympathiques étant concentrées autour des vaisseaux sanguins du nœud.23
La fonction inhérente du nœud AV est de retarder l’impulsion cardiaque. Chez l’homme, ce nœud présente une partie compacte et une zone de cellules transitionnelles. La première est semi-ovale et se trouve au-dessus de la BFC (figure 3c). Dans les sections proches de la base du triangle de Koch, la partie compacte du nœud se divise en deux extensions ou prolongements. L’artère vascularisant le nœud AV se trouve généralement entre ces deux extensions. La longueur de ces prolongements varie d’un cœur à l’autre.24 La taille des cellules transitionnelles est intermédiaire entre celles du nœud AV et les cellules de travail auriculaires. Elles sont entourées d’une plus grande quantité de cellules conjonctives que celles qui recouvrent les cellules actives, mais elles ne sont pas isolées du myocarde adjacent. Ils forment plutôt une sorte de pont entre le myocarde de travail et le myocarde nodal, et recueillent les informations électriques des parois auriculaires pour les transmettre au nœud AV.
Une controverse entoure la façon dont l’impulsion du nœud SA atteint le nœud AV. Certains auteurs ont suggéré l’existence de voies spécialisées entre eux.25 Nos études ne soutiennent pas cette idée mais favorisent l’hypothèse que les fibres musculaires de travail elles-mêmes (et leur disposition géométrique dans les parois auriculaires) sont responsables de la conduction plus rapide dans certaines zones de l’oreillette que dans d’autres.26
Le nœud AV se poursuit distalement avec le faisceau de His pénétrant (figure 3d), bien qu’il y ait de légères différences en termes de disposition cellulaire entre ces deux structures, notamment la disposition des cellules du faisceau de His de manière plus parallèle. L’explication de ce phénomène pourrait être morphologique : le faisceau de His commence à être entouré par le tissu conjonctif de la BFC, devenant ainsi un tractus conducteur qui achemine l’information vers les ventricules.
Le nœud AV du chien est plus petit que celui de l’homme, mais possède un faisceau de His pénétrant plus long.27 Certains auteurs28 interprètent cela comme signifiant qu’une partie du nœud AV du chien se trouve dans la BFC. Chez le lapin, d’autres auteurs29 décrivent une partie du faisceau de His comme si elle faisait partie du nœud AV, mais c’est une erreur (Figures 4a-d). La différence morphologique la plus remarquable entre le nœud AV du chien et ceux du lapin et de l’homme est que le premier n’est pas recouvert de cellules transitionnelles. Chez le rat (dont la fréquence cardiaque au repos est 10 fois plus rapide que celle du chien ou de l’homme), le nœud AV est proportionnellement comparable à celui du chien, mais le BFC est plus petit.
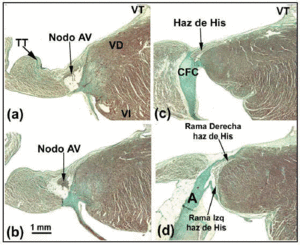
Fig. 4. Cette figure composite montre le nœud auriculo-ventriculaire (AV) plus le faisceau de His et ses branches droite et gauche chez le lapin. La barre horizontale en b représente 1 mm (identique pour toutes les images). Coloration au trichrome de Masson. A indique l’aorte ; TT, tendon de Todaro ; RV, ventricule droit ; LV, ventricule gauche ; TV, valve tricuspide.
Lorsque l’on suit la trajectoire histologique du système de conduction vers le faisceau de His pénétrant, on constate que ce dernier tourne vers la gauche dans de nombreux cœurs humains, et émerge sur la crête musculaire du septum interventriculaire. Entouré par le tissu conjonctif de la BFC, la longueur du faisceau de His peut varier avant de se diviser en deux branches, la gauche et la droite. La première branche passe en cascade sur le côté gauche du septum interventriculaire (figures 5a et c). La division du faisceau de His ressemble à un jockey accroupi au-dessus de la crête musculaire du septum interventriculaire (figure 5a). Cependant, il arrive qu’elle soit déviée vers la gauche (figure 5c). Lorsque cela se produit, la branche droite pénètre à l’intérieur de la musculature du septum (figure 5b), apparaissant dans le ventricule droit en association avec l’insertion du muscle papillaire médial.
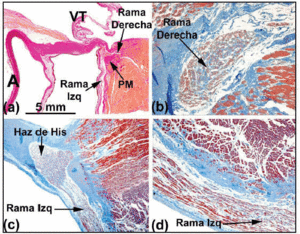
Fig. 5. a : coupe colorée par van Gieson montrant le faisceau de His (cœur humain) au-dessus de la partie membraneuse (MP) du septum interventriculaire. b : à son origine, la branche droite de ce cœur est intramyocardique et est entourée de tissu conjonctif (bleu) (coloration trichrome de Jones, x20). c : la division du faisceau de His dans ce coeur est déplacée sur le côté gauche de la crête musculaire du septum interventriculaire, et descend longitudinalement sous l’endocarde du ventricule gauche (trichrome de Jones, x5). d : notez la gaine conjonctive de recouvrement (bleu) de la branche gauche (trichrome de Jones, x10). A indique l’aorte ; E, l’endocarde ; TV, la valve tricuspide.
Le long de leurs parcours proximaux, les branches groupées droite et gauche sont recouvertes d’une lamelle fibreuse (figures 5b et d). Comme l’a montré Tawara2 (figure 6a), chez l’homme, la branche gauche est typiquement divisée en trois fascicules avec une intercommunication importante. Ces fascicules se ramifient dans l’apex ventriculaire, et s’étendent à l’intérieur des deux muscles papillaires de la valve mitrale, mais aussi en arrière le long des parois ventriculaires vers la base cardiaque. Plus distalement, dans l’apex des ventricules du cœur humain, il devient presque impossible de tracer les ramifications des fibres de Purkinje car celles-ci perdent leur enveloppe fibreuse et ressemblent beaucoup au myocarde de travail.
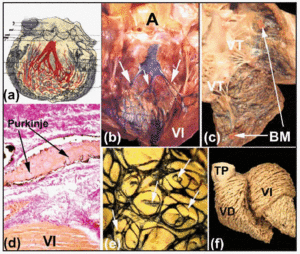
Fig. 6. a : schéma de Tawara montrant la disposition trifasciculaire de la branche bundle gauche chez l’Homme. b et c : un coeur de veau frais dans lequel les ventricules droit et gauche ont été ouverts. Des injections sous-endocardiques d’encre de Chine révèlent les branches du faisceau droit et gauche et le réseau de Purkinje. Notez en B les trois fascicules de la branche bundle gauche (flèches), et en C la bande modératrice (MB). d : coupe d’un coeur de veau (coloration de van Gieson, x100) obtenue après injection d’encre de Chine dans le réseau de Purkinje), qui est enveloppé à son origine par du tissu conjonctif (rouge). e : disposition sous-endocardique du réseau de Purkinje dans le ventricule gauche d’un veau. Notez la disposition elliptique du réseau et les ramifications des bords qui pénètrent dans le myocarde (flèches). f : dissection des fibres musculaires ventriculaires d’un cœur humain adulte. Notez la différence de disposition entre les couches médiane et profonde du ventricule gauche. A indique l’aorte ; PT, tronc pulmonaire ; LV, ventricule gauche ; TV, valve tricuspide.
L’injection sous-endothéliale d’encre de Chine est l’une des méthodes utilisées pour observer ces feuillets fibreux et pour mettre en évidence le parcours sous-endocardique des branches du faisceau droit et gauche et de leurs ramifications dans les cœurs d’ongulés (figures 6b et d). Nos études sur les cœurs de moutons et de veaux montrent que ceux-ci diffèrent quelque peu des cœurs humains. Les cœurs de veaux ressemblent davantage aux cœurs humains en ce sens que les fascicules de la branche bundle gauche sont généralement au nombre de trois et prennent naissance dans la partie supérieure du septum interventriculaire (figure 6b). En revanche, les cœurs de mouton ne présentent que deux fascicules, et ceux-ci apparaissent à mi-longueur de la paroi septale. Dans les cœurs de mouton et de veau, de petits trabécules musculaires traversent la cavité ventriculaire – ce qu’on appelle le « faux tendon » – qui, à l’intérieur, transportent les ramifications distales des branches de His vers les muscles papillaires et les parois ventriculaires adjacentes. Sur le côté droit du cœur, la bande modératrice du cœur du mouton et du veau est plus mince que celle de l’homme, mais à l’intérieur, elle contient toujours une ramification de la branche de faisceau droite (figure 6c).
Dans les cœurs d’ongulés, le réseau de Purkinje sous-endocardique est de disposition elliptique, tant dans le ventricule gauche que dans le ventricule droit (figure 6e). De plus, de son contour naissent des branches qui pénètrent les parois ventriculaires, conduisant à de nouvelles branches ou à des anastomoses avec d’autres branches (Figure 6e). Cependant, les branches intramurales du réseau de Purkinje n’ont pas été démontrées dans le cœur humain.30
Un point controversé concernant le réseau de Purkinje est l’existence de cellules de transition entre le myocarde ventriculaire de travail et les fibres de Purkinje.31 Les études anatomiques et immunohistochimiques d’Oosthoek et al,30 montrent que, dans les cœurs bovins, il existe une très petite zone de cellules de transition où les fibres de Purkinje perdent leur couverture de tissu conjonctif. Cependant, de telles cellules n’ont pas été observées dans le cœur de mouton.32 Lorsque les fibres de Purkinje perdent leur enveloppe de tissu conjonctif, des impulsions électriques passent du CS aux myocytes actifs des ventricules. L’orientation spatiale des myofibrilles de travail dans les parois du ventricule détermine la nature anisotrope de la conduction ventriculaire (figure 6f).
CONCLUSIONS
Bien que des différences existent entre les espèces, la structure des nœuds, ainsi que celle du reste du système de conduction AV humain, est similaire à celle des animaux de laboratoire couramment utilisés. Le nœud SA, la structure qui génère l’impulsion cardiaque, est situé à une extrémité de l’oreillette droite. Les impulsions provenant de ce nœud se déplacent vers la partie postérieure des parois de l’oreillette à travers une disposition spatiale complexe mais précise des fibres atriales actives jusqu’à ce qu’elles atteignent l’extrémité de l’oreillette. À cette extrémité, les cellules transitionnelles du nœud AV reçoivent l’impulsion et la retardent avant sa transmission via le faisceau de His. Ce dernier traverse le plan fibreux isolant entre les oreillettes et les ventricules, et transmet l’impulsion via deux branches (les branches du faisceau droit et gauche) vers les ventricules correspondants. Chacune de ces branches est isolée par une gaine conjonctive de myocytes ventriculaires en activité. Cette disposition ne permet le contact entre les myocytes spécialisés et les myocytes actifs qu’au niveau des ramifications distales du faisceau de His. De cette façon, le système de conduction AV, largement décrit par Tawara2 il y a près de 100 ans, est structuré de manière à donner un ordre à la transmission des impulsions cardiaques. Connaître la structure et l’emplacement des tissus conducteurs spécifiques dans le cœur pourrait aider à apporter des solutions aux différentes perturbations du rythme cardiaque.
Leave a Reply