Amérique du SudChien de brousse Speothos venaticus

chien de brousse – © Gerald L Zuercher
Groupe de travail sur les canidés amazoniens – Karen DeMatteo et Fernanda Michalski sont les coordinatrices du groupe de travail sur les canidés amazoniens. Ce groupe de travail se concentre sur quatre espèces : le chien à oreilles courtes, le renard mangeur de crabes, le chien de brousse et les renards sud-américains. Les canidés amazoniens sont semblables à de nombreux carnivores dans le monde entier dont la survie à long terme est menacée par une variété de menaces directes et indirectes, notamment la perte d’habitat, l’expansion des barrages hydroélectriques, la chasse illégale des proies et les maladies des chiens domestiques.
Projets
- Proyecto Zorro Pitoco : Utilisation de techniques non invasives pour fournir de nouvelles perspectives pour les chiens de brousse et la biodiversité coexistante à Misiones, Argentine
- Surveillance de la faune par piège à caméra dans et autour du parc national Madidi, Bolivie
- Investigation de l’helminthiase néotropicale et d’autres parasites dans le biotope des animaux sauvages de la forêt de Misionera, comme foyers potentiels de zoonoses
- Effet du changement climatique sur les carnivores en Amazonie
Liens pertinents
- Flickr : Canidés sauvages du monde
- Évaluation de la liste rouge de l’UICN 2011 – Chien de brousse
Rapports / Documents
- Résidents de la forêt – canidés d’Amazonie
- Enquête sur le statut de 2004 & Plan d’action de convergence -. Amérique du Sud
- Pourquoi les chiens de brousse sont si différents des autres chiens
- Des chiens de brousse rares d’Amazonie pris en photo
- Un chien de sauvetage aide maintenant à sauver d’autres chiens (beaucoup plus sauvages)
- Espèce étonnante : chien de brousse
Autres noms
Anglais : Bush Dog, Savannah Dog, Vinegar Dog
Français : Chien Des Buissons, Zorro
Espagnol ; Castillan:Cachorro Vinagre, Guanfando, Pero Selvático, Perrito Venadero, Perrito de Monte , Perro De Monte, Perro Grullero , Perro Vinagre , Perro de Agua, Perro de la Selva, Umba, Zorrito Vinagre, Zorro Pitoco , Zorro Vinagre
Allemand : Waldhund
Italien : Itticione, Speoto
Portugais : Cachorrinho, Cachorro-do-mata, Cachorro-do-mato-cotó, Cachorro-do-mato-vinagre, Cachorro-pitoco
Justification
Bien que répandu, le chien de brousse semble être rare sur l’ensemble de son aire de répartition. L’espèce s’est avérée extrêmement difficile à localiser dans la nature, ce qui rend les estimations des tendances de la population difficiles. Alors que l’on pourrait s’attendre à ce qu’une espèce largement distribuée avec des occurrences confirmées dans un habitat fragmenté ou altéré ait une population généralement stable, les preuves préliminaires sur le terrain suggèrent que ces zones peuvent modifier les exigences écologiques du chien de brousse, ce qui entraîne une augmentation de la zone minimale nécessaire pour soutenir un groupe (et donc mettre l’espèce à un risque accru d’exposition directe ou indirecte à d’autres menaces). L’espèce est ici inscrite dans la catégorie « Quasi menacée » sur la base d’un déclin estimé à 20-25% au cours des 12 dernières années (durée estimée de la génération = 4 ans), ce qui correspond approximativement au seuil d’inscription dans la catégorie « Vulnérable » selon le critère A2. Ce déclin est attribuable à de multiples menaces, notamment la perte et la fragmentation continues de l’habitat, la réduction de l’abondance des proies en raison de la chasse illégale et de la prédation par les chiens domestiques, et un risque accru de maladies liées aux canidés.
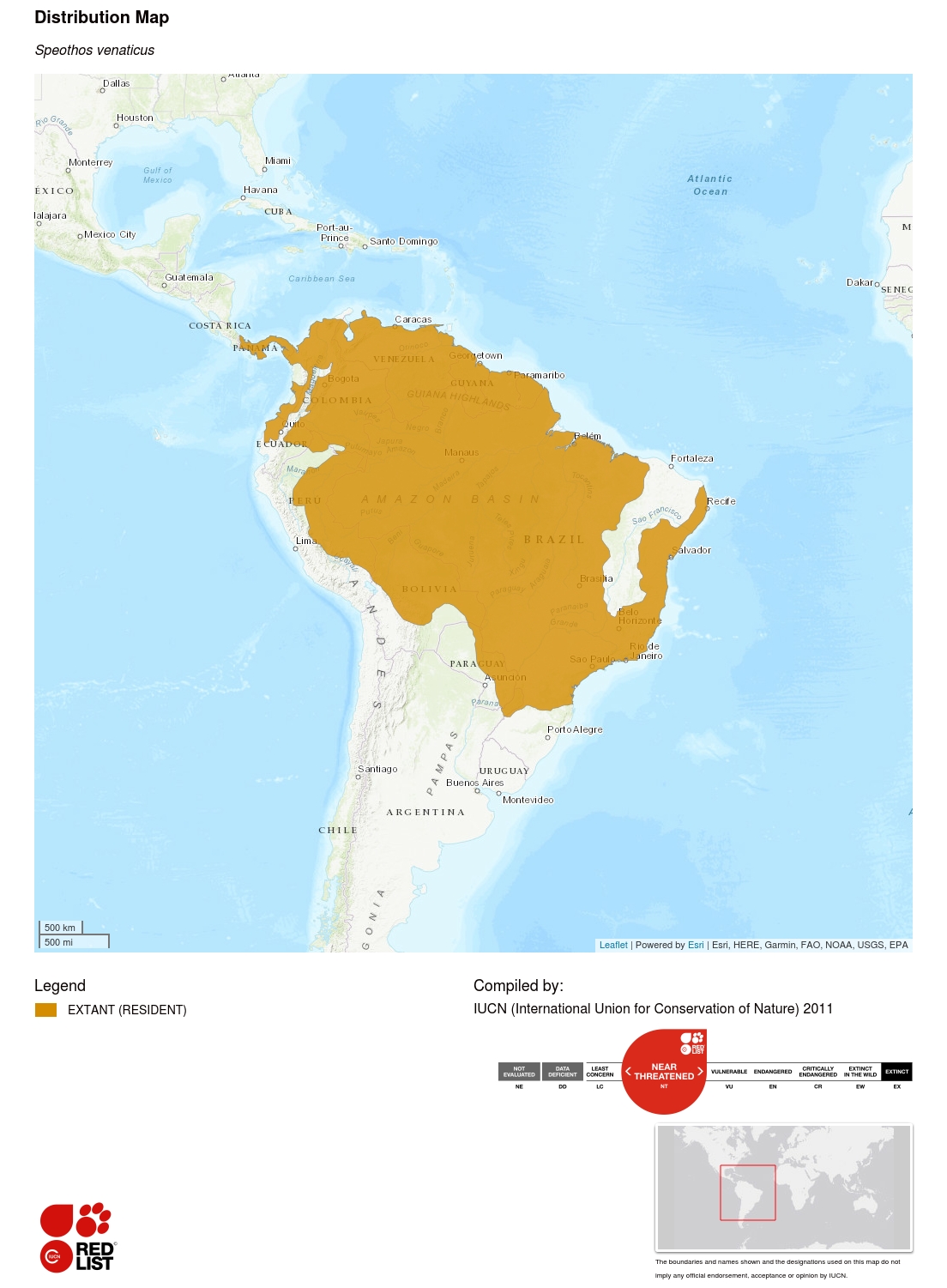
Informations sur l’aire de répartition géographique
Cette espèce est présente depuis l’extrême est de l’Amérique centrale et le nord de l’Amérique du Sud, au sud du Paraguay et au nord-est de l’Argentine. Des sous-populations isolées peuvent également encore être présentes en Équateur et en Colombie, à l’ouest des Andes. Sa distribution historique peut s’être étendue jusqu’au Costa Rica (Rosa et Nocke 2002), où l’espèce peut encore survivre. La carte de répartition actuelle a été établie à partir des résultats d’une vaste enquête menée auprès de biologistes spécialistes des carnivores et de la littérature sur la présence de l’espèce (n = 399 emplacements historiques), ainsi que d’un modèle bioclimatique prédisant les zones propices à l’espèce (DeMatteo et Loiselle 2008). Ces derniers auteurs ont estimé que la superficie totale prédite comme convenant aux chiens de brousse est de l’ordre de 14 445 000 km², dont 77 % se trouvent dans l’aire de répartition actuelle.
Tendance de la population : en baisse
Informations sur la population
Malgré sa grande aire de répartition et sa présence dans une variété d’habitats, le chien de brousse semble être naturellement rare dans toute son aire de répartition. Dans une enquête récente de DeMatteo (2008), la majorité des pays dans la distribution du chien de brousse ont rapporté le statut de l’espèce comme rare ou inconnu (rare : Équateur ; rare ou inconnu : Argentine, Bolivie, Brésil, Guyane française, Paraguay ; inconnu : Panama et Venezuela) et seulement deux pays l’ont signalé comme commune (Guyana et Pérou). L’espèce est rarement enregistrée à l’aide de pièges photographiques ; cependant, il faut être prudent lors de l’interprétation de l’absence de détection, car cela peut en fait être associé au fait que l’espèce évite activement les caractéristiques associées à cette technique (par ex, le placement des pièges le long des sentiers d’animaux utilisés par d’autres carnivores) ou des hypothèses sur les mouvements des animaux (par exemple, le placement le long des routes suppose que l’animal marchera le long de la route plutôt que de traverser la route).
Les données démographiques sur les chiens de brousse manquent dans toute leur aire de répartition et les estimations de population n’ont été rapportées que pour quelques zones : <100 en Misiones Argentine (DeMatteo 2008), >1 000 en Bolivie (DeMatteo 2008), >1 000 sur 4 022 km² ou un individu/4 km² à Cusco Pérou dans la région de la rivière Camisea (DeMatteo 2008), 0,04 individus/km² (B. Beisiegel comm. pers.) au Brésil, 0,025 individus/km² dans le cerrado partiellement fragmenté du Mato Grosso Brésil (E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, et S. Klorfine, obs. pers.), 15,8 individus/394 km² ou 0,04 individus/km² dans le Pantanal au Brésil (Lima, Jorge et al. 2009), et 0,001 individus/km² dans le sud fragmenté de l’Amazonie au Brésil (Michalski 2010). Une zone appropriée d’environ 11 000 000 km² (DeMatteo et Loiselle 2008), et une densité de population moyenne d’environ 0,01 individu/km², permettraient de prévoir une population estimée à 110 000 individus, dont environ la moitié serait mature ; cependant, les effets de la fragmentation, le degré de protection et la variabilité de leur large distribution suggéreraient qu’il s’agit d’une surestimation.
Dans toute l’aire de répartition du chien de brousse, les tendances de la population sont signalées comme étant inconnues dans deux pays (Guyane et Panama), en déclin dans deux pays (Paraguay et Venezuela), inconnues ou stables dans un pays (Guyane française), et stables dans deux pays (Équateur et Pérou, plus précisément Cusco Pérou) (DeMatteo 2008). Dans l’ensemble de l’aire de répartition, l’augmentation des niveaux de fragmentation de l’habitat (urbanisation et agriculture), les menaces sur les populations de proies avec le braconnage illégal, et l’exposition à des maladies potentiellement mortelles liées à la candidose, signifient que la probabilité que la tendance soit stable ou en augmentation est très peu probable.
Informations sur l’habitat et l’écologie
Le chien des buissons est signalé comme un généraliste de l’habitat par les peuples autochtones, dans le contexte où il se trouve généralement près des sources d’eau, en particulier les petits cours d’eau, où les densités de proies peuvent être plus élevées (Zuercher et al. 2005 ; E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, et S. Klorfine, obs. pers. ; M. Swarner, comm. pers.). Les chiens de brousse ont été observés dans les habitats forestiers des basses terres (en dessous de 1500 m), y compris les forêts primaires et les galeries (Defler 1986), les forêts semi-décidues et les forêts saisonnièrement inondées (Aquino et Puertas 1997). Des observations ont également été enregistrées dans des habitats de cerrado au Brésil (Silveira et al. 1998 ; Oliveira 2009, C. Brady comm. pers.) et au Paraguay (Zuercher et Villalba 2002) et dans des zones de lisière/riverains de la pampa (savane humide) (Strahl et al. 1992, Emmons 1998). Des rapports récents mentionnent des chiens de brousse dans trois habitats uniques : la caatinga, le chaco et les mangroves le long de la côte (DeMatteo et Loiselle 2008). Dans certains cas, ils ont été observés à plusieurs kilomètres de l’habitat forestier (Silveira et al. 1998). L’espèce est également signalée occasionnellement dans des forêts secondaires, des ranchs (M. Swarner comm. pers.), des ranchs cerrado fragmentés (E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, et S. Klorfine comm. pers. ; L. Silveira et A. Jácomo pers. comm.), des zones perturbées (DeMatteo et Loiselle 2008, Oliveira 2009), et des zones forestières fragmentées (Michalski et Peres 2005, Michalski 2010).
Aucune préférence de sélection d’habitat n’a été trouvée ni dans le Pantanal au Brésil (Lima, Jorge et al. 2009) ou dans le mélange forêt atlantique – cerrado du Haut Paraná au Paraguay (Zuercher et al. 2005) ; cependant, certaines preuves ont été trouvées suggérant une préférence pour un habitat intact de savane et de forêt par rapport à un habitat altéré (terres cultivées et pâturages) pour un groupe de chiens de brousse dans un cerrado partiellement fragmenté, indiquant que l’utilisation et la préférence de l’habitat peuvent différer selon la région et la disponibilité (E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, et S. Klorfine pers. obs.). Alors que Michalski (2010) a signalé l’absence de chiens de brousse dans les zones fragmentées du sud de l’Amazonie, d’autres études ont démontré que leur présence est probable (DeMatteo et Loiselle 2008 ; Oliveira 2009 ; E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, et S. Klorfine pers. obs.) ; cependant, l’intensité de l’utilisation dans ces zones et l’impact sur les exigences écologiques sont inconnus. Des données préliminaires sur le terrain suggèrent que plus le degré de fragmentation de l’habitat augmente, plus la surface requise par le chien de brousse augmente (E.S. Lima pers. comm.) ; bien que ces données ne soient disponibles que pour l’écosystème du cerrado au Brésil, on pense qu’elles sont vraies pour tous les types d’habitat et qu’elles reflètent une relation négative entre la densité des proies et la fragmentation de l’habitat. Une nouvelle analyse de la distribution historique du chien de brousse (n > 250 emplacements) a déterminé qu’environ un quart (20%) était associé à un habitat fragmenté/altéré et que le pourcentage d’habitat modifié augmentait lorsque l’estimation était étendue de la zone nécessaire pour soutenir un seul individu à la zone à celle d’un groupe de reproduction (DeMatteo et Loiselle 2008).
La variation rapportée dans les estimations de la taille du domaine vital est probablement associée à l’intégrité de l’habitat et à la densité des proies : 150 km² (forêt atlantique du Haut Paraná ; Beisiegel 1999), environ. 16 km² (Beisiegel et Ades 2004), et 140 km² (Fixed Kernel 95%) pour un groupe de chiens de brousse (n = 2-4 individus) dans le cerrado (E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, et S. Klorfine, obs. pers.).
Les données préliminaires de terrain soutiennent les études en captivité selon lesquelles les chiens de brousse existent dans des groupes familiaux avec des jeunes d’une ou plusieurs portées (DeMatteo 2008, Michalski 2010, E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, and S. Klorfine, pers. obs.) ; cependant, des individus solitaires sont régulièrement observés dans une variété de types d’habitats. La reproduction dans la nature est aseptique (DeMatteo 2008). L’espèce semble avoir un mode de déplacement semi-nomade plutôt qu’un véritable territoire comme de nombreux carnivores (DeMatteo 2008, E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, et S. Klorfine, obs. pers.) et a été enregistré vivant en sympatrie avec Atelocynus microtis au Pérou et au Brésil (Leite Pitman, Beck et al. 2003, Michalski 2010). La durée estimée de la génération est de quatre ans [(0,5 x durée de reproduction de six ans) + maturité sexuelle à un an (en captivité ; Porton et al. 1987).
Les données préliminaires de terrain confirment les rapports anecdotiques sur le régime alimentaire et l’idée que les chiens de brousse sont hautement carnivores (Deutsch 1984, Peres 1991) ; cependant, il semble y avoir des preuves de la préférence des proies en fonction de la région géographique et du type d’habitat, ce qui est probablement aggravé par la variabilité saisonnière. Dans la région du Pantanal au Brésil, le principal aliment était le tatou à neuf bandes (Dasypus novemcinctus ; 94%) avec des petits mammifères, des agoutis (Dasyprocta azarae) et des oiseaux en plus petites quantités ; cependant, aucun fruit n’a été enregistré (n = 17, identifiés par l’odeur et les traces ; Lima, Jorge et al. 2009). Dans la forêt atlantique intérieure du Paraguay, la majorité du régime alimentaire était composée d’Agoutis et de Paca (Cuniculus paca), les petits mammifères, les rongeurs, les reptiles, les invertébrés et les fruits de Cecropia étant présents en plus faible quantité (n = 11, identifiés à l’aide de l’ADN mitochondrial ; Zuercher et al. 2005). Dans un centre de reproduction réussi dans le sud-est du Brésil, où de la viande et des fruits (banane et papaye) sont disponibles, les animaux mangent des fruits et de la viande en proportions égales (L. Saboia, comm. pers.). La prédation de la volaille a été signalée occasionnellement (DeMatteo 2008).
Menaces Information
Il existe plusieurs menaces graves perçues, notamment : 1) l’empiètement humain et la perte d’habitat intact en raison de l’agriculture à grande échelle (par exemple, le soja), la conversion des terres en pâturages et les plantations à grande échelle d’arbres en monoculture (par exemple, eucalyptus, pin) ; 2) la réduction de l’abondance des proies en raison du braconnage illégal et de la prédation par les chiens domestiques ; et 3) le risque accru de contracter des maladies mortelles par les chiens domestiques (proximité des populations humaines et des chiens de chasse (DeMatteo 2008).
Les maladies liées aux canidés constituent une menace qui n’a pas été identifiée précédemment pour les chiens de brousse. Cependant, des preuves de terrain soutiennent que les agents pathogènes peuvent être transmis par les chiens domestiques, et les effets peuvent être potentiellement dévastateurs, principalement en raison de la vie en groupe de l’espèce (Mann et al. 1980, Steinel et al. 2001, Leite Pitman, Nieto et al. 2003, Jorge, Morato et al. 2007, Jorge, Nunes, et al. 2007, DeMatteo 2008, Jorge et al. 2008, E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima, and S. Klorfine, pers. obs.). E.S. Lima, K.E. DeMatteo, R.S.P. Jorge, M.L.S.P. Jorge, J. Dalponte, H.S. Lima et S. Klorfine (obs. pers.) ont observé cet effet lorsqu’une perte de poils généralisée, soupçonnée d’être un type de gale, s’est progressivement propagée dans un groupe de chiens de brousse sauvages, pour finalement tuer tous les individus. En plus de la gale, le parvovirus et la rage sont des maladies rapportées comme ayant un effet négatif sur les populations sauvages (Mann et al. 1980, DeMatteo 2008). L’espèce a été identifiée comme sensible à la fois à Dioctophyma renale et Amphimerus interruptus (collections de musée – Vierira et al. 2008), Lagochilascaris sp. (Volcán et Medrano 1991), et comme hôte d’Echinococcus vogeli (Cestoda : Taeniidae) (Rausch et Bernstein 1972). Les animaux en captivité ont été identifiés comme sensibles à une variété de maladies et de parasites, y compris le parvovirus (Janssen et al. 1982), la maladie de Carré induite par la vaccination (McInnes et al. 1992), la leishmaniose (Lima, Fattori et al. 2009), Spirocerca lupi (Rinas et al. 2009), Toxoplasma gondii (Sedlak et Bartova 2006), et Campylobacter (L. Saboia pers. comm.). Dans ce dernier cas, 13 des 15 individus d’un grand groupe familial sont soudainement morts d’une entérite hémorragique sévère après avoir contracté Campylobacter à partir d’un Coati infecté qu’on leur avait donné à manger par inadvertance (L. Saboia comm. pers.). Cette perte de plusieurs animaux en une courte période souligne à la fois la sensibilité de l’espèce à diverses maladies et la susceptibilité des espèces vivant en groupe aux agents pathogènes. Avec la proximité croissante des zones humaines et l’intrusion de chiens de chasse dans les zones protégées, le risque d’exposition aux maladies est potentiellement élevé. L’exposition aux maladies peut également résulter de la présence de chiens domestiques non vaccinés, sauvages ou semi-fermes, qui chassent régulièrement des proies indépendamment des humains (K. DeMatteo obs. pers.). DeMatteo (2008) a noté qu’au Brésil, il y avait plus d’interactions problématiques entre les chiens de brousse et les chiens domestiques qu’avec le bétail, ce qui ne fait que souligner la menace de maladie pour l’espèce.
Informations sur l’utilisation et le commerce
Des chiens de brousse ont été signalés abattus dans cinq pays (Argentine, Brésil, Panama, Pérou, Venezuela) et piégés dans deux (Panama et Pérou) (DeMatteo 2008, F. Michalski données inédites). Au Pérou, ces événements ont été associés à des indigènes déclarant qu’ils mangeront des chiens de brousse s’ils sont pris au piège ou s’ils ont la rare opportunité de les collecter alors avec la chasse traditionnelle ; cependant, le Venezuela a rapporté que les tirs étaient associés à la collecte occasionnelle de trophées en raison de sa rareté (DeMatteo 2008).
Information sur les actions de conservation
Cette espèce est présente dans plusieurs aires protégées à travers son aire de répartition, mais elle a une distribution inégale et est présente à de très faibles densités. La chasse est interdite en Colombie (loi numéro 848:1973), en Equateur (loi numéro 74:1981), en Guyane française (loi numéro JO19860625:1986), au Panama (loi numéro 2-80:1980), au Paraguay (loi numéro 18796:1975) et au Pérou (loi numéro 5056:1970). La chasse et le commerce sont réglementés en Argentine (loi n° 22.421:1981), en Bolivie (loi n° 12301:1975), au Brésil (loi n° 5197:191967) et au Venezuela (loi n° 276:1970). Il n’existe aucune information pour la Guyane et le Suriname. Malheureusement, dans de nombreuses parties de son aire de répartition, les ressources sont insuffisantes pour gérer les zones protégées désignées et appliquer les lois existantes sur la faune.
Inclus dans la CITES à l’annexe I.
Les chiens des buissons sont présents en captivité et font partie d’un programme d’élevage international réussi (Buck 2009), qui comprend l’Asie (Japon), l’Europe, le Brésil et l’Amérique du Nord. Il n’y a pas eu de tentatives connues de réintroduction.
Les estimations de population et les données démographiques des chiens de brousse sont encore peu connues dans toute son aire de répartition. Cela s’étend à la compréhension de la dynamique sociale des groupes individuels, notamment en termes de dispersion des jeunes et de zone d’utilisation par rapport aux autres groupes (chevauchement ou séparation des domaines vitaux). Les associations d’habitats ne sont pas clairement comprises – on pensait autrefois que l’espèce était dépendante des forêts, mais on l’observe de plus en plus dans des habitats ouverts et fragmentés ; cependant, il n’existe pas de données sur la viabilité des populations dans ces zones. Les données préliminaires sur le régime alimentaire confirment que l’espèce est principalement carnivore, mais les changements saisonniers et les variations géographiques du régime alimentaire doivent être évalués. Il est nécessaire de déterminer comment l’impact des maladies, en particulier la dynamique de transmission par les chiens domestiques, peut être géré ou minimisé dans les populations sauvages. Les relations interspécifiques avec les carnivores sympatriques doivent être évaluées plus avant.
La localisation des preuves de la présence des espèces à l’aide des techniques d’enquête standard, y compris les pièges à caméra et les enquêtes par transects, s’est avérée difficile (Beisiegel 2009, DeMatteo et al. 2009, Michalski 2010). L’utilisation d’appâts olfactifs artificiels, qui peuvent augmenter l’attraction vers un endroit spécifique, s’est avérée infructueuse avec les chiens de brousse sauvages (Zuercher et al. 1999). Cependant, il existe plusieurs ajustements méthodologiques qui peuvent augmenter l’efficacité de ces techniques avec l’espèce, y compris l’ajustement de la hauteur du placement de la caméra, l’augmentation de l’effort de piégeage, et l’utilisation simultanée d’enregistrements de vocalisations d’appels longs et d’urine conspécifique (DeMatteo et al. 2004). Des essais limités sur le terrain dans un cerrado partiellement fragmenté (2004-2005) avec des playbacks, de l’urine et des pièges à mâchoires ont échoué (K. DeMatteo, données non publiées). Cependant, des essais supplémentaires sont nécessaires pour déterminer comment la densité des espèces, la variabilité de l’habitat (forêt versus cerrado) et la densité des proies modifient l’efficacité des techniques.
Les recherches préliminaires et en cours utilisant une combinaison de trois techniques non invasives (chiens détecteurs d’odeur, dépistage de l’ADN fécal, technologie GIS) se sont avérées fructueuses pour l’espèce (DeMatteo et al. 2009, données non publiées) et devraient être étendues à d’autres régions et habitats. Cet ensemble de techniques élimine la nécessité d’attirer l’espèce dans un endroit spécifique et permet de comprendre de nombreuses variables écologiques, notamment l’utilisation de l’habitat (intact et fragmenté), l’état de la population, la zone minimale d’utilisation et le chevauchement/séparation de niche avec d’autres carnivores.
Leave a Reply