Miksi #”HF ”#:llä on alhaisempi kiehumispiste kuin vedellä, vaikka #”F ”# on elektronegatiivisempi kuin #”O ”#?
Tässä on monia monimutkaisia tekijöitä. Tämän löysin:
- Vesi voi muodostaa tasapainoisemman vetysidosverkoston (kaksi akseptoria ja kaksi donoria yhden donorin ja kolmen akseptorin sijasta), jolloin irtosysteemi on tasaisemmin vuorovaikutuksessa ja siten vahvempi kokonaisuutena.
- Vesi muodostaa laajemman vetysidosverkoston (kolmiulotteinen tetraedrinen paikallinen ympäristö kaksiulotteisen siksak-ympäristön sijaan), jolloin irtosysteemi ei ole niin helposti höyrystyvä.
- Vedellä on yleensä optimaalisempi vuorovaikutuskulma, koska se vastaa paremmin molekyylin elektronigeometriaa ja kohdistaa vuorovaikutukset molekyylin dipolin suuntaisesti, kun taas #”HF ”#:llä olisi voimakkaampi vetysidos (raakalukuina ilmaistuna), jos vuorovaikutukset olisivat lineaarisia.
DISKLAIMERI: PITKÄ VASTAUS! Myös hyvin visuaalinen.
Vetysidos on vahvin molekyylien välinen voima sekä #”HF ”#:ssä että #”H”_2 ”O ”#:ssa. Vuorovaikutuksen voimakkuus riippuu vuorovaikutusetäisyydestä, vuorovaikutuskulmasta ja verkoston laajuudesta.
Kun vedämme pois kaikki vetysidonnaiset vuorovaikutukset ja oletamme, että kyseessä on puhdas vesi ja puhdas #”HF ”#, saamme (eristämällä valitun joukon molekyylejä äärettömästä matriisista)#””^()##””^()#:
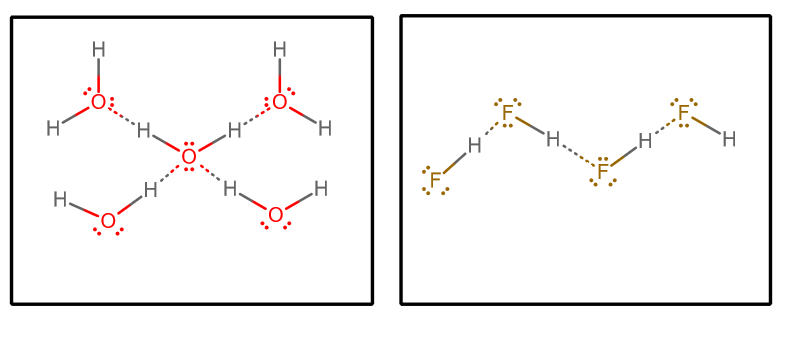
Voisimme tämän jälkeen ottaa huomioon muutamia tekijöitä:
- Vetysidosten luovuttajien ja vastaanottajien määrä
Jokainen vesimolekyyli voi ottaa vastaan kaksi vetysidoksista vuorovaikutusta (yksinäisten parien kautta) ja luovuttaa kaksi vetysidoksista vuorovaikutusta (vetyjen kautta).
Toisaalta jokainen #”HF ”#-molekyyli ottaa vastaan kolme vetysidosvuorovaikutusta (yksinäisten parien kautta) ja luovuttaa vain yhden (vedyn kautta).
Voidaan siis väittää, että vedellä on tasapainoisempi vetysidosverkosto, mikä tekee irtosysteemistä kaiken kaikkiaan huonommin höyrystyvän. Tämä tukisi veden korkeampaa kiehumispistettä kuin #”HF ”#.
- #bb(”F”)# ja #bb(”O”)# elektronegatiivisuudet
#”F ”# on elektronegatiivisempi, joten se pitää kiinni elektronitiheydestään helpommin; näin ollen yksinäisten parien odotetaan olevan heikompia vetysidosvuorovaikutusten luovuttajia kuin #”O ”#:n yksinäiset parit.
Tämä näyttäisi ennustavan, että jokainen yksittäinen vetysidosvuorovaikutus on heikompi, mikä tukisi veden korkeampaa kiehumispistettä kuin #”HF ”#, MUTTA tämä on ristiriidassa seuraavan kohdan kanssa.
- Keskimääräiset raa’at vetysidosten voimakkuudet #bb(”HF”)# vs. vesi
#”O”-”H ”cdotcdotcdot: ”O”-#, #DeltaH_(”H”-”sidos”) ~~ ”21 kJ/mol ”#
#”F”-”H ”cdotcdotcdot: ”F”-#, #DeltaH_(”H”-”sidos”) ~~ ”161.5 kJ/mol ”#
Tämä Wikipediasta saatu tieto viittaa siihen, että #”HF ”#:llä on vahvemmat vetysidosvuorovaikutukset #”HF ”#-molekyylien kesken kuin vedessä.
Tämä ei tukisi kokeellista todistusta siitä, että #”HF ”#:llä on paljon alhaisempi kiehumispiste, mutta tämäkin on vain raakaluku eikä ota huomioon esimerkiksi vuorovaikutuskulmia irtosysteemissä.
- Havaitut vetysidoskulmat ja vuorovaikutuksen ulottuvuudet
#”HF ”#:llä, joka on lineaarinen molekyyli, on havaittu olevan siksakmaisia vetysidosvuorovaikutuksia, kahdessa ulottuvuudessa, kulmien ollessa #116^@#. Optimaalisempi kulma olisi #180^@#, koska se antaisi suorempia dipolivuorovaikutuksia. Tämä rajoittaa #”HF ”#:n vetysidosten voimakkuutta.
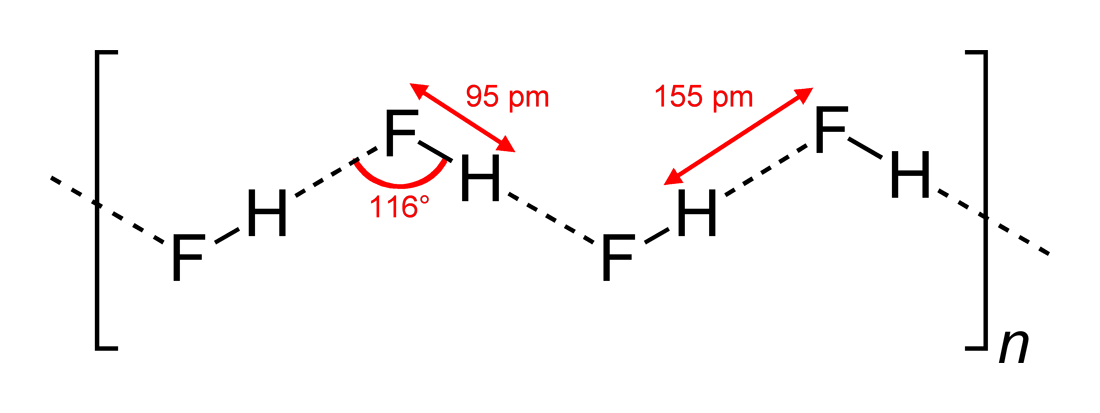
Vesi, joka on taivutettu molekyyli, jolla on tetraedrinen elektronigeometria, pystyy vetysidoksiin kolmessa ulottuvuudessa.
Tässä on esimerkki vedynsidosvuorovaikutuksen paikallisesta ympäristöstä löytyvästä tetraedrisestä klusterista vedessä:
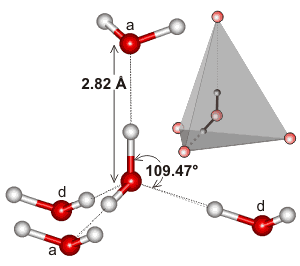
Voi olla, että vedynsidosverkoston laajuus ja se, miten se pyrkii vastaamaan veden elektronigeometriaa, tekee veden kiehumispisteestä niin korkean. Tämä tukisi veden korkeampaa kiehumispistettä kuin #”HF ”#.
Kokonaisuutena nämä ovat vähiten haastavia tekijöitä, joita keksin:
- Vesi voi muodostaa tasapainoisemman vetysidosverkoston (kaksi akseptoria ja kaksi donoria yhden donorin ja kolmen akseptorin sijasta), mikä tekee irtosysteemistä tasaisemmin vuorovaikuttavan ja siten vahvemman kokonaisuutena.
- Vesi muodostaa laajemman vetysidosverkoston (kolmiulotteinen tetraedrinen paikallinen ympäristö kaksiulotteisen siksak-ympäristön sijaan), jolloin bulkkisysteemi höyrystyy huonommin.
- Vedellä on yleensä optimaalisempi vuorovaikutuskulma, koska se vastaa paremmin molekyylin elektronigeometriaa ja kohdistaa vuorovaikutukset molekyylin dipolin suuntaisesti, kun taas #”HF ”#:llä olisi voimakkaampi vetysidos (raakalukuina ilmaistuna), jos vuorovaikutukset olisivat lineaarisia.
Leave a Reply