Mikä on elektronegatiivisuus?
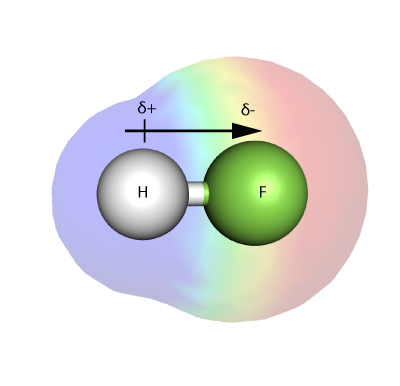
ELEKTRONEGATIIVISUUS
Elektronegatiivisuus on mitta, jolla mitataan sitä, kuinka voimakkaasti atomi – molekyylissä – kykenee vetämään sidoksessa olevia elektroneja puoleensa.
Elektronegatiivisuuteen vaikuttavat tekijät:
1) Atomiluku
Atomiluku on protonien lukumäärä atomin ytimessä.
Se määrää alkuaineen kemialliset ominaisuudet ja paikan jaksollisessa järjestelmässä.
Mitä korkeampi atomiluku, sitä voimakkaampi elektronegatiivisuus.
2) Atomisäde
Kemiallisen alkuaineen atomisäde mitataan yleensä etäisyydellä ytimen keskipisteen ja uloimman elektronikerroksen rajan välisestä etäisyydestä.
Mitä suuremmat atomisäteet, sitä heikompi elektronegatiivisuus.
Esimerkki happiatomin atomisäteestä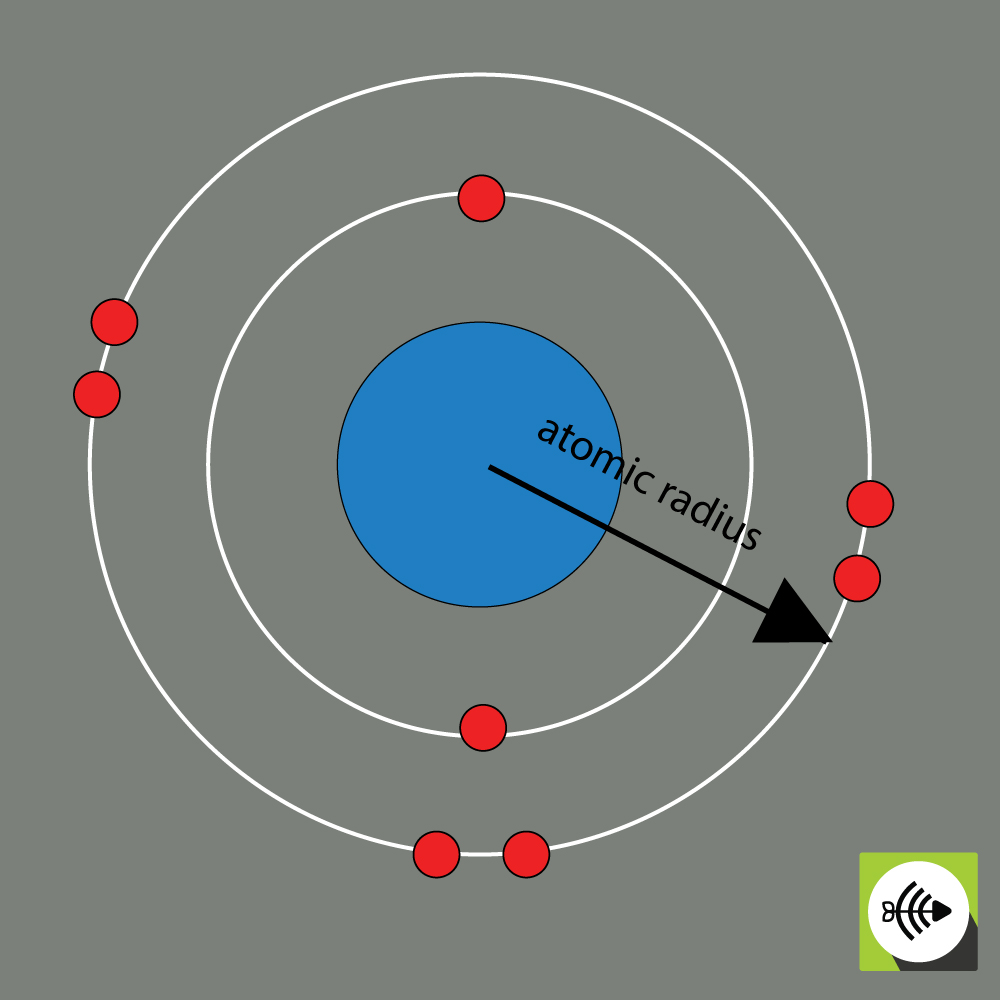
Millä mitataan elektronegatiivisuutta?
Elektronegatiivisuuden yleisin mittaustapa on Paulingin asteikko, jonka on suunnitellut kaksinkertainen Nobel-palkittu Linus Pauling. Alkuaineiden elektronegatiivisuusasteikko kertoo, kuinka voimakkaasti kukin alkuaine (suhteessa toisiinsa) pystyy vetämään sidoselektroneita puoleensa. Mitä korkeampi elektronegatiivisuusluku on, sitä enemmän atomi pyrkii vetämään elektroneja puoleensa.
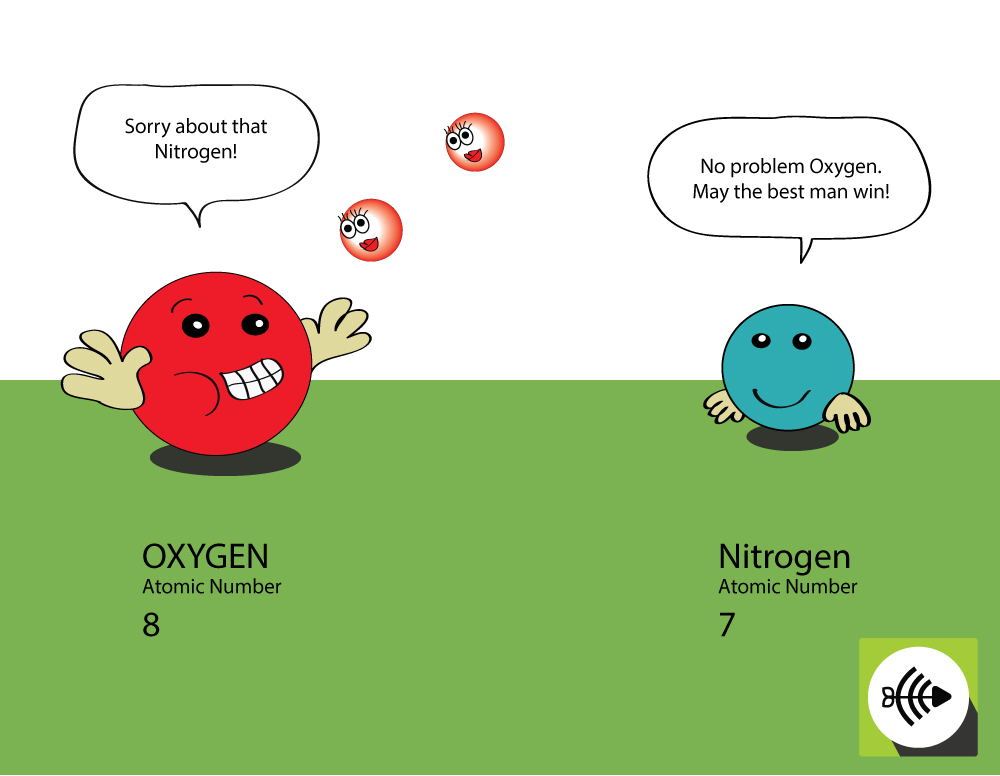
Miksi happi on elektronegatiivisempi kuin typpi?
Hapella on korkeampi järjestysluku
- Hapella on kahdeksan protonia ytimessä, kun taas typellä on vain seitsemän.
- Sidoselektronipari kokee enemmän vetovoimaa hapen ytimestä kuin typen ytimestä, joten hapen elektronegatiivisuus on suurempi.
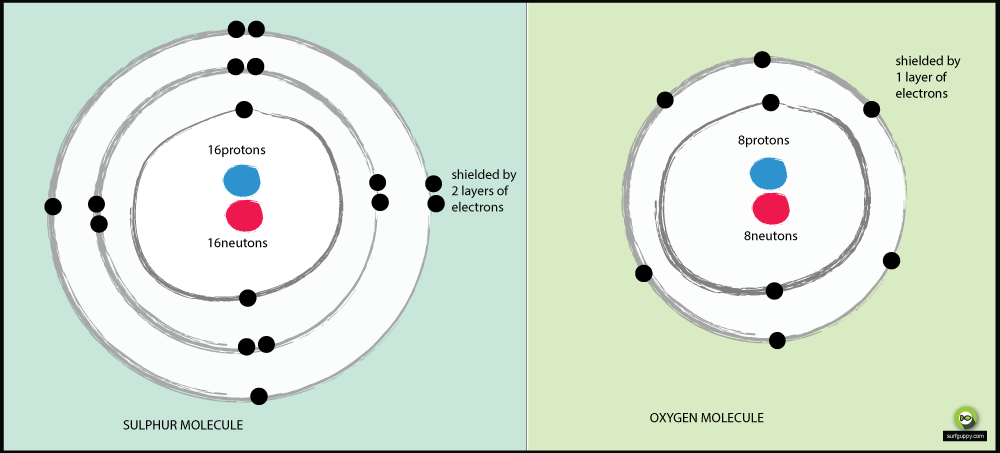
Miksi rikki on vähemmän elektronegatiivinen kuin happi?
Syitä, miksi happi on elektronegatiivisempi kuin rikki:
- Hapella on 2 energiatasoa, rikillä 3
- Rikin sidoselektronit ovat kauempana atomin ytimestä
- Kun sidoselektronit ovat kauempana atomin ytimestä, on vähemmän vetovoimaa ytimestä
- Hapen sidoselektronipari kokee enemmän vetovoimaa ytimestä kuin rikin sidoselektronit
- Happi on siis elektronegatiivisempi atomi
Lue lisää valenssielektroneista ennen kuin jatkat. Valenssielektronit

Pienemmällä atomilla on suurempi elektronegatiivisuus
Elektronegatiivisuussuuntaukset esiintyvät jaksollisessa järjestelmässä
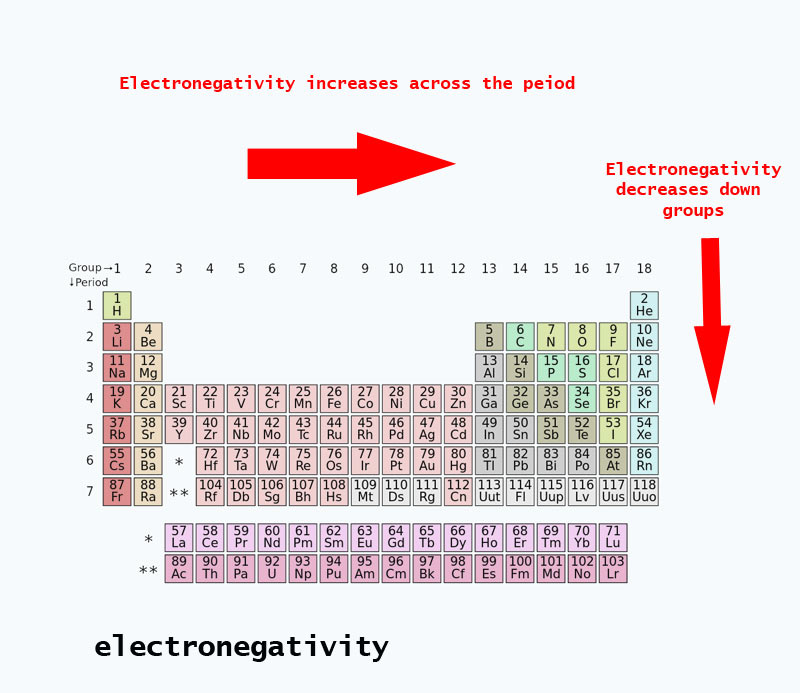
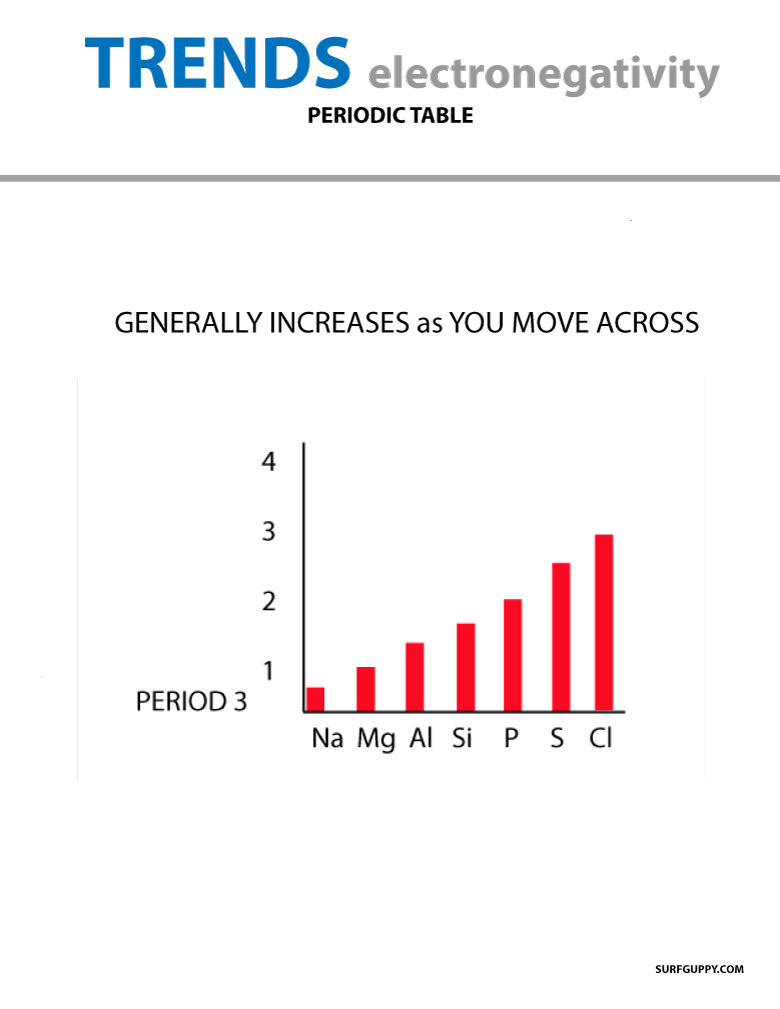
Kun siirryt jaksollisessa järjestelmässä, protonien määrä ytimessä kasvaa (energiatason ei noustessa), joten elektronegatiivisuus kasvaa.
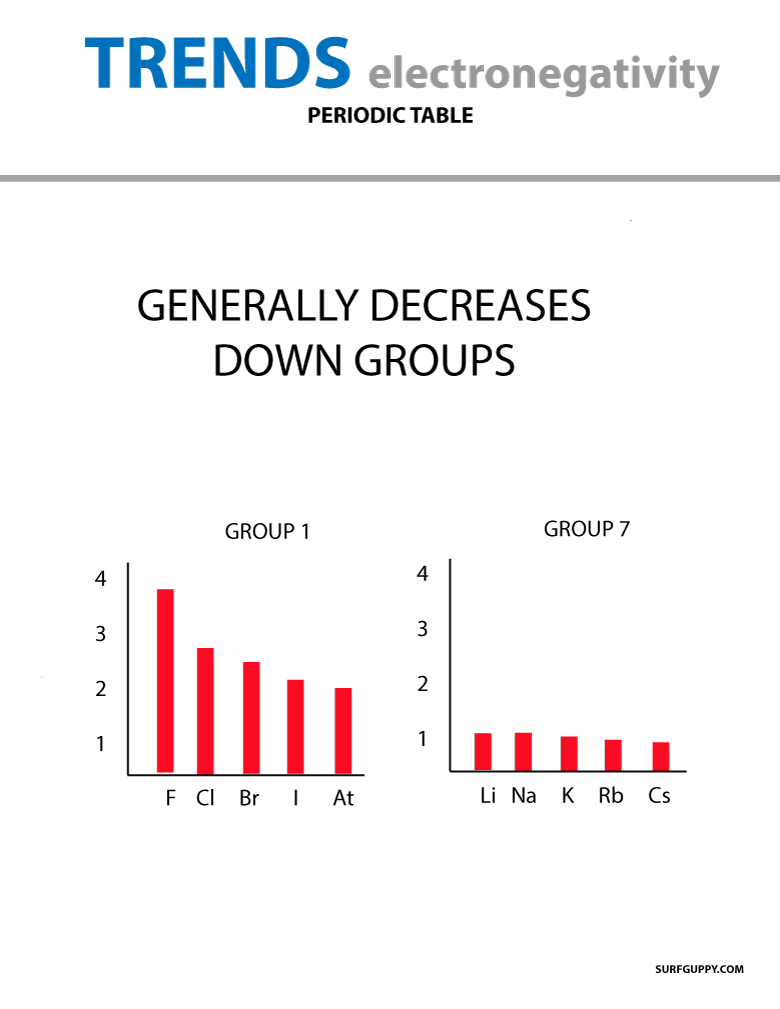
Kun atomiluku nousee ryhmässä alaspäin, myös energiatasot nousevat. Atomisäde on suurempi, joten elektronegatiivisuus pienenee.
PERJODISESSA TAULUKOSSA ELEKTRONEGATIIVISUUDEN KAAVIOINTI
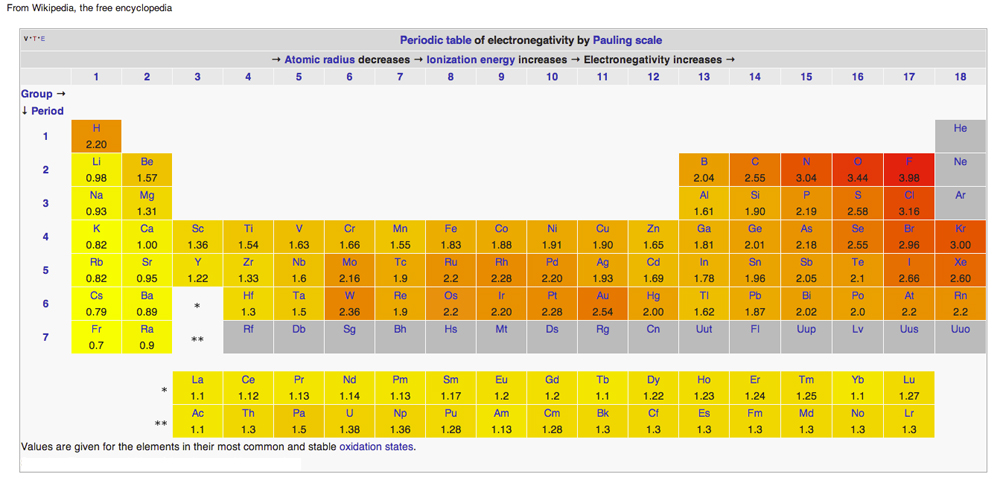 Kaavio Wikipedian julkaisemana luovutusperiaatteella luovuttamalla yhteisellä käyttölisenssillä
Kaavio Wikipedian julkaisemana luovutusperiaatteella luovuttamalla yhteisellä käyttölisenssillä
.
Leave a Reply