Itsetuhoutuvat hyttyset ja steriloidut jyrsijät: lupaus geeniajoista
Austin Burt ja Andrea Crisanti olivat yrittäneet kahdeksan vuoden ajan kaapata hyttysen genomin. He halusivat ohittaa luonnonvalinnan ja liittää siihen geenin, joka sienestyisi populaatiossa nopeammin kuin tavanomaisen periytymisprosessin kautta periytyvä mutaatio. Heidän takaraivossaan oli keino ehkäistä malariaa levittämällä geeniä, joka tyrmäisi hyttyspopulaatiot niin, etteivät ne voisi levittää tautia.
Crisanti muistaa epäonnistuneensa kerta toisensa jälkeen. Lopulta vuonna 2011 Lontoon Imperial Collegessa työskentelevät genetiikan tutkijat saivat toivomansa DNA-tulokset: hyttysen perimään lisätty geeni oli levinnyt populaation läpi ja saavuttanut yli 85 prosenttia hyönteisten jälkeläisistä1.
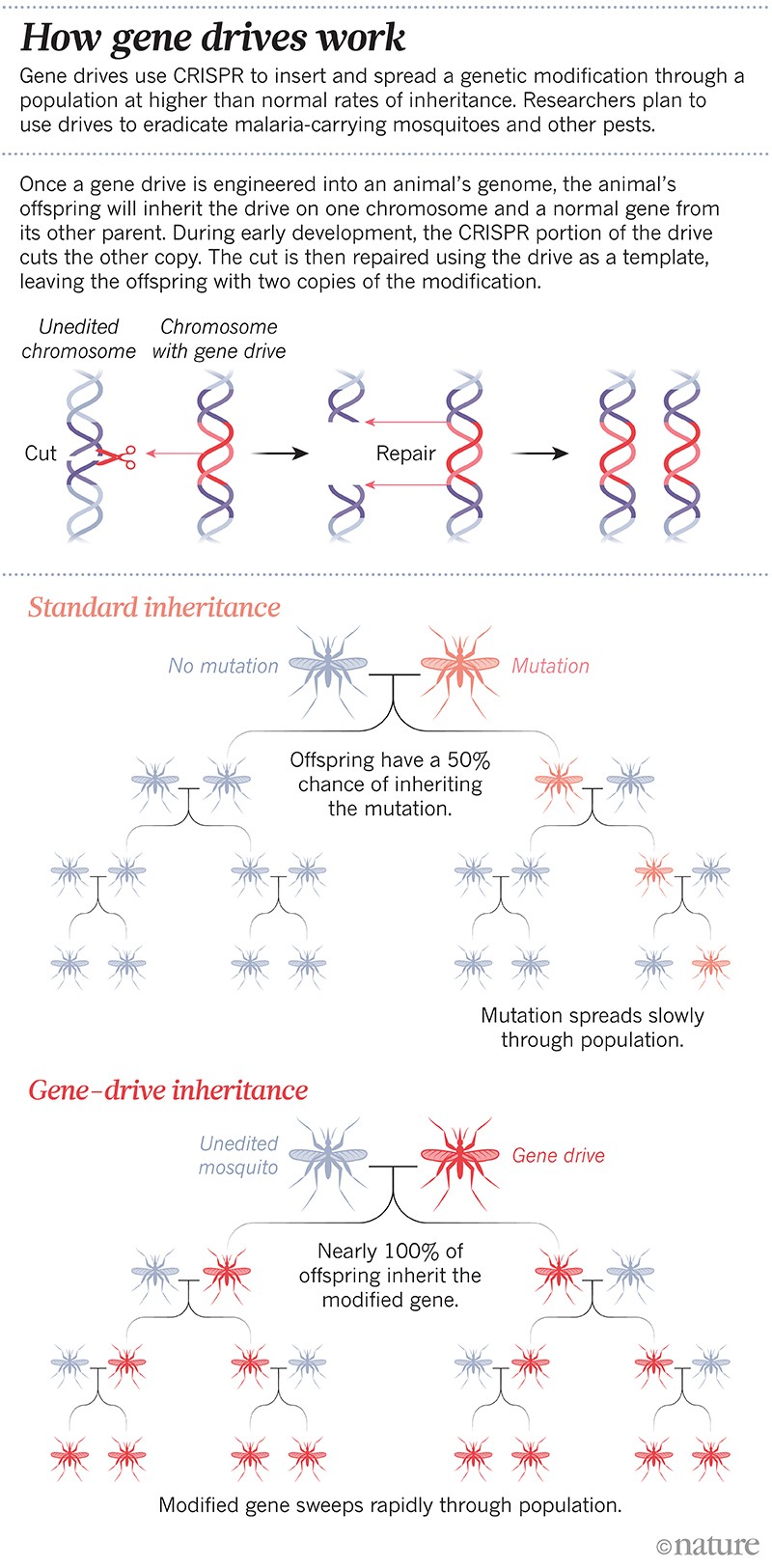
Se oli ensimmäinen keinotekoinen ”geeniajo”: geneettinen muutos, joka on suunniteltu leviämään populaatiossa normaalia nopeammin. Geeniajoista on tullut nopeasti rutiinitekniikka joissakin laboratorioissa; tutkijat voivat nyt valmistaa geeniajon muutamassa kuukaudessa. Tekniikka perustuu geeninmuokkaustyökaluun CRISPR ja joihinkin RNA:n palasiin, joiden avulla tiettyä geeniä voidaan muuttaa tai hiljentää tai lisätä uusi geeni. Seuraavassa sukupolvessa koko ajuri kopioituu kumppanikromosomiinsa niin, että genomissa ei enää ole valitun geenin luonnollista versiota, vaan kaksi kopiota ajurista. Näin muutos periytyy jopa 100 prosenttiin jälkeläisistä noin 50 prosentin sijasta (ks. ”Miten geeniajurit toimivat”).
Vuoden 2014 jälkeen tutkijat ovat kehittäneet CRISPR-pohjaisia geeniajurijärjestelmiä hyttysissä, hedelmäkärpäsissä ja sienissä ja kehittävät niitä parhaillaan hiirissä. Mutta se on vasta tarinan alkua. Kysymykset siitä, onko geeniajo mahdollista, ovat korvautuneet muilla tuntemattomilla kysymyksillä: kuinka hyvin ne toimivat, miten niitä testataan ja kenen pitäisi säännellä teknologiaa. Geeniajoja on ehdotettu keinoksi vähentää tai poistaa hyönteisten levittämiä tauteja, valvoa vieraslajeja ja jopa kumota tuholaisten hyönteismyrkkyjen vastustuskyky. Yhtään muokattua geeniajoa ei ole vielä päästetty luontoon, mutta periaatteessa teknologia voisi olla valmis jo kolmen vuoden kuluttua, Crisanti sanoo. Hän tekee yhteistyötä Target Malarian kanssa, joka on voittoa tavoittelematon kansainvälinen tutkimuskonsortio, joka pyrkii käyttämään geeniohjattuja hyttysiä malarian torjuntaan Afrikassa. Ryhmä vapautti 1. heinäkuuta koe-erän hyttysiä – geneettisesti muokattuja, mutta ei vielä geeniajureilla varustettuja – eräässä kylässä Burkina Fasossa.
Geeniajurit poikkeavat kaikista aiemmin testatuista ekologisista korjaustoimenpiteistä, sanoo Tansanian Dar es Salaamissa sijaitsevan Ifakara-terveysinstituutin (Ifakara Health Institute, Dar es Salaam, Tansania) tiedejohtaja Fredros Okumu. ”Geeniajurit leviävät itsestään”, hän sanoo. ”Meidän on valmisteltava ihmisiä ja jaettava tietoa avoimesti kaikkien asianomaisten maiden kanssa.”
Tekniset haasteet eivät ole yhtä pelottavia kuin sosiaaliset ja diplomaattiset, sanoo Massachusetts Institute of Technologyn (MIT) medialaboratoriossa Cambridgessa työskentelevä bioinsinööri Kevin Esvelt, joka oli ensimmäisten joukossa rakentamassa CRISPR-pohjaista geeniajuria. ”Tällaisilla teknologioilla on reaalimaailman seurauksia ihmisten elämään, jotka voivat olla lähes välittömiä.”
Geeniajureihin liittyvien mahdollisten huolenaiheiden vuoksi Nature tarkastelee viittä keskeistä kysymystä teknologiasta ja sen sovelluksista.
Toimivatko geeniajurit edes?
Geeniajurin rakentaminen populaation manipuloimiseksi tai hävittämiseksi on kuin ryhtyisi taisteluun luonnonvalinnan kanssa, eikä tätä taistelua välttämättä ole helppo voittaa.
Heti kun tutkijat alkoivat tehdä geeniajureita säännöllisesti laboratorioissa, eläimet kehittivät vastustuskykyä niitä vastaan – kerryttivät mutaatioita, jotka estivät ajureiden leviämisen. Esimerkiksi testeissä, joissa testattiin kahta hedelmäkärpäsiin lisättyä ajuria, muodostui usein resistenssiä aiheuttavia geenimuunnoksia2. Yleisimmin mutaatiot muuttavat sekvenssiä, jonka CRISPR on asetettu tunnistamaan, ja estävät geenin muokkaamisen. Crisanti ja Target Malaria -hankkeen tutkija Tony Nolan seurasivat häkkihyttysillä tehdyissä kokeissa, kuinka geeniajurin taajuus vähitellen väheni useiden sukupolvien ajan kohdegeenin resistenttien mutaatioiden vuoksi3. Tulokset järisyttivät alaa. Tekisikö resistenssi geeniajoista voimattomia?
Ei välttämättä – jos tutkijat valitsevat oikean kohteen. Jotkin geenit ovat hyvin konservoituneita, mikä tarkoittaa, että mikä tahansa muutos todennäköisesti tappaa niiden omistajat. Näiden geenien valitseminen ajokohteeksi merkitsee vähemmän mutaatioita ja vähemmän resistenssiä. Syyskuussa 2018 Crisanti ja hänen työryhmänsä tuhosivat häkissä olevien Anopheles gambiae -hyttysten populaation 100-prosenttisella tehokkuudella4 tekemällä taajuusmuuttajan, joka häiritsee hedelmällisyysgeeniä nimeltä doublesex. Kun ajuri on käytössä, naaraspuoliset hyttyset eivät pysty puremaan eivätkä munimaan. 8-12 sukupolven kuluessa häkkipopulaatiot eivät tuottaneet lainkaan munia. Koska doublesex on elintärkeä lisääntymiselle, se on vastustuskykyinen mutaatioille, mukaan lukien mutaatioille, jotka antaisivat vastustuskyvyn asemakonstruktiolle.
Ryhmä on tehnyt yhdeksän häkkikokeilua, joissa on tehty yli miljoona asemansiirtoa, jotka kohdistuvat doublesexiin, eikä se ole havainnut minkäänlaista vastustuskykyä, Crisanti sanoo. Nyt tiimi mukauttaa ajoa leikkaamaan doublesex-geenistä ei yhtä vaan kahta lokusta, ikään kuin sairautta hoidettaisiin lääkkeiden yhdistelmällä. ”Haluan varmistaa, että resistenssin kehittymisen todennäköisyys on hyvin, hyvin pieni, ennen kuin sanon, että teknologia on valmis kenttäkäyttöön”, Crisanti sanoo.
Nisäkkäillä tutkijoilla on nisäkkäiden kohdalla paljon perustavanlaatuisempia haasteita kuin resistenssi. Viime vuonna Kim Cooper ja hänen kollegansa Kalifornian yliopistossa San Diegossa (UCSD) kehittelivät nisäkkäissä geeniajurin alkeet – ajurin, joka keskeyttää hiiren geenin, Tyrin, ja muuttaa eläinten turkin valkoiseksi5. Ajuri kopioi itseään genomiin vain 72-prosenttisesti, eikä se toiminut hyvin uroksen sukusoluissa, Cooper kertoo. Hän epäilee tämän johtuvan siitä, että solunjakautuminen tapahtuu eri aikaan munasolujen ja siittiöiden muodostumisessa, mikä näyttää vaikuttavan ajurin kykyyn kopioitua onnistuneesti kromosomista toiseen.
Tässä kokeessa ajuri ei lisääntynyt itsestään eikä Cooper seurannut ominaisuutta useiden sukupolvien ajan, joten hän korostaa, että sitä ei teknisesti voida pitää geeniajurina. ”On vielä niin paljon tehtävää, jotta voidaan osoittaa, että jotain tällaista on edes mahdollista toteuttaa”, hän lisää.
Mihin muuhun geeniajurit sopivat?
Vaikka hyttyssovellukset hallitsevat alaa, geeniajureiden ehdotettuihin käyttötarkoituksiin kuuluvat myös herkkien ekosysteemien säilyttäminen ja laboratoriotyön nopeuttaminen.
Joidenkin organismien genomia on haastavaa manipuloida, mutta sen tekeminen saattaisi kuitenkin auttaa tutkijoita tutkimaan niitä. Otetaan esimerkiksi Candida albicans, usein lääkkeille vastustuskykyinen ihmisen sienipatogeeni. Massachusettsin Cambridgessa sijaitsevan Broad-instituutin ja MIT:n postdoc-tutkijana Rebecca Shapiro kehitti järjestelmän6 , jolla sieneen voidaan ajaa mutaatioita lähes 100-prosenttisella tehokkuudella. Hän voi nyt kasvattaa sieniä hiljentämään kaksi toisistaan riippumatonta geeniä ja periyttää nämä mutaatiot jälkeläisille. ”Se toimii mielettömän tehokkaasti”, sanoo Shapiro, joka työskentelee nyt Guelphin yliopistossa Kanadassa. UCSD:ssä Cooper käyttää geeniajureita samanlaiseen tarkoitukseen, monimutkaisten ominaisuuksien luomiseen ja tutkimiseen hiirissä.
Genetic Biocontrol of Invasive Rodents (GBIRd) -ohjelma haluaa tehdä geeniajurihiirillä muutakin kuin tutkia niitä laboratoriossa. GBIRd, joka on yliopistojen, hallitusten ja kansalaisjärjestöjen kumppanuus, jota hallinnoi voittoa tavoittelematon Island Conservation -ryhmä, haluaa käyttää teknologiaa vieraslajien jyrsijöiden hävittämiseen saarilta, joilla ne aiheuttavat tuhoa alkuperäiselle villieläimistölle. Tähän tarkoitukseen käytetään nykyisin torjunta-aineita, mutta ne ovat kalliita ja vaikeita käyttää suuremmilla saarilla, joilla on ihmisasutusta. Ne ovat käyttökelpoisia vain noin 15 prosentilla saarista, sanoo GBIRd-ohjelman johtaja Royden Saah. ”Yritämme etsiä tekniikoita, jotka hoitaisivat loput 85 prosenttia.”
GBIRd:n jäsenet David Threadgill Texas A&M Universityssä College Stationissa ja Paul Thomas Adelaiden yliopistossa Australiassa kehittävät hiirille geeninohjaustekniikoita, vaikka Saah arvioi, että menee useita vuosia, ennen kuin tällaiset ohjaimet toimivat menestyksekkäästi.
Jotkut hyttystutkijat toivovat kokeilevansa tautien ehkäisyyn jotakin hienovaraisempaa kuin hyönteispopulaatioiden täydellistä hävittämistä. Toukokuussa julkaistussa esipainoksessa7 Omar Akbari ja hänen kollegansa UCSD:ssä muokkasivat Aedes aegypti -hyttysiä ilmentämään vasta-ainetta, joka suojasi hyönteisiä kaikkia neljää tärkeintä denguekantaa vastaan. Nyt he liittävät tämän vasta-aineen asemaan nähdäkseen, leviääkö se. Akbari rakentaa myös yleiskäyttöistä geeniajoa, joka aktivoi toksiinin, kun mikä tahansa virus, ei vain denguevirus, tarttuu A. aegypti -lajiin. ”Haluamme rakentaa hyttysen Troijan hevosen”, Akbari sanoo. ”Kun hyttynen saa virustartunnan – oli se sitten denguevirus, zikavirus, chikungunya-virus, keltakuume tai mikä tahansa – se aktivoi järjestelmämme, joka tappaa hyttysen.”
Voidaanko geeniajureita kontrolloida?
Voitko hallita geeniajureita?
Ennen kuin Kevin Esvelt ehti koskaan rakentaa ainoatakaan CRISPR-pohjaista geeniajuria, hän heräsi kylmään hikeen miettimään seurauksia. ”Tajusin, että hei, tämä ei koske vain malariaa, vaan tämä on potentiaalisesti jotain sellaista, jonka kuka tahansa, joka pystyy tekemään siirtogeenisen hedelmäkärpäsen, voisi rakentaa muokkaamaan kaikkia hedelmäkärpäsiä.”
Ei siis ole yllätys, että kun Esvelt ja geneetikko George Church rakensivat vuonna 2014 ensimmäisen geeniajurinsa Harvardin lääketieteellisessä tiedekunnassa Bostonissa, Massachusettsissa, he rakensivat samalla peruutusajurin, jolla alkuperäinen ajuri voitiin käskystä korvata.
Muu osa alasta on seurannut esimerkkiä kehittäen geeniajureita, joissa on sisäänrakennetut kontrollit, ulkoiset ohitukset tai molemmat. Suurimman osan näistä ponnisteluista rahoittaa Yhdysvaltain puolustusministeriön tutkimusosasto DARPA (Defense Advanced Research Projects Agency). Vuonna 2017 DARPAn Safe Genes -ohjelma ilmoitti käyttävänsä 65 miljoonaa Yhdysvaltain dollaria seitsemään yhdysvaltalaiseen tutkimusryhmään, jotka tutkivat, miten geeniajureita voidaan hallita, torjua ja peruuttaa. ”Vähennämme väärinkäytön mahdollisuuksia, olivatpa ne sitten tahattomia tai häijyjä”, sanoo Safe Genes -ohjelman johtaja Renee Wegrzyn.
Esvelt, joka sai rahoitusta ohjelman alkuvaiheessa, kehitti itsestään tyhjentyvän aseman, joka tunnetaan nimellä daisy drive. Ajuri on suunniteltu niin, että se menettää lenkki kerrallaan, ikään kuin nyppisi yhden kukan ketjusta, joka on kytketty päästä varteen, kunnes se loppuu useiden sukupolvien aikana.
UCSD:ssä Akbarin DARPA-rahoitteinen työryhmä kehittää geeniajureita, joiden ei pitäisi pystyä leviämään muualle kuin kohdepopulaatioon kuuluviin hyttysiin tai kärpäsiin. Yksi tällainen ajuri vaatii jatkuvaa levittämistä useiden sukupolvien ajan. Kun vapautukset loppuvat, se laimenee geenin villityyppisillä versioilla ja häviää neljässä vuodessa. Akbari sanoo, että tämä saattaa olla tarpeeksi pitkä aika zika- tai dengueviruksen kaltaisen viruksen hävittämiseen hyttyspopulaatiosta. ”Se on mielestäni hieman turvallisempaa ja silti melko tehokasta”. Ryhmä on jo tuottanut useita versioita näistä ajureista A. aegypti -bakteerille, joka on dengueviruksen päävektori10.
Target Malaria -ryhmä kehittää myös DARPA:n rahoittamaa vastatoimenpidettä, jolla voidaan pysäyttää doublesex-ajurin leviäminen populaatiossa.
Miten geeniajureita voidaan kokeilla?
Kenttäkokeen sijasta – jonka DARPA:n Safe Genes -sopimus nimenomaisesti kieltää ja johon tutkijat ovat yhtä mieltä siitä, että teknologia ei ole vielä valmis – tiimit laajentavat häkkikokeita ja rakentavat ekologisia malleja tutkiakseen turvallisesti luonnonvaraiseen ympäristöön vapautumisen hyötyjä ja riskejä.
Ternin kaupungissa Keski-Italiassa Crisanti ja Nolan ovat rikastuttaneet hyttyshäkkejään muuttuvilla ympäristöoloilla. ”Haluamme laajentaa sitä, jotta voimme testata sitä erilaisilla geneettisillä taustoilla realistisemmissa skenaarioissa”, sanoo Nolan, joka nykyään johtaa laboratoriota Liverpool School of Tropical Medicinessä Yhdistyneessä kuningaskunnassa. Hän ja Crisanti haluavat jäljitellä luonnollista pariutumiskäyttäytymistä – kuten urosten muodostamia parvia houkutellakseen naaraita – nähdäkseen, miten se vaikuttaa geenipaketin leviämiseen.
Paketin leviämisen dynamiikka näissä häkeissä on toistaiseksi ”lupaavaa”, sanoo Crisanti – paketti siirtyy tehokkaasti eteenpäin ilman merkkejä vastustuksesta. Jos laajemmissa häkkikokeissa ei ilmene huolenaiheita, ryhmä luovuttaa tekniikan riippumattomille ryhmille testattavaksi, jotta se saisi viranomaishyväksynnän noin kolmen vuoden kuluttua, hän sanoo.
Target Malaria -ryhmä rakentaa myös ekologisia malleja mahdollisista levityspaikoista selvittääkseen dynamiikkaa paikan päällä. Tuoreimmassa tutkimuksessa11 mallinnetaan hyttyspopulaatioita yli 40 000 asuinalueella Burkina Fasossa ja sitä ympäröivissä maissa. Siinä otetaan huomioon joet, järvet ja sateet sekä kenttätiedot hyttysten liikkumisesta. Tulokset11 osoittavat, että hyönteisten kokonaismäärän vähentämiseksi tarvitaan hyönteisten toistuvaa levittämistä muutettujen hyttysten käyttöön muutamien vuosien aikana eri kylien välillä, eikä yhtä ainoaa levittämistä.
”Teorian mukaan jos hyttyset levittäisi kerran, ne periaatteessa leviäisivät koko mantereen laajuisesti. Todellisuudessa se tapahtuisi hyvin hitaasti”, sanoo populaatiobiologi Charles Godfray Oxfordin yliopistosta, Yhdistyneestä kuningaskunnasta, Target Malaria -hankkeen yhteistyökumppani ja tutkimuksen johtava tutkija.
Toinen huolenaihe on se, että geeniajurit voivat muuttaa kokonaisia populaatioita ja siten kokonaisia ekosysteemejä. Ne voisivat teoriassa vaikuttaa kielteisesti myös ihmisten terveyteen aiheuttamalla malariaparasiitin kehittymisen entistä virulentimmaksi tai toisen isännän kantajaksi, sanoo molekyylibiologi ja bioeetikko Natalie Kofler. Hän on perustajajohtaja Yalen yliopistossa New Havenissa, Connecticutissa sijaitsevassa Yalen yliopistossa toimivassa Editing Nature -ryhmässä, jonka tavoitteena on käsitellä ympäristögeeniteknologiaa maailmanlaajuisesti. ”Tällä teknologialla on potentiaalia olla valtavan voimakas ja muuttaa asioiden kulkua tavalla, jota emme ehkä pysty ennustamaan”, Kofler sanoo.
Kuka päättää, milloin geeniajuria käytetään?
Lääkekokeissa yritys voi aloittaa kenttäkokeen valmistelun jo vuotta tai kahta aikaisemmin. Geeniajoihin tarvitaan enemmän aikaa, Okumu sanoo. Viime vuonna hän kuului Kansallisten terveysinstituuttien säätiön järjestämään 15-jäseniseen tieteelliseen työryhmään, joka esitti joukon suosituksia12 geeniohjattujen hyttysten käytöstä Saharan eteläpuolisessa Afrikassa.
Raportissa korostetaan, että hallitukset, yhteisöt ja paikalliset tiedemiehet tarvitsevat aikaa omaksuakseen tieteen ja saadakseen valtuudet säännellä teknologiaa. ”Sanon tämän täysin vakuuttuneena – loppujen lopuksi parhaat ihmiset tekemään nämä päätökset ovat maat itse”, Okumu sanoo.
Vuonna 2017 Kofler kokosi ryhmän tiedemiehiä ja eetikkoja pohtimaan geeniohjauksiin liittyviä yhteiskunnallisia kysymyksiä13. ”Tärkeimmät kysymykset keskittyvät oikeudenmukaisuuteen”, Kofler sanoo. Keskusteluissa, jotka koskevat geenimanipuloidun organismin vapauttamista afrikkalaiseen ympäristöön, historiallisesti syrjäytyneillä ryhmillä on hänen mukaansa oikeus osallistua päätöksentekoprosessiin.
Okumu haluaa, että afrikkalaiset tiedemiehet kehittäisivät ja testaisivat geenivetoteknologiaa paikallisesti, mikä edellyttää rahoittajilta kunnioitusta ja halukkuutta tukea tällaisia pyrkimyksiä. ”Ihmiset pelkäävät tuntematonta, ja tuntematon esitetään juuri nyt länsimaisesta näkökulmasta”, Okumu sanoo. ”Odotan innolla sitä päivää, jolloin voimme rakentaa näitä konstruktioita omissa laboratorioissamme ja näin rakentaa paikallista luottamusta.”
Elokuussa 2018 Burkina Fason kansallinen bioturvallisuusvirasto antoi Target Malaria -organisaatiolle luvan vapauttaa geenimuunnellun steriilin uroshyttysen kannan, joka on ensimmäinen laatuaan Afrikan mantereella. Viime viikolla ryhmä vapautti noin 6400 hyttystä, jotka on geenimuunneltu, mutta joissa ei ole geeniohjaimia. Tutkijat toivovat, että vapauttaminen parantaa tutkimuksen tunnettuutta ja antaa tietoa tulevia vapauttamisia varten.
Ja vaikka geenimuunnellut hiiret eivät ole vielä läheskään valmiita vapautettaviksi, GBIRd tekee jo yhteistyötä riskinarvioijien, eetikoiden ja ekologien kanssa löytääkseen saaren ensimmäiselle kenttäkokeelle. ”Haluamme varmistaa, että tämä onnistuu oikein”, Saah sanoo. ”Riippumatta siitä, miten nopeasti teknologia etenee, voimme edistää yhteiskuntatieteitä ja etiikkaa nyt.”
Leave a Reply