Frontiers in Pharmacology
Introduction
Yleisimpään dementiatyyppiin, Alzheimerin tautiin (Alzheimerin tauti, AD), liittyy kognitiivisten toimintojen krooninen heikkeneminen, ja sen osuus dementiatapauksista on 60-70 % (Fan ja Chiu, 2014; Lu et al., 2018). Vuonna 2014 tehdyn katsauksen mukaan noin 35,6 miljoonaa ihmistä sairastaa tällä hetkellä Alzheimerin tautia, ja Alzheimerin taudin esiintyvyys lisääntyy asteittain iän myötä, ja se koskee noin 115,4 miljoonaa ihmistä vuoteen 2050 mennessä maailmanlaajuisesti (Fan ja Chiu, 2014). On yleisesti hyväksytty, että AD on monimutkainen neurodegeneratiivinen sairaus, jossa on useita patologioita, jotka liittyvät pääasiassa kolinergisen siirron rappeutumiseen, oksidatiiviseen stressiin, neuroinflammaatioon ja niin edelleen (Coyle et al., 1983; Aucoin et al., 2005; Lin ja Beal, 2006; Verri et al., 2012; Heneka et al., 2015; Bassani et al., 2017). Asetyylikoliiniesteraasin (AChE) estäjiä, kuten donepetsiiliä, rivastigmiiniä ja galantamiinia, määrätään ensisijaisesti Alzheimerin taudin kliiniseen hoitoon alkuvaiheessa (Kwon ym., 2010; Rijpma ym., 2014; Kumar ja Singh, 2015). Lisäksi antioksidantteja ja tulehduskipulääkkeitä käytetään sananmukaisesti AD:n liitännäishoidossa (Zhou ym., 2016; Demirci ym., 2017). Kaikkien näiden aineiden teho on kuitenkin rajallinen, koska ne menettävät tehonsa vähitellen taudin edetessä, ja lääkkeisiin liittyy myös monia toksisia sivuvaikutuksia (Zhou ym., 2016; Jeon ym., 2017; Lu ym., 2018). Tällä hetkellä ei nimittäin ole saatavilla tyydyttävää hoitoa AD:n parantamiseksi tai sen etenevän kulun muuttamiseksi.
Harmaliini (HAL) ja harmiini (HAR) ovat Peganum harmala L:n runsaita farmakologisia β-karboliinialkaloideja, joilla on samankaltaiset kemialliset rakenteet (Li et al., 2017b). Niillä on merkittävä AChE: n, monoamiinioksidaasin (MAO) ja myeloperoksidaasin (MPO) estävä vaikutus, antioksidanttinen, anti-inflammatorinen, kasvainten vastainen ja verenpainetaudin vastainen vaikutus, ja ne voivat myös vaikuttaa erilaisten välittäjäaineiden sisältöihin, jolloin ne voivat johtaa biokemiallisiin, fysiologisiin ja käyttäytymismuutoksiin eläimillä ja ihmisillä (Mahmoudian et ai.., 2002; Frison et al., 2008; Jiménez et al., 2008; Herraiz et al., 2010; Louis et al., 2010; Bensalem et al., 2014; Wang et al., 2015; Li et al., 2017a). Aiempien tutkimustemme mukaan HAL ja HAR osoittivat samanlaista AChE:n estoa verrattuna galantamiiniin in vitro (Zhao et al., 2013). Lisäksi P. harmalan kokonaisalkaloidit (28 mg/kg), jotka sisältävät pääasiassa HAL:a ja HAR:a, osoittivat parantavaa vaikutusta skopolamiinin ja 30-prosenttisen etanolin aiheuttamiin oppimisen ja muistin puutoksiin (He et al., 2015b). Myöhemmin He et al. (2015a) tutkimus vahvisti edelleen, että HAR (20 mg/kg) voisi parantaa skopolamiinin indusoimien hiirten heikentynyttä muistia parantamalla kolinergisiä toimintoja AChE:n estämisen kautta. Viimeisimmät tutkimukset kuitenkin osoittivat, että HAR ei ollut ainoastaan monilääkeresistenssiin liittyvän proteiinin isomuodon 2 (MRP2) substraatti, vaan sillä oli myös heikko metabolinen stabiilisuus, ja se johti lopulta huomattavasti alhaisempaan biologiseen hyötyosuuteen kuin HAL eri eläimillä (Li et al., 2017b). Näin ollen on spekuloitu, että HAL:n tehokas annos AD:tä vastaan voi olla paljon pienempi kuin HAR:n. Siksi olisi suoritettava järjestelmällinen vertailututkimus näiden kahden analogin muistinvastaisista vaikutuksista ja mekanismeista, jotta etsitään suositeltavampi ehdokasyhdiste AD-hoitoa varten.
Tässä tutkimuksessa verrattiin HAL:n ja HAR:n moduloivia vaikutuksia skopolamiinin aiheuttamiin muistihäiriöihin käyttämällä käyttäytymisarviointia Morrisin vesilabyrintissä (MWM). MWM:ää on käytetty laajasti avaruudellisen oppimisen ja muistin neurobiologian ja neurofarmakologian tutkimuksessa, ja sillä on tärkeä rooli neurokognitiivisten häiriöiden, kuten Alzheimerin taudin kaltaisten neurologisten häiriöiden jyrsijämallien validoinnissa (Bromley-Brits et ai., 2011). Lisäksi suoritettiin kattavasti biokemialliset määritykset, western blotting -analyysi sekä immunofluoresenssianalyysi HAL:n ja HAR:n mahdollisten vaikutusten selvittämiseksi joihinkin AD:n etenemisen taustalla oleviin mekanismeihin. Tämän tutkimuksen tuloksista on hyötyä arvioitaessa β-karboliinialkaloidien antiamnestisia vaikutuksia jatkotutkimuksessa ja -kehityksessä, ja ne voivat tarjota arvokasta tietoa AD:n kliinistä hoitoa varten.
Materiaalit ja menetelmät
Materiaalit
Harmaliini, HAR, L-tryptofaani (L-Trp), 5-hydroksitryptamiini (5-HT), 5-hydroksiindoli-3-etikkahappo (5-HIAA), asetyylikoliinikloridi (ACh), koliinikloridi (Ch), γ-aminovoihappo (γ-GABA), L-glutamiinihapon mononatriumsuolan monohydraatti (L-Glu), L-fenyylialaniini (L-Phe), L-tyrosiini (L-Tyr), teofylliini ja kaikki muut käytetyt kemikaalit ostettiin Sigma-Aldrich, Co., Ltd. (St. Louis, MO, Yhdysvallat). Skopolamiinihydrobromidi ja donepetsiilihydrokloridimonohydraatti ostettiin TCI (Shanghai) Development, Co., Ltd.:ltä. (Shanghai, Kiina). Karboksimetyyliselluloosanatrium (CMC-Na) ja NaCl saatiin Meilunbio® Biotech, Co., Ltd.:ltä. (Dalian, Kiina). Yhdistetty titaanidioksidiväriaine ostettiin Shanghai Dyestuffs Research Institute, Co., Ltd.:stä. (Shanghai, Kiina). BCA-proteiinien määrityssarja, RIPA-lyysipuskuri, naudan seerumin albumiini (BSA), PBST (10X), 30-prosenttinen akryyliamidi, 10-prosenttinen SDS, glysiini, näytteen latauspuskuri (4X) ja TEMED ostettiin YEASEN Biotechnology, Co., Ltd.:ltä. (Shanghai, Kiina). Fosfolipaasi-inhibiittori ja proteaasi-inhibiittori ostettiin Roche Applied Science -yritykseltä (Foster City, CA, Yhdysvallat). PVDF-kalvo ja ImmobilonTM Western kemiluminesenssi HRP-substraatti ostettiin Milliporelta (Billerica, MA, Yhdysvallat). Kanin anti-AChE, kanin anti-koliiniasetyylitransferaasi (ChAT), kanin anti-MPO ja anti-glyseraldehydi-3-fosfaattidehydrogenaasi (GAPDH), HRP-konjugoidut anti-kani IgG-vasta-aineet ja merkkiaine ostettiin Abcam Technologyltä (Cambridge, MA, Yhdysvallat). HPLC-luokan asetonitriili, metanoli ja muurahaishappo ostettiin Fisher Scientific, Co. (Santa Clara, CA, Yhdysvallat). Deionisoitu vesi (>18 mΩ) puhdistettiin Milli-Q Academic Systemillä (Millipore, Corp., Billerica, MA, Yhdysvallat). Kaikki muut kemikaalit olivat analyyttistä laatua.
eläimet
Sata kahdeksan uros C57BL/6-hiirtä (iältään 10 viikkoa) saatiin Shanghain perinteisen kiinalaisen lääketieteen yliopiston lääketurvallisuuden arviointi- ja tutkimuskeskuksesta. Hiiret kasvatettiin hyvin valaistussa ilmastoidussa huoneessa (25 ± 1 °C) tavanomaisissa ympäristöolosuhteissa (suhteellinen kosteus: 60-65 %, 12 tunnin valo-pimeä-vuorokausijakso: valo päällä kello 7:00-19:00), ja niille annettiin vapaata pääsyä jyrsijöiden ruokaan ja vesijohtoveteen. Kaikki eläinkäyttötoimenpiteet olivat Kiinan valtion tiede- ja teknologiakomitean 14. marraskuuta 1988 antamien eläinkokeita koskevien säännösten mukaisia, ja Shanghain perinteisen kiinalaisen lääketieteen yliopiston koe-eläinten eettinen komitea hyväksyi ne (nro. SUTCM-2011-1107; Hyväksymispäivä: 10. marraskuuta 2011).
Lääkkeen anto
HAL:n ja HAR:n biologisen hyötyosuuden eron perusteella annoksiksi asetettiin 2, 5 ja 10 mg/kg HAL:lle ja 10, 20 ja 30 mg/kg HAR:lle (Zhang, 2013; Shi et al., 2014). Sata kahdeksan hiirtä jaettiin satunnaisesti yhdeksään ryhmään (12 hiirtä ryhmää kohti), nimittäin kontrolliryhmään (kantaja-aine, 0,5 % CMC-Na), skopolamiiniryhmään (1 mg/kg), donepetsiiliryhmään (positiivinen kontrolli, 5 mg/kg), HAL-ryhmiin (2, 5 ja 10 mg/kg eli matalat: L-, keskisuuret: M- ja korkeat: H-annokset) ja HAR-ryhmiin (10, 20 ja 30 mg/kg eli L-, M- ja H-annokset). Kuten kuvasta 1 käy ilmi, ennen MWM-testiä kontrolli- ja skopolamiiniryhmille annettiin suun kautta 0,5-prosenttista CMC-Na-liuosta, ja HAL-ryhmille (L-, M- ja H-annokset), HAR-ryhmille (L-, M- ja H-annokset) ja donepetsiiliryhmille (5 mg / kg) annettiin ruokatorven kautta seitsemänä peräkkäisenä päivänä. Päivästä 8 päivään 16 skopolamiinia (1 mg/kg) ruiskutettiin vatsansisäisesti (i.p.) kaikkiin ryhmiin paitsi kontrolliryhmään, joka sai normaalia suolaliuosta 30 minuuttia eri hoitojen jälkeen. Tämän jälkeen käyttäytymiskokeet suoritettiin päivittäin 30 min skopolamiinin tai normaalin suolaliuoksen i.p.-injektion jälkeen.
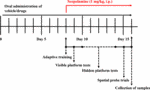
KUVIO 1. Käyttäytymiskokeet. Hiirten koe- ja hoitosuunnitelmien aikataulu.
Käyttäytymisen arviointi Morrisin vesilabyrintissa
MWM-testiä käytettiin arvioimaan HAL:n ja HAR:n vaikutuksia hiirten avaruudelliseen oppimiseen ja muistiin Richard Morrisin vuonna 1982 aiemmin kuvaamalla tavalla pienin muutoksin (Morris et al., 1982; He ym., 2015a; Singh ym., 2016).
MWM-laitteisto koostui valkoisesta pyöreästä vesisäiliöstä (halkaisija: 120 cm ja korkeus: 50 cm), jota ympäröivät erilaiset visuaaliset vihjeet (tähti, neliö, suorakulmio, suorakulmio ja ympyrä jne.) pylväissä kiinteissä paikoissa koko kokeen ajan. Säiliö valkaistiin lisäämällä myrkytöntä väriainetta, titaanidioksidiyhdistettä, 22 ± 2 °C:n lämpötilassa siten, että alusta oli näkymätön veden pinnan alla. Säiliö oli käytännössä jaettu neljään yhtä suureen kvadranttiin, jotka olivat kaakkoinen, koillinen, lounainen ja luoteinen. Valkoinen alusta (halkaisija: 10 cm ja korkeus: 25 cm) oli keskitetty lounaaseen nelikenttään (Jeon et al., 2017; Kouémou et al., 2017; Lu et al., 2018). Koko kokeellinen menettely koostui sopeutumiskoulutuksesta (1 päivä, kerran päivässä), näkyvän alustan testistä (1 päivä, neljä kokeilua päivässä), piilotetun alustan testeistä (5 päivää, neljä kokeilua päivässä) ja avaruudellisesta koettimen kokeesta (24 h viimeisen piilotetun alustan testin jälkeen, kerran päivässä).
Sopeutumiskoulutuksen (1 päivä, kerran päivässä), MWM-testin ensimmäisenä päivänä (lääkekäsittelyjen 8-päivänä), kukin hiiri sijoitettiin vesisäiliön sisälle uimaan 60 s: n ajan, jotta se saisi akklimatisoitumisjakson. Seuraavana päivänä (lääkehoitojen 9. päivä) hiirten visuaalisten, sensoristen ja motoristen ominaisuuksien tutkimiseksi näkyvä alusta sijoitettiin 1 cm vedenpinnan yläpuolelle, ja jokaisen hiiren annettiin löytää alusta 60 s. Testi (1 päivä, neljä kokeilua päivässä) suoritettiin ennen piilotetun alustan kokeilua pätevien hiirten seulomiseksi. Tämän jälkeen alusta upotettiin 1 cm vedenpinnan alapuolelle piiloalustakokeissa (5 päivää, neljä koetta päivässä, lääkehoitojen päivät 10-14). Uintiaktiivisuus tallennettiin yläpuolella olevalla videokameralla ja analysoitiin tietokoneistetun seuranta- ja kuva-analysaattorijärjestelmän (RD1101-MWM-G, Shanghai Mobile Datum Information Technology Company, Shanghai, Kiina) avulla. Hiiret vapautettiin säiliöön pää säiliön seinään päin yhdestä neljästä kvadrantista peräkkäin (koillisesta, pohjoisesta, idästä ja kaakosta), ja niiden annettiin löytää alusta 60 s. Jos hiiri ei löytänyt alustaa, sen olisi ohjattava varovasti erityisellä kokeilijalla, ja sen annettiin pysyä 15 s alustalla. Kunkin kokeen jälkeen jokainen hiiri vietiin häkkiinsä ja sen annettiin kuivua lämmittimen alla. Pakenemisviive ja pakenemisnopeus kirjattiin jokaisesta kokeesta. Tilakokeessa (lääkehoitojen 15. päivä) alusta poistettiin säiliöstä. Jokainen hiiri asetettiin vesisäiliöön edellisen alustan sijainnin (kohdekvadrantti) vastakkaisesta kvadrantista (hetkellisesti luoteesta) 60 s muistin säilyttämiskokeen saamiseksi (Lee et ai., 2016; Liu et ai., 2017; Malik et ai., 2017). Aika kohdekvadrantissa ja ylitysmäärä kirjattiin.
Aivokudosten kerääminen
16. päivänä lääkehoitojen jälkeen kaikki hiiret nukutettiin ja plasma kerättiin oftalmektomialla, ja sitten aivokudokset kerättiin dekapitaation jälkeen. Kussakin ryhmässä alaryhmän eläinten aivoja käytettiin immunofluoresenssianalyysiin ja muita eläimiä biokemialliseen ja western blotting -analyysiin. Uhrauksen jälkeen aivokudokset poistettiin välittömästi, huuhdeltiin normaalilla suolaliuoksella, pyyhittiin pintavesikosteus suodatinpaperilla ja punnittiin. Kunkin aivokuori ja hippokampus jaettiin kahteen osaan (vasempaan ja oikeaan) jäällä. Osa niistä kiinnitettiin 4-prosenttisella paraformaldehydillä immunofluoresenssianalyysiä varten, ja toiset jäädytettiin välittömästi nestemäisellä typellä ja säilytettiin sitten -80 °C:ssa analyysiin asti.
Biokemiallinen määritys
Aivokuori ja hippokampus homogenisoitiin jääkylmässä 0.1 M fosfaattipuskurissa (pH 7,4), ja 10 %:n (w/v) homogenaatit sentrifugoitiin 4 °C:ssa 12 000 rpm:n kierrosnopeudella 10 minuutin ajan, ja supernatantit erotettiin toisistaan, minkä jälkeen ne varastoitiin -80 °C:n lämpötilaan biokemiallista arviointia varten (Malik ym, 2017). AChE:n, ChAT:n, superoksididismutaasin (SOD), glutationiperoksidaasin (GSH-px), maleiinidiadehydin (MDA), MPO:n, tuumorinekroositekijä α:n (TNF-α), interleukiini 1β:n (IL-1β), interleukiini 6:n (IL-6), interleukiini 10:n (IL-10), ja typpioksidi (NO) aivokuoren ja/tai hippokampuksen homogenaateista määritettiin ELISA-menetelmällä käyttäen kaupallisesti saatavilla olevia määrityssarjoja (Jiancheng, Nanjing, Kiina) valmistajan ohjeiden mukaisesti. Erityisesti edellä mainittujen biokemiallisten tekijöiden tasot aivokuoressa ja hippokampuksessa normalisoitiin käyttämällä kunkin näytteen proteiinipitoisuutta. Määritykset tehtiin kahtena kappaleena.
Western Blotting Analysis
Aivokuori ja hippokampus homogenisoitiin jääkylmässä 50 mM Tris-HCl-puskurissa (pH 7,4), joka sisälsi fosfataasi-inhibiittoria ja proteaasi-inhibiittoria. Sentrifugoinnin (12 000 rpm) jälkeen 10 minuutin ajan 4 °C:ssa kokonaisproteiinipitoisuus määritettiin BCA-proteiinimäärityssarjalla. Proteiininäytteet sekoitettiin neljänneksen tilavuuteen latauspuskuria ja kuumennettiin sitten 5 minuuttia 100 °C:ssa. Kustakin näytteestä elektroforeerattiin 20 μg proteiinia 8 % SDS-PAGE:lla ja siirrettiin PVDF-kalvoille. Tämän jälkeen kalvo estettiin 1 tunnin ajan 5-prosenttisella rasvattomalla maidolla huoneenlämmössä ja inkuboitiin anti-GAPDH:lla (1:5000), anti-AChE:llä (1:1000), anti-ChAT:lla (1:1000) ja anti-MPO:lla (1:1000) 4 °C:ssa yön yli. Tämän jälkeen kalvot huuhdeltiin huolellisesti PBST:llä ja inkuboitiin sitten HRP-konjugoidulla anti-kaniini (1:5000) sekundäärisellä vasta-aineella 2 tunnin ajan huoneenlämmössä. Kun proteiinibändit oli pesty kokonaan PBST:llä, ne visualisoitiin ECL prime kitillä.
Immunofluoresenssianalyysi
Myeloperoksidaasin muodostuminen visualisoitiin immunofluoresenssimikroskopialla aiemmin kuvatulla tavalla pienin muutoksin (Gray ym., 2008). Kiinnittämisen jälkeen 4-prosenttiseen paraformaldehydiin korteksit leikattiin 5 μm paksuiksi sagittaalisiksi leikkauksiksi, ja ne deparafinoitiin ja käsiteltiin immunofluoresenssianalyysiä varten. Aivoleikkeet asetettiin sitruunahappoliuokseen (pH 6,0) antigeenin korjaamista varten mikroaaltouunissa. Tämän jälkeen autofluoresenssin sammutus suoritettiin 5 minuutin ajan. Sen jälkeen, kun leikkeet oli estetty 2 %:n BSA:ssa, ne tutkittiin anti-MPO:lla (1:100) yön yli 4 °C:ssa. Tämän jälkeen leikkeet pestiin PBS:llä (pH 7,4) kolme kertaa ja inkuboitiin HRP-konjugoidulla anti-kaniinivasta-aineella (1:300) 30 minuutin ajan huoneenlämmössä. Tämän jälkeen käytettiin 4′,6-diamidino-2-fenylindolia (DAPI) DNA:n vastavärjäykseen, ja aivoleikkeitä tarkasteltiin fluoresenssimikroskoopilla (Nikon ECLIPSE C1, Japani), ja kuvat otettiin vastaavasti. Tässä DAPI:n tai MPO:n fluoresenssi mitattiin vastaavasti 330-380 tai 510-560 nm:n heräteaallonpituudella ja 420 tai 590 nm:n emissioaallonpituudella.
HAL:n ja HAR:n vaikutukset hermovälittäjäaineisiin
Extraktiomenetelmä
Nopeaa, luotettavaa ja käytännöllistä saostamismenetelmää sovellettiin aivokuorihomogenaattien ja veriplasmanäytteiden valmistamiseen. 100 μl näytettä lisättiin 200 μl:aan jääkylmää asetonitriiliä, joka sisälsi 60 ng/ml IS:ää, 1,5 ml:n sentrifugiputkessa ja sekoitettiin vortexillä 1 minuutin ajan. Tämän jälkeen seosta sentrifugoitiin 12 000 rpm 10 minuutin ajan (4 °C). Kunkin näytteen supernatantista injisoitiin 5 μl:n aliquot-annos ultrasuorituskykyiseen nestekromatografiaan yhdistettynä sähkösuihku-ionisaatio (ESI) kvadrupoli-tandem-massaspektrometriaan (UPLC-ESI-MS/MS) kvantitatiivista analyysia varten.
UPLC-ESI-MS/MS-analyysi
Eri välittäjäaineiden pitoisuudet kvantifioitiin samanaikaisesti SHIMADZU LC-30AD UPLC-järjestelmällä (Shimadzu, Kioto, Japani), joka oli liitetty AB Sciex QTRAP® 6500 -kolmoisella kvadrupoli-massaspektrometrillä (SCIEX, Yhdysvallat), joka oli varustettu ESI-lähteellä, jossa käytettiin positiivisen ionin havaitsemistilaa moninkertaisen reaktion seurantaa varten. Kromatografinen erottelu suoritettiin käyttämällä ZIC-cHILIC-kolonnia (150 mm × 2,1 mm, 3 μm, Merck-Sequant, Saksa), jossa oli SeQuant ZIC-cHILIC-suojakolonni (20 mm × 2,1 mm, 5 μm, Merck-Sequant, Saksa). Liikkuva faasi, asetonitriili – vesi (65:35, v/v), joka sisälsi 0,1 % muurahaishappoa, annettiin virtausnopeudella 0,2 ml/min. Massaspektrometrin suojaamiseksi kontaminaatioilta virtaus ohjattiin hukkaan ensimmäisen minuutin aikana injektion jälkeen. Kaikki muut instrumenttiparametrit asetettiin aiemman tutkimuksemme mukaisesti (Jiang, 2016). UPLC-ESI-MS/MS-menetelmä oli hyvin validoitu ja sitä sovellettiin menestyksekkäästi neurotransmitterien pitoisuuksien määrittämiseen aivokuoren homogenoiduissa aineissa ja plasmassa (Jiang, 2016).
Statistinen analyysi
Statistinen arviointi tehtiin SPSS-ohjelmiston versiolla 18.0, ja tiedot ilmaistiin keskiarvona ± SD. Esitetyt pakenemisviiveen ja polun pituuden tiedot MWM-testissä analysoitiin toistettujen toimenpiteiden kaksisuuntaisella ANOVA:lla. Muut käyttäytymistiedot ja biomarkkereiden muutokset in vitro testattiin yksisuuntaisella ANOVA:lla useita vertailuja varten. Merkitsevät tulokset merkittiin tavanomaisten kriittisten P-arvojen mukaisesti: #P < 0.05; ##P < 0.01; ###P < 0.001, vs. kontrolliryhmä. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, vs. skopolamiinin aiheuttama ryhmä.
Tulokset
HAL ja HAR heikensivät skopolamiinilla käsiteltyjen hiirten kognitiivista toimintahäiriötä MWM:ssä
HAL:n (L-, M- ja H-annokset) ja HAR:n (L-, M- ja H-annokset) vaikutusten selvittämiseksi spatiaaliseen oppimiseen ja muistiin tehtiin MWM-tehtävä skopolamiinin aiheuttamassa muistihäiriöisessä muistin heikentymishiiressä. Kaksisuuntainen toistettujen toimenpiteiden analyysi sekamallilla osoitti, että latenssi alustan saavuttamiseen oli merkittävästi erilainen hiirten koeryhmien (F(8,396) = 26.011, P < 0.001) ja hankintakoulutuksen päivien (F(4,396) = 15.274, P < 0.001) välillä. Ryhmien ja päivien välillä ei ollut merkittävää vuorovaikutusta (F(32,396) = 1.132, P > 0.05), mikä viittaa siihen, että ryhmien väliset erot olivat riippuvaisia hoidosta. Kuten kuvassa 2 esitetään, piilotetun alustan testauksessa pakenemisen latenssi ja polun pituus skopolamiinin aiheuttamassa ryhmässä olivat merkittävästi pidempiä kuin kontrolliryhmässä neljännellä (Kuva 2A, F (8,99) = 3.135, P < 0.01; Kuva 2B, F(8,99) = 4.074, P < 0.01) ja viidentenä päivänä (Kuva 2A, F(8,99) = 4.164, P < 0.01; Kuva 2B, F(8,99) = 4.548, P < 0.01), mikä osoitti onnistuneesti rakennetun hiirten muistin heikkenemismallin. Skopolamiinin aiheuttamat kognitiiviset puutteet kumoutuivat kuitenkin sekä HAL:lla että HAR:lla. Skopolamiinin aiheuttamaan ryhmään verrattuna pakenemisen latenssi ja polun pituus vähenivät tehokkaasti HAL- (L-, M- ja H-annokset) ja HAR- (M- ja H-annokset) -käsitellyissä ryhmissä neljännellä (Kuva 2A, F(8,99) = 4.975, P < 0.01; F(8,99) = 2.816, P < 0.05; F(8,99) = 2.795, P < 0.05; Kuva 2B, F(8,99) = 3.836, P < 0.01; F(8,99) = 3.231, P < 0.01; F(8,99) = 2.658, P < 0.05; Kuva 2C, F(8,99) = 4.673, P < 0.01; F(8,99) = 4.881, P < 0.01; Kuva 2D, F(8,99) = 3.817, P < 0.01; F(8,99) = 3.129, P < 0.01) ja viidennen päivän (Kuva 2A, F(8,99) = 12.637, P < 0.001; F(8,99) = 2.802, P < 0.05; F(8,99) = 2.772, P < 0.05; Kuva 2B, F(8,99) = 4.014, P < 0.01; F(8,99) = 2.722, P < 0.05; F(8,99) = 2.531, P < 0.05; Kuva 2C, F(8,99) = 4.574, P < 0.01; F(8,99) = 4.632, P < 0.01; Kuva 2D, F(8,99) = 2.547, P < 0.05; F(8,99) = 3.905, P < 0.01). Kuitenkin, kun hoidettiin pienellä HAR-annoksella 10 mg / kg (L-annosryhmä), pakenemisen latenssi ja polun pituus eivät vähentyneet merkittävästi koko harjoittelujakson aikana neljännellä (Kuva 2C, F (8,99) = 1.182, P > 0,05; Kuva 2D, F(8,99) = 0,494, P > 0,05) ja viidentenä päivänä (Kuva 2C, F(8,99) = 0,873, P > 0,05; Kuva 2D, F(8,99) = 0,201, P > 0,05). Kuvasta 2 voidaan myös nähdä, että donepetsiilillä käsiteltyjen (5 mg / kg) pakenemislatenssi ja polun pituus lyhenivät huomattavasti verrattuna skopolamiinilla indusoidun ryhmän ryhmään neljännellä (Kuva 2A, F (8,99) = 2.668, P < 0.05; Kuva 2B, F(8,99) = 2.643, P < 0.05) ja viidentenä päivänä (Kuva 2A, F(8,99) = 2.780, P < 0.05; Kuva 2B, F(8,99) = 2.897, P < 0.05) harjoittelukokeilun kolmannella harjoitusjaksolla
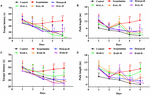
KUVIO 2. Harjoittelukokeilun kolmas jakso. HAL:n (2, 5 ja 10 mg/kg, eli matalat: L-, keskisuuret: M- ja suuret: H-annokset) ja HAR:n (10, 20 ja 30 mg/kg, eli L-, M- ja H-annokset) vaikutukset skopolamiinin aiheuttamiin muistihäiriöihin hiirillä. HAL (L-, M- ja H-annokset), HAR (L-, M- ja H-annokset) ja donepetsiiliä (5 mg/kg) annettiin gavage-annoksena 7 päivää ennen Morrisin vesilabyrintti (MWM) -testien harjoittelua, ja sitä jatkettiin testien aikana. Muistihäiriöt aiheutettiin skopolamiinilla (1 mg/kg, i.p.). HAL:lla (L-, M- ja H-annokset) käsiteltyjen ryhmien pakenemisen latenssi (A) ja polun pituus (B) piilotetun alustan testeissä viitenä peräkkäisenä päivänä ja HAR:lla (L-, M- ja H-annokset) käsiteltyjen ryhmien pakenemisen latenssi (C) ja polun pituus (D) piilotetun alustan testeissä viitenä peräkkäisenä päivänä. Tämän kuvan datapisteiden virhepalkkia (SD) ei ole annettu, jotta hoitojen väliset erot voitaisiin erottaa selvästi. N = 12/ryhmä. ##P < 0.01, vs. kontrolliryhmä. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, vs. skopolamiinin aiheuttama ryhmä.
Piilotetun alustan testausta seuraavana päivänä suoritettiin avaruudellinen koekoe ottamalla alusta pois kaikkien hiirten avaruudellisen muistin arvioimiseksi. Kuten kuvasta 3 näkyy, ohitusfrekvenssi laski huomattavasti skopolamiinin aiheuttamassa ryhmässä (F(8,81) = 5.498, P < 0.05), mikä osoittaa, että 1 mg/kg skopolamiinia vahingoitti hiirten avaruudellisen muistin muodostumista. Erityisesti HAR (L-annos) -hoitoryhmää (F (8,81) = 0.494, P > 0.05) lukuun ottamatta muut HAL (L-, M- ja H-annokset) ja HAR (M- ja H-annokset) -hoitoryhmät nostivat dramaattisesti ohitustaajuutta (F (8,81) = 11.667, P < 0.01; F(8,81) = 9.072, P < 0.01; F(8,81) = 4.507, P < 0.05; F(8,81) = 7.063, P < 0.05; F(8,81) = 8.583, P < 0.01), ja HAL-L-annosryhmän lisäys oli huomattavampi verrattuna muihin ryhmiin (kuva 3). Lisäksi donepetsiilillä käsitelty (5 mg / kg) -ryhmä lisäsi myös merkittävästi ohitusfrekvenssiä verrattuna skopolamiinilla indusoituihin hiiriin (kuva 3, F(8,81) = 5.345, P < 0.05). Kaikki nämä tulokset viittasivat siihen, että HAL (L-, M- ja H-annokset) ja HAR (M- ja H-annokset) voisivat parantaa skopolamiinin aiheuttamien kognitiivisten toimintahäiriöiden hiirten avaruudellista muistikykyä, ja HAL:lla oli voimakkaampia vaikutuksia kuin HAR:lla avaruudelliseen oppimiseen ja muistiin MWM:ssä.
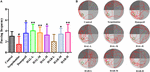
KUVIO 3. HAL:n (2, 5 ja 10 mg/kg eli matalat: L-, keskisuuret: M- ja suuret: H-annokset) ja HAR:n (10, 20 ja 30 mg/kg eli L-, M- ja H-annokset) vaikutukset skopolamiinin aiheuttamiin muistihäiriöihin hiirillä. Alustan sijainnin läpi kulkevien hiirten taajuus (A) ja hiirten uintiradat vesisäiliössä (B). Vihreä ympyrä osoittaa piilotetun alustan sijainnin, kun taas punaiset käyrät kuvaavat hiirten liikeratoja. N = 10/ryhmä. #P < 0.05, vs. kontrolliryhmä. ∗P < 0.05; ∗∗P < 0.01; vs. skopolamiinin aiheuttama ryhmä.
HAL:n ja HAR:n vaikutukset skopolamiinin aiheuttamaan kolinergiseen järjestelmään, oksidatiiviseen stressiin ja tulehdukseen
HAL:n ja HAR:n mahdollisten mekanismien tarkemmaksi selvittämiseksi skopolamiinin aiheuttaman muistin parantamisessa tutkittiin moninaisten biokemiallisten tekijöiden ja proteiini-ilmaisujen tasoja, jotka liittyvät kolinergiseen järjestelmään, oksidatiiviseen stressiin ja tulehdukseen. Kuvissa 4, 5 esitetään erilaisten biokemiallisten tekijöiden muutokset aivokuoressa tai hippokampuksessa, ja kuvissa 6-8 esitetään HAL:n ja HAR:n vaikutukset hiirten aivokuoren proteiini-ilmentymiin.
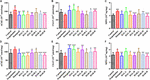
KUVA 4. HAL:n ja HAR:n vaikutukset aivokuoren proteiini-ilmentymiin. HAL:n (2, 5 ja 10 mg/kg, eli matala: L, keskisuuri: M ja korkea: H-annokset) ja HAR (10, 20 ja 30 mg/kg, eli L-, M- ja H-annokset) asetyylikoliiniesteraasin (AChE), koliiniasetyylitransferaasin (ChAT) ja myeloperoksidaasin (MPO) aktiivisuuteen skopolamiinin aiheuttamien kognitiivisten häiriöiden aiheuttamien hiirten aivokuoressa (A-C) ja hipokampuksessa (D-F). Tiedot ilmaistiin keskiarvona ± SD (n = 10). #P < 0.05; ##P < 0.01; ###P < 0.001, vs. kontrolliryhmä. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, vs. skopolamiinin aiheuttama ryhmä.
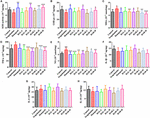
KUVA 5. HAL:n (2, 5 ja 10 mg/kg, eli matala: L, keskisuuri: M ja korkea: H-annokset) ja HAR (10, 20 ja 30 mg/kg, eli L-, M- ja H-annokset) superoksididismutaasin (SOD) (A), glutationiperoksidaasin (GSH-px) (B) aktiivisuuteen tai tuotantoon, maleiinidiadehydin (MDA) (C), tuumorinekroositekijä α:n (TNF-α) (D) ja typpioksidin (NO) (E) vaikutusta skopolamiinin aiheuttamien kognitiivisten häiriöiden aiheuttamien hiirten aivokuoressa. Tiedot ilmaistiin keskiarvona ± SD (n = 10). #P < 0.05; ##P < 0.01; ###P < 0.001, vs. kontrolliryhmä. Interleukiini 1β (IL-1β) (F), interleukiini 6 (IL-6) (G) ja interleukiini 10 (IL-10) (H). ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, vs. skopolamiinin indusoima ryhmä.
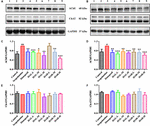
KUVA 6. HAL:n (2, 5 ja 10 mg/kg, eli matalat: L-, keskisuuret: M- ja suuret: H-annokset) ja HAR:n (10, 20 ja 30 mg/kg, eli L-, M- ja H-annokset) vaikutukset asetyylikoliiniesteraasin (AChE) ja koliiniasettitransferaasin (ChAT) proteiiniekspressiotasoihin skopolamiinin aiheuttamien kognitiivisten haittojen aiheuttamien hiirten aivokuoressa (A,C,E) ja lonkkakampuksessa (B,D,F). Tiedot ilmaistiin keskiarvona ± SD (n = 3). #P < 0.05; ##P < 0.01, vs. kontrolliryhmä. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, vs. skopolamiinin aiheuttama ryhmä.

KUVIO 7. Vertailuryhmä. HAL:n (2, 5 ja 10 mg/kg, eli matalat: L-, keskisuuret: M- ja korkeat: H-annokset) ja HAR:n (10, 20 ja 30 mg/kg, eli L-, M- ja H-annokset) vaikutukset myeloperoksidaasin (MPO) proteiiniekspressiotasoihin skopolamiinin aiheuttamien kognitiivisten häiriöiden hiirten aivokuoressa (A,C) ja lonkkakampuksessa (B,D). Tiedot ilmaistiin keskiarvona ± SD (n = 3). #P < 0.05; ##P < 0.01, vs. kontrolliryhmä. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, vs. skopolamiinin aiheuttama ryhmä.

KUVIO 8. Skopolamiinin aiheuttama ryhmä. HAL:n (2, 5 ja 10 mg/kg, eli matalat: L-, keskisuuret: M- ja korkeat: H-annokset) ja HAR:n (10, 20 ja 30 mg/kg, eli L-, M- ja H-annokset) vaikutukset myeloperoksidaasin (MPO) syntyyn skopolamiinin aiheuttamien kognitiivisten häiriöiden aiheuttamien hiirten aivokuoressa visualisoituna immunofluoresenssimikroskopialla.
HAL:n ja HAR:n vaikutukset kolinergisiin vajaatoimintoihin
HAL:n ja HAR:n vaikutusten selvittämiseksi aivojen kolinergiseen toimintaan arvioitiin AChE:n ja ChAT:n aktiivisuudessa ja proteiinipitoisuuksissa tapahtuneita muutoksia kaikkien hiirten aivokuori- ja hippokampuskudoksissa. Kuten kuvista 4A,D käy ilmi, skopolamiinihoito 1 mg/kg lisäsi merkittävästi AChE:n aktiivisuutta aivokuoressa ja hippokampuksessa (F(8,81) = 10,553, P < 0,01; F(8,81) = 6,177, P < 0,05). Lukuun ottamatta HAR-L-annosryhmää aivokuoressa muut HAL- (L-, M- ja H-annokset) ja HAR- (M- ja H-annokset) -käsittelyryhmät vähensivät huomattavasti AChE-aktiivisuutta (Kuva 4A, F(8,81) = 10.837, P < 0.01; F(8,81) = 8.621, P < 0.05; F(8,81) = 15.177, P < 0.01; F(8,81) = 8.615, P < 0.05; F(8,81) = 16.330, P < 0.001; Kuva 4D, F(8,81) = 46.593, P < 0.001; F(8,81) = 34.179, P < 0.001; F(8,81) = 7.968, P < 0.05; F(8,81) = 4.769, P < 0.05; F(8,81) = 49.802, P < 0.001; F(8,81) = 46.665, P < 0.001). Samoin donepetsiilillä käsitelty ryhmä vähensi selvästi AChE: n aktiivisuutta verrattuna skopolamiinin aiheuttaman ryhmän tasoihin (Kuva 4A, F(8,81) = 13.138, P < 0.01; Kuva 4D, F(8,81) = 7.400, P < 0.05). Lisäksi skopolamiinin aiheuttama ryhmä osoitti merkittävää ChAT-aktiivisuuden vähenemistä sekä aivokuoressa että hippokampuksessa (Kuva 4B, F(8,81) = 5.481, P < 0.05; Kuva 4E, F(8,81) = 4.874, P < 0.05). Kuitenkin HAL (L- ja M-annokset) ja HAR (M- ja H-annokset) -annokset lisäsivät tuntuvasti ChAT-aktiivisuutta aivokuoressa (Kuva 4B, F(8,81) = 7.956, P < 0.05; F(8,81) = 8.390, P < 0.05; F(8,81) = 7.835, P < 0.05; F(8,81) = 51.927, P < 0.001), ja kaikkien HAL- ja HAR-hoitoryhmien ChAT-tasot hippokampuksessa olivat merkitsevästi korkeammat kuin skopolamiinin aiheuttamassa ryhmässä (Kuva 4E, F(8,81) = 18.139, P < 0.001; F(8,81) = 9.665, P < 0.01; F(8,81) = 14.113, P < 0.01; F(8,81) = 5.178, P < 0.05; F(8,81) = 7.599, P < 0.05; F(8,81) = 11.953, p < 0.01), ja HAL-L-annosryhmän vaikutus ChAT-aktiivisuuteen oli merkittävämpi verrattuna HAR-annosryhmiin.
Kuten kuvassa 6 on esitetty, verrattuna kontrolliryhmään, AChE: n proteiiniekspressiotasot aivokuoressa ja hippokampuksessa skopolamiinin aiheuttaman ryhmän aivokuoressa ja hippokampuksessa kasvoivat huomattavasti (kuva 6C, F (8,18) = 36.632, P < 0.01; kuva 6D, F (8,18) = 14.823, P < 0.05), kun taas ChAT: n proteiinipitoisuudet olivat melkein muuttumattomia (kuviot 6E ja 6E). HAL- (L-, M- ja H-annokset), HAR- (M- ja H-annokset) ja donepetsiilikäsittelyjen jälkeen, lukuun ottamatta HAR-annosta (L-annos), AChE: n proteiinitasot aivokuoressa pienenivät selvästi verrattuna skopolamiinin aiheuttamaan ryhmään (Kuva 6C, F(8,18) = 50.590, P < 0.001; F(8,18) = 16.950, P < 0.05; F(8,18) = 30.993, P < 0.01; F(8,18) = 23.821, P < 0.01; F(8,18) = 52.196, p < 0.001; F(8,18) = 29.284, p < 0.01), kun taas ChAT-tasot eivät muuttuneet (kuva 6E). Ja samanlaisia vaikutuksia AChE- ja ChAT-tasoihin havaittiin HAL- ja HAR-annoksilla (L-, M- ja H-annokset) hippokampuksessa (Kuva 6D, F(8,18) = 41.195, P < 0.001; F(8,18) = 28.111, P < 0.01; F(8,18) = 47.611, P < 0.001; F(8,18) = 30.539, P < 0.01; F(8,18) = 33.225, P < 0.01; F(8,18) = 40.032, P < 0.001; Kuva 6F). Lisäksi HAR: n estävät vaikutukset AChE-proteiinin ilmentymiseen olivat annosriippuvaisia, kun taas HAL: lla oli huomattava estävä vaikutus pienellä annoksella 2 mg / kg (Kuva 6). Siten HAL- ja HAR-hoidot estivät skopolamiinin aiheuttaman AChE-aktiivisuuden ja proteiiniekspression nousun ja ChAT-aktiivisuuden vähenemisen, mikä osoitti, että HAL ja HAR voisivat parantaa kolinergisen järjestelmän toimintaa ja lievittää käyttäytymishäiriöitä. Erityisesti HAL osoitti merkittävää parannusta pienellä annostuksella.
HAL:n ja HAR:n vaikutukset oksidatiivisen stressin merkkiaineisiin
HAL:n ja HAR:n vaikutukset antioksidanttisten entsyymien SOD:n, GSH-px:n aktiivisuuteen ja MDA:n tasoon aivokuoressa mitattiin. Kuten kuvasta 5 kävi ilmi, skopolamiinin aiheuttamassa ryhmässä SOD- ja GSH-px-aktiivisuus heikkeni näkyvästi kontrolliryhmään verrattuna (kuva 5A, F(8,81) = 12.254, P < 0.01; kuva 5B, F(8,81) = 4.577, P < 0.05). Kun taas HAL (H-annos), HAR (M- ja H-annokset) ja donepetsiilin antaminen lisäsivät merkittävästi SOD-aktiivisuutta (Kuva 5A, F(8,81) = 13.287, P < 0.01; F(8,81) = 13.424, P < 0.01; F(8,81) = 34.510, P < 0.001; F(8,81) = 8.670, P < 0.01), ja HAL-, HAR- (molemmat H-annokset) ja donepetsiilikäsittelyt nostivat selvästi GSH-px: n aktiivisuutta (Kuva 5B, F(8,81) = 6.010, P < 0.05; F(8,81) = 6.008, P < 0.05; F(8,81) = 6.860, P < 0.05). Lisäksi HAL-, HAR- (sekä M- että H-annokset) ja donepetsiili (5 mg / kg) -käsittelyillä havaittiin MDA-tason nousun merkittävää heikentymistä verrattuna skopolamiinin aiheuttamiin hiiriin (Kuva 5C, F (8,81) = 9.302, P < 0.01; F(8,81) = 6.565, P < 0.05; F(8,81) = 12.690, P < 0.01; F(8,81) = 33.627, P < 0.001; F(8,81) = 5.874, P < 0.05). Nämä tulokset viittasivat siihen, että HAL ja HAR voivat estää skopolamiinin aiheuttamia oksidatiivisia vaurioita suojaamalla aivokuorta oksidatiiviselta stressiltä. Huomattavaa oli, että hapettumisvaurioita voitiin parantaa vain suurilla annoksilla sekä HAL:n että HAR:n osalta, ja HAL:n ja HAR:n parannukset olivat yleisesti ottaen vertailukelpoisia.
HAL:n ja HAR:n vaikutukset tulehdustasoihin
Analysoitiin HAL:n ja HAR:n vaikutuksia tulehdustekijöiden MPO:n, TNF-α:n, IL-1β:n, IL-6:n ja IL-10:n aktiivisuuteen sekä NO:n tasoon aivokuoressa tai hippokampuksessa. MPO:n (aivokuori ja hippokampus) ja TNF-α:n (aivokuori) aktiivisuudet olivat koholla skopolamiinin aiheuttamissa hiirissä verrattuna kontrollihiiriin (kuva 4C, F(8,81) = 34.740, P < 0,001; Kuva 4F, F(8,81) = 6,729, P < 0,05; Kuva 5D, F(8,81) = 6,316, P < 0,05), mutta IL-1β:n, IL-6:n ja IL-10:n tasot eivät muuttuneet (kuvat 5F-H). HAL-, HAR- (sekä M- että H-annokset) ja donepetsiiliannokset johtivat kuitenkin MPO-aktiivisuuden merkittävään vähenemiseen aivokuoressa ja hippokampuksessa annosriippuvaisesti (Kuva 4C, F(8,81) = 10.435, P < 0,01; F(8,81) = 32,309, P < 0,001; F(8,81) = 16,397, P < 0,01; F(8,81) = 31,291, P < 0.001; F(8,81) = 7.129, p < 0.05; Kuva 4F, F(8,81) = 7.212, p < 0.05; F(8,81) = 10.533, p < 0.01; F(8,81) = 9.150, P < 0.01; F(8,81) = 18.903, P < 0.001; F(8,81) = 11.641, P < 0.01), ja HAL- (L-, M- ja H-annokset), HAR- (M- ja H-annokset) ja donepetsiilihoidot heikentävät myös TNF-α:n aktiivisuutta aivokuoressa (Kuva 5D, F(8,81) = 10.377, P < 0,01; F(8,81) = 28,257, P < 0,001; F(8,81) = 31,088, P < 0,001; F(8,81) = 15,966, P < 0,001; F(8,81) = 23,530, P < 0,001; F(8,81) = 5,909, P < 0,05). Lisäksi HAR-L-annosryhmää lukuun ottamatta NO-tason nousun huomattava vaimeneminen havaittiin muissa HAL-, HAR- ja donepetsiilihoitohiirissä verrattuna skopolamiinin aiheuttamiin amnesiahiiriin (Kuva 5E, F (8,81) = 21.319, P < 0.001; F(8,81) = 12.996, P < 0.01; F(8,81) = 11.911, P < 0.01; F(8,81) = 5.227, P < 0.05; F(8,81) = 8.799, P < 0.01; F(8,81) = 17,349, p < 0,001), ja HAL:n TNF-α:ta ja NO:ta estävät vaikutukset olivat voimakkaampia kuin HAR:n.
Kuten kuvasta 7 käy ilmi, kontrollihiiriin verrattuna kortikaalisen ja hippokampuksen MPO:n proteiiniekspressiotasot skopolamiinin aiheuttamissa hiirissä olivat koholla (kuva 7C, F(8,18) = 29.975, P < 0.01; kuva 7D, F(8,18) = 32.014, P < 0.01). Donepetsiilin, HAL: n ja HAR: n (L-, M- ja H-annokset) antamisen jälkeen MPO: n proteiini-ilmaisut laskivat ilmeisesti aivokuoressa ja hippokampuksessa verrattuna skopolamiinin aiheuttamaan ryhmään. Lisäksi immunofluoresenssimäärityksen tulokset paljastivat myös, että HAL- ja HAR-hoidot voisivat vähentää silmiinpistävästi aivokuoren MPO-ekspressiota annosriippuvaisella tavalla, ja HAL:n ja HAR:n estot olivat vertailukelpoisia (kuva 8). Kaikki nämä havainnot viittasivat siihen, että HAL ja HAR voisivat vähentää skopolamiinin aiheuttamaa tulehdusvauriota estämällä aivokuoren ja hippokampuksen tulehdusta.
HAL: n ja HAR: n modulaattorivaikutukset skopolamiinilla käsiteltyjen hiirten hermovälittäjäaineisiin
Erilaiset plasman ja kortikaaliset hermovälittäjäaineet arvioitiin UPLC-ESI-MS / MS: n avulla, ja muutokset on esitetty kuvissa 9, 10. vastaavasti. Aiemmin vahvistetun välittäjäaineiden määritysmenetelmän perusteella ACh:n, Ch:n, L-Trp:n, 5-HT:n, L-Glu:n, L-Phe:n, L-Tyr:n pitoisuudet plasmassa ja ACh:n, Ch:n, L-Trp:n, γ-GABA:n, L-Glu:n, L-Phe:n, L-Tyr:n pitoisuudet aivokuoressa olivat kvantitatiivisen määritysrajan alarajan yläpuolella, minkä jälkeen kaikki ne onnistuttiin määrittämään kvantitatiivisesti.
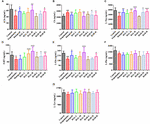
KUVA 9. HAL:n (2, 5 ja 10 mg/kg, eli matalat: L-, keskisuuret: M- ja suuret: H-annokset) ja HAR:n (10, 20 ja 30 mg/kg, eli L-, M- ja H-annokset) vaikutukset skopolamiinin aiheuttamien kognitiivisten häiriöiden aiheuttamien hiirten plasman välittäjäainepitoisuuksiin. N = 10/ryhmä. ACh (A), Ch (B), L-Trp (C), 5-HT (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0.05; ##P < 0.01; ###P < 0.001, vs. kontrolliryhmä. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, vs. skopolamiinin aiheuttama ryhmä.
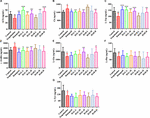
KUVA 10. HAL:n (2, 5 ja 10 mg/kg, eli matalat: L-, keskisuuret: M- ja korkeat: H-annokset) ja HAR:n (10, 20 ja 30 mg/kg, eli L-, M- ja H-annokset) vaikutukset skopolamiinin aiheuttamien kognitiivisten häiriöiden aiheuttamien hiirten aivokuoren välittäjäainepitoisuuksiin. N = 10/ryhmä. ACh (A), Ch (B), L-Trp (C), γ-GABA (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0.05; ##P < 0.01, vs. kontrolliryhmä. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, vs. skopolamiinin aiheuttama ryhmä.
Skopolamiinin indusoimisen jälkeen annoksella 1 mg / kg ACh: n, L-Trp: n, 5-HT: n, L-Glu: n ja L-Phe: n pitoisuudet pienenivät plasmassa (Kuva 9A, F (8,81) = 11.453, P < 0,01; Kuva 9C, F(8,81) = 23,137, P < 0,001; Kuva 9D, F(8,81) = 7,359, P < 0,05; Kuva 9E, F(8,81) = 55.531, P < 0.001; Kuva 9F, F(8,81) = 6.330, P < 0.05), kun taas L-Tyriin ei ollut vaikutusta (Kuva 9G, F(8,81) = 2.091, P > 0.05). Kuitenkin, kun HAL- ja HAR-hoitoja annettiin suurilla annoksilla, ACh- ja L-Glu-pitoisuudet kohosivat (kuvat 9A, E), ja L-Trp-pitoisuudet kohosivat selvästi HAL- (L-, M- ja H-annokset) ja HAR- (M- ja H-annokset) -annoksilla annosriippuvaisesti (kuva 9C). Lisäksi HAL- ja HAR- (M- ja H-annokset) hoidetuilla hiirillä havaittiin merkittävä 5-HT-tason nousu verrattuna skopolamiinin aiheuttamiin hiiriin (kuva 9D). HAL- ja HAR-annokset eivät kuitenkaan muuttaneet L-Phe- ja L-Tyr-pitoisuuksia (kuvat 9F, G). Lisäksi HAL (H-annos) sekä HAR (M- ja H-annokset) tuottivat vaikutuksen Ch:n pitoisuuden vähentämiseen plasmassa (kuva 9B).
Lisäksi kuvassa 10 on esitetty neurotransmittereiden vaihtelut aivokuorella. Skopolamiinin indusoimisen jälkeen ACh:n, L-Trp:n, L-Glu:n, L-Phe:n ja L-Tyr:n pitoisuudet vähenivät selvästi (kuva 10A, F(8,81) = 11.296, P < 0.01; kuva 10C, F(8,81) = 10.979, P < 0.01; kuva 10E, F(8,81) = 7.216, P < 0.05; kuva 10F, F(8,81) = 10.340, P < 0.01; Kuva 10G, F(8,81) = 6.834, P < 0.05), kun taas Ch- ja γ-GABA-pitoisuudet kohosivat merkitsevästi aivokuoressa kontrolliryhmään verrattuna (Kuva 10B, F(8,81) = 7.377, P < 0.05; Kuva 10D, F(8,81) = 5.580, P < 0.05). ACh-pitoisuudet olivat kuitenkin havaittavasti koholla HAL- (L-, M- ja H-annokset) ja HAR- (M- ja H-annokset) -ryhmissä, ja L-Trp-pitoisuudet kohosivat huomattavasti HAL- (L-, M- ja H-annokset) ja HAR- (H-annos) -ryhmissä, ja L-Glu-määrät kohosivat myös HAL- ja HAR-ryhmien suurilla annoksilla (Kuvat 10A,C,E). Lisäksi HAL- (L-, M- ja H-annokset) ja HAR- (H-annos) -käsittelyt johtivat Ch- ja γ-GABA-tasojen selvään vähenemiseen verrattuna skopolamiinin aiheuttamaan ryhmään (kuvat 10B,D). HAL:n ja HAR:n eri annoksilla oli kuitenkin vähäinen vaikutus skopolamiinin aiheuttamaan L-Phe- ja L-Tyr-tasojen vähenemiseen (kuvat 10F, G). Yleisesti ottaen HAL:n vaikutukset tärkeisiin plasman ja aivokuoren välittäjäaineisiin olivat selvempiä kuin HAR:n (kuvat 9, 10).
Keskustelu
Alzheimerin tauti on tappava etenevä hermoston rappeutumishäiriö, jossa ikääntyvä väestö ja elinajanodote kasvavat, ja on kiireellisesti löydettävä uusia lääkkeitä, jotka voivat tehokkaasti hoitaa AD: tä (Kouémou et ai, 2017). Yleisesti tiedetään, että kolinerginen hypofunktio, oksidatiivinen stressi ja neuroinflammaatio ovat yksi AD:n pääpiirteistä (Abd-El-Fattah et al., 2014; Demirci et al., 2017). Skopolamiini on ei-selektiivinen muskariinikolinergisen reseptorin antagonisti (Jang ym., 2013; Kaur ym., 2017). Lukuisat tutkimukset ovat osoittaneet, että skopolamiini voi heikentää oppimisen ja muistin kykyä ihmisillä ja eläinmalleilla, ja skopolamiinin aiheuttamaa AD-mallia käytetään laajalti kognitiivisen puutteen tutkimiseen ja AD-lääkkeiden seulontaan (Goverdhan et ai., 2012). Skopolamiini johtaa kognitiivisiin puutteisiin, jotka liittyvät kolinergisen neurotransmission vähenemiseen, lisääntyneeseen oksidatiiviseen stressiin sekä kohonneeseen tulehdukseen aivoissa (Lin ja Beal, 2006). Näin ollen lääkkeet voivat tehokkaasti parantaa kolinergistä toimintaa ja/tai heikentää oksidatiivista stressiä ja tulehdusta, ja ne voivat kääntää oppimis- ja muistihäiriöt skopolamiinin aiheuttamissa AD-hiirissä, ja ne ovat viime kädessä arvokkaita AD:n hoidossa.
Viime aikoina He et al. (2015a) osoittivat, että HAR voi estää AChE-aktiivisuutta ja parantaa merkittävästi kognitiivisesti heikentyneiden hiirten, mukaan lukien APP/PS1-siirtogeenisten ja skopolamiinin aiheuttamien AD-hiirten, spatiaalista oppimista ja muistia. Tässä tutkimuksessa verrattiin HAL:n (2, 5 ja 10 mg/kg) ja HAR:n (10, 20 ja 30 mg/kg) muistia parantavia vaikutuksia skopolamiini-indusoitujen hiirten muistiin käyttämällä MWM-käyttäytymisarviointia. Skopolamiinin (1 mg/kg) todettiin vahingoittavan hiirten avaruudellista oppimis- ja muistikykyä MWM-tehtävässä, mikä oli yhdenmukainen aiempien tutkimustemme kanssa (He et ai., 2015a; Liu et ai., 2017). HAL- (L-, M- ja H-annokset) ja HAR- (M- ja H-annokset) -hoitojen jälkeen pakenemisen latenssi ja polun pituus pienenivät ja ohitusfrekvenssi kasvoi tehokkaasti (kuvat 2, 3), mikä osoittaa, että HAL- ja HAR-annokset paransivat tuntuvasti skopolamiinin aiheuttamien hiirten oppimista ja avaruudellista muistia, ja HAL:n parannukset olivat merkittävämpiä kuin HAR:n parannukset.
HAL:n ja HAR:n oppimisen ja muistin parantamisen taustalla olevan mekanismin selvittämiseksi skopolamiinin aiheuttamissa hiirissä arvioitiin kolinergisen järjestelmän, oksidatiivisen stressin ja tulehduksen muutoksia. Kuten aiemmissa kirjallisuuksissa on raportoitu (Abd-El-Fattah et ai., 2014; Lin et ai., 2016; Demirci et ai., 2017), skopolamiinin i.p. -injektio johti kolinergisen toiminnan heikkenemiseen, kohonneeseen oksidatiiviseen stressiin ja tulehdukseen tässä tutkimuksessa. Donepetsiili on AChE:n estäjänä edustava oireenmukainen hoito lievässä ja keskivaikeassa Alzheimerin taudissa (Bohnen ym., 2005), ja viimeaikaisissa tutkimuksissa on käynyt ilmi, että se voi myös hillitä tulehdusta ja oksidatiivista stressiä (Saxena ym., 2008; Yoshiyama ym., 2010). Tässä tutkimuksessa donepetsiili (positiivinen kontrolli) pystyi tehokkaasti parantamaan näitä muutoksia skopolamiinin aiheuttamissa hiirissä ja paransi niiden oppimista ja muistia. Samoin kuin niiden toiminta in vitro (Zhao et al., 2013; Liu et al., 2014), HAL ja HAR eri annoksina eivät ainoastaan kumonneet skopolamiinin aiheuttamaa AChE-aktiivisuuden nousua, vaan johtivat myös neurotransmitterin ACh:n kohoamiseen ja Ch:n vähenemiseen aivokuoressa, hippokampuksessa tai plasmassa (kuvat 4, 9, 10). Lisäksi HAL ja HAR estivät selvästi aivokuoren AChE:n proteiinitasoja (kuvat 6C, D). Kuten Oh et al. (2009) raportoivat, ChAT-positiiviset neuronit vähenivät merkittävästi skopolamiinikäsittelyllä. Nykyiset tulokset osoittivat, että HAL ja HAR voisivat kääntää skopolamiinin aiheuttaman ChAT-aktiivisuuden vähenemisen (kuvat 4B, E), mutta niillä ei ole vaikutusta ChAT:n proteiini-ilmentymiin (kuvat 6E, F), ja se on vielä todistettava. Näin ollen nämä vahvistivat, että HAL: n ja HAR: n antiamnestiset vaikutukset skopolamiinin aiheuttamiin kognition toimintahäiriöihin liittyivät todennäköisesti kolinergisen järjestelmän (erityisesti AChE: n) muuttamiseen, ja HAL osoitti ilmeisen kolinergisen parannuksen pienellä annoksella (2 mg / kg).
Lisäksi monet tutkimukset ovat osoittaneet, että lisääntynyttä oksidatiivista stressiä pidetään laajasti merkittävänä myötävaikuttavana riskitekijänä AD: n kehittymisessä (Ghumatkar et ai., 2015; Lu et ai., 2018). HAL ja HAR saattavat toimia endogeenisina antioksidantteina, ja niillä on todettu olevan antioksidanttikapasiteettia pyyhkimällä vapaita radikaaleja (Tse-Susanna et ai., 1991; Berrougui et al., 2006a,b). Tässä tutkimuksessa skopolamiinin aiheuttamissa hiirissä havaittiin ROS:n (lipidiperoksidaation tuote, MDA) ylituotantoa ja antioksidanttientsyymien (SOD ja GSH-px) vähenemistä (kuva 5). HAL- ja HAR-annokset aktivoivat kuitenkin havaittavasti SOD:n ja GSH-px:n antioksidanttisia entsyymejä ja tukahduttivat MDA:n muodostumista skopolamiinin aiheuttaman dementian aiheuttamien hiirten aivokuoressa (kuva 5) ja paransivat sitten antioksidanttisen puolustuksen kykyä, mikä osoittaa HAL:n ja HAR:n neuroprotektiivisia vaikutuksia. Erityisesti HAL:n ja HAR:n antioksidatiiviset vaikutukset olivat yleisesti ottaen vertailukelpoisia.
Lisäksi yhä useammat todisteet viittaavat siihen, että muistin heikkeneminen liittyy lisääntyneeseen neuroinflammaatioon (Abd-El-Fattah ym., 2014). Bensalem et al. (2014) tutkimuksen mukaan HAL ja HAR osoittivat merkittävää MPO:n estoa IC50:n ollessa vastaavasti 0,08 ja 0,26 μM. HAR:n anti-inflammatorinen aktiivisuus saavutettiin estämällä TNF-α:ta ja NO:ta lipopolysakkaridilla stimuloiduissa hiiren RAW264- ja ihmisen THP-1-soluissa (Patel et al., 2012). Erityisesti skopolamiinin aiheuttamien amnesiahiirten aivoissa havaittiin korkeita pro-inflammatoristen sytokiinien (TNF-α ja MPO) ja tulehdusvälittäjäaineiden (NO) tasoja (kuvat 4, 5). Tämä tutkimus vahvisti, että HAL- ja HAR-käsittelyt pystyivät samanaikaisesti estämään NO:n muodostumista ja TNF-α:n ja MPO:n nousua, ja HAL:n estävät vaikutukset TNF-α:n ja NO:n suhteen olivat selvemmät kuin HAR:n (kuvat 4, 5). Lisäksi western blotting- ja immunofluoresenssianalyysin tulokset osoittavat edelleen, että HAL ja HAR tukahduttivat MPO:n proteiiniekspressiotasot huomattavasti (kuvat 7, 8), mikä viittaa siihen, että HAL:n ja HAR:n kyky torjua muistihäiriöitä saattaisi johtua tulehdusmarkkereiden TNF-α:n, MPO:n ja NO:n tukahduttamisesta.
Kuten tunnettua, Alzheimerin tauti liittyy erilaisten välittäjäaineiden riittämättömiin tasoihin (Kumar ja Singh, 2015; Svob Strac ym, 2015). Aiemmissa tutkimuksissa on raportoitu, että pelkkää skopolamiinia saaneilla hiirillä havaittiin huomattavaa kolinergisen järjestelmän reaktiivisuuden vähenemistä, mikä näkyi ACh-tason laskuna ja AChE-aktiivisuuden lisääntymisenä sekä ChAT-aktiivisuuden vähenemisenä (Lee ym., 2014). AD:n siirtogeeninen eläinmalli osoitti Glu-tason laskevan (Nilsen ym., 2012), ja seerumin ja plasman metabolomiikka osoitti myös Trp:n, 5-HT:n, Glu:n, Phe:n ja Tyr:n vähenemistä AD-mallihiirillä tai potilailla (Vermeiren ym., 2014; González-Domínguez ym., 2015; Weng ym., 2015; Corso ym., 2017; Li ym., 2018). Vastaavasti tuloksemme osoittivat, että skopolamiinin aiheuttamaan dementiaan liittyi ACh: n, L-Trp: n, 5-HT: n, L-Glu: n, L-Phe: n, L-Tyr: n väheneminen ja Ch: n ja γ-GABA: n kohoaminen, mikä on sopusoinnussa aiempien tutkimusten kanssa (Scali et ai.., 1999; Nilsen et al., 2012; Lee et al., 2014; Vermeiren et al., 2014; González-Domínguez et al., 2015; Kumar ja Singh, 2015; Weng et al., 2015; Zhou et al., 2016; Corso et al., 2017; Liu et al., 2017). Neurotransmittereilla on tärkeä rooli aivopiirissä, joka liittyy moniin oppimisen ja muistin osa-alueisiin, erityisesti kolinergisillä, serotonergisillä, glutametargisilla ja GABAergisilla välittäjäaineilla (Vermeiren et ai., 2014; Kumar ja Singh, 2015; Zhou et ai., 2016). On huomionarvoista, että L-Phe:tä ja L-Tyr:iä lukuun ottamatta muut muutokset voitiin kumota tehokkaasti sekä HAL- että HAR-annoksilla plasmassa ja aivokuoressa, ja HAL:n modulaatiot olivat silmiinpistävämpiä kuin HAR:n modulaatiot (kuvat 9, 10). Näin ollen näiden välittäjäaineiden säätely HAL:n ja HAR:n avulla voi olla hyödyllistä dementiahiirten oppimis- ja muistikyvyn parantamiseksi.
Yleisesti ottaen HAL (2, 5 ja 10 mg/kg) ja HAR (20 ja 30 mg/kg) osoittivat kolinergisen neurotransmission tehostumista AChE:n tukahduttamisen ja ChAT:n indusoimisen kautta, antioksidanttisen puolustuksen tehostaminen lisäämällä SOD- ja GSH-px-aktiivisuutta ja vähentämällä MDA-tuotantoa, anti-inflammatoristen vaikutusten tehostaminen alentamalla TNF-α:ta, MPO:ta ja NO:ta sekä kriittisten välittäjäaineiden (ACh, Ch, L-Trp, 5-HT, γ-GABA ja L-Glu) tasojen modulointi. Näin ollen HAL ja HAR voivat vaikuttaa moniin kohteisiin AD:n terapeuttisina lääkkeinä. Lisäksi HAL:n säädöt kolinergiseen toimintaan, tulehdukseen ja välittäjäaineisiin olivat huomattavampia kuin HAR:n, ja HAL osoitti samanlaista antioksidanttikapasiteettia kuin HAR. Erityisesti HAL:n tehokas annos (2 mg/kg) oli huomattavasti pienempi kuin HAR:n (20 mg/kg), mikä voi johtua pääasiassa näiden kahden lääkkeen biologisen hyötyosuuden ja metabolisen vakauden eroista (Li ym., 2017b). Kaiken kaikkiaan kaikki nämä tulokset osoittivat, että HAR:iin verrattuna HAL voi olla parempi kandidaattiyhdiste, jolla on paremmat antiamnestiset ja farmakokineettiset ominaisuudet Alzheimerin taudin hoidossa.
Tulokset
Yhteenvetona voidaan todeta, että HAL ja HAR pystyivät tehokkaasti parantamaan muistin heikkenemistä skopolamiinin aiheuttamassa hiirimallissa parantamalla kolinergeenisen järjestelmän toimintaa, tukahduttamalla oksidatiivista stressiä ja tulehdusvaurioita sekä moduloimalla elintärkeitä hermovälittäjäaineiden välittäjäaineen toimintaa dementia-hiivassa. Erityisesti HAL:n osalta kolinergisen toiminnan, tulehduksen ja välittäjäaineiden säätely oli merkittävämpää kuin HAR:n, ja sillä oli HAR:iin verrattavissa oleva antioksidanttivaikutus. Huomattavaa on, että HAL:n tehokas annos (2 mg/kg) oli paljon pienempi kuin HAR:n (20 mg/kg). Kokonaistulokset osoittavat, että HAL voi olla parempi lääkeehdokas oppimis- ja muistihäiriöiden, kuten Alzheimerin taudin, hoidossa. HAL:n muistia ehkäiseviä vaikutuksia ja molekyylimekanismeja on arvioitava edelleen, mikä antaa merkittävää alustavaa näyttöä Alzheimerin taudin ennaltaehkäisyä ja hoitoa varten.
Tekijöiden kontribuutiot
S-PL ja C-HW: osallistuivat tutkimussuunnitteluun, suorittivat data-analyysin, kirjoittivat tai osallistuivat käsikirjoituksen kirjoittamiseen. S-PL, Y-WW, S-LQ, Y-PZ, GD, W-ZD, CM, Q-YL, H-DG, WL ja X-MC: suorittivat kokeet.
Rahoitus
Tämä työ sai tukea Kiinan kansalliselta luonnontieteelliseltä säätiöltä (National Natural Science Foundation of China) ja Xinjiangin uiguurien autonomiselta alueelta (apuraha nro. U1130303), Kiinan kansallinen luonnontieteellinen säätiö (Grant No. 81173119), Kiinan tiede- ja teknologiaministeriön avainhanke (Grant No. 2012ZX09103201-051) ja Kiinan Shanghain tieteen teknologiayhteistyöhankkeet (Grant No. 14495800200), jotka myönnettiin C-HW:lle tämän tutkimuksen taloudelliseen tukeen.
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus suoritettiin ilman minkäänlaisia kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Abd-El-Fattah, M. A., Abdelakader, N. F. ja Zaki, H. F. (2014). Pyrrolidiiniditiokarbamaatti suojaa skopolamiinin aiheuttamaa kognitiivista heikkenemistä vastaan rotilla. Eur. J. Pharmacol. 723, 330-338. doi: 10.1016/j.ejphar.2013.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Aucoin, J. S., Jiang, P., Aznavour, N., Tong, X. K., Buttini, M., Descarries, L., et al. (2005). Hapetusstressistä riippumaton selektiivinen kolinerginen denervaatio Alzheimerin taudin hiirimallissa. Neuroscience 132, 73-86. doi: 10.1016/j.neuroscience.2004.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassani, T. B., Turnes, J. M., Moura, E. L., Bonato, J. M., J. M., Cóppola-Segovia, V., Zanata, S. M., et al. (2017). Kurkumiinin vaikutukset lyhytaikaiseen avaruus- ja tunnistusmuistiin, aikuisten neurogeneesiin ja neuroinflammaatioon streptozotokiini-indusoidussa Alzheimer-tyyppisen dementian rotta-mallissa. Käyttäytyminen. Brain Res. 335, 41-54. doi: 10.1016/j.bbr.2017.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Bensalem, S., Soubhye, J., Aldib, I., Bournine, L., Nguyen, A. T., Vanhaeverbeek, M., ym. mukaan (2014). Peganum harmala L. (Zygophyllaceae) alkaloidien aiheuttama myeloperoksidaasiaktiivisuuden esto. J. Ethnopharmacol. 154, 361-369. doi: 10.1016/j.jep.2014.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Isabelle, M., Cloutier, M., Hmamouchi, M. ja Khalil, A. (2006a). Peganum harmala L. -uutteen, harmiinin ja harmaliinin suojaavat vaikutukset ihmisen matalan tiheyden lipoproteiinin hapettumista vastaan. J. Pharm. Pharmacol. 58, 967-974. doi: 10.1211/jpp.58.7.0012
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Martín-Cordero, C., Khalil, A., Hmamouchi, M., Ettaib, A., Marhuenda, E., et al. (2006b). Peganum harmala L. siemenistä uutetun harmiinin ja harmaliinin vasorelaksanttiset vaikutukset eristetyssä rotan aortassa. Pharmacol. Res. 54, 150-157. doi: 10.1016/j.phrs.2006.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohnen, N. I., Kaufer, D. I., Hendrickson, R., Ivanco, L. S., Lopresti, B. J., Koeppe, R. A., et al. (2005). Aivokuoren asetyylikoliiniesteraasiaktiivisuuden eston aste ja donepetsiilihoidon kognitiiviset vaikutukset Alzheimerin taudissa. J. Neurol. Neurosurg. Psychiatry 76, 315-319. doi: 10.1136/jnnp.2004.038729
PubMed Abstract | CrossRef Full Text | Google Scholar
Bromley-Brits, K., Deng, Y., and Song, W. H. (2011). Morrisin vesilabyrinttitesti Alzheimerin taudin mallihiirten oppimis- ja muistivajeiden selvittämiseksi. J. Vis. Exp. 53, 1-5. doi: 10.3791/2920
PubMed Abstract | CrossRef Full Text | Google Scholar
Corso, G., Cristofano, A., Sapere, N., La Marca, G., Angiolillo, A., Vitale, M., et al. (2017). Seerumin aminohappoprofiilit normaaleilla henkilöillä ja potilailla, joilla on Alzheimerin dementia tai joilla on riski sairastua siihen. Dement. Geriatr. Cogn. Dis. Extra 7, 143-159. doi: 10.1159/000466688
PubMed Abstract | CrossRef Full Text | Google Scholar
Coyle, J. T., Price, D. L., and Delong, M. R. (1983). Alzheimerin tauti: aivokuoren kolinergisen innervaation häiriö. Science 219, 1184-1190. doi: 10.1126/science.6338589
CrossRef Full Text | Google Scholar
Demirci, K., Nazıroğlu, M., Övey,İ. S., and Balaban, H. (2017). Seleeni vaimentaa apoptoosia, tulehdusta ja oksidatiivista stressiä ikääntyneiden rottien veressä ja aivoissa, joilla on skopolamiinin aiheuttama dementia. Metab. Brain Dis. 32, 321-329. doi: 10.1007/s11011-016-9903-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, L. Y., and Chiu, M. J. (2014). Yhdistelmähoito ja nykyiset käsitteet sekä tulevaisuuden strategiat Alzheimerin taudin hoidossa. Neuropsychiatr. Dis. Treat. 10, 439-451. doi: 10.2147/NDT.S45143
PubMed Abstract | CrossRef Full Text | Google Scholar
Frison, G., Favretto, D., Zancanaro, F., Fazzin, G. ja Ferrara, S. D. (2008). Tapaus beetakarboliinialkaloidimyrkytyksestä Peganum harmala -siemenuutteen nauttimisen jälkeen. Forensic Sci. Int. 179, 37-43. doi: 10.1016/j.forsciint.2008.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghumatkar, P. J., Patil, S. P., Jain, P. D., Tambe, R. M., ja Sathaye, S. (2015). Floretiinin nootrooppiset, neuroprotektiiviset ja neurotrofiset vaikutukset skopolamiinin aiheuttamassa muistinmenetyksessä hiirillä. Pharmacol. Biochem. Behav. 135, 182-191. doi: 10.1016/j.pbb.2015.06.005
PubMed Abstract | CrossRef Full Text | Google Scholar
González-Domínguez, R., García-Barrera, T. ja Gómez-Ariza, J. L. (2015). Metaboliittiprofilointi Alzheimerin taudin muuttuneiden aineenvaihduntareittien tunnistamiseksi. J. Pharm. Biomed. Anal. 107, 75-81. doi: 10.1016/j.jpba.2014.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Goverdhan, P., Sravanthi, A., ja Mamatha, T. (2012). Meloksikaamin ja selegiliinin neuroprotektiiviset vaikutukset skopolamiinin aiheuttamassa kognitiivisessa heikentymisessä ja oksidatiivisessa stressissä. Int. J. Alzheimers Dis. 2012, 1-8. doi: 10.1155/2012/974013
PubMed Abstract | CrossRef Full Text | Google Scholar
Gray, E., Thomas, T. L., Betmouni, S., Betmouni, S., Scolding, N. ja Love, S. (2008). Myeloperoksidaasin kohonnut aktiivisuus ja mikrogliaalinen ilmentyminen demyelinoidussa aivokuoressa multippeliskleroosissa. Brain Pathol. 18, 86-95. doi: 10.1111/j.1750-3639.2007.00110.x
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Wu, H., Wei, Y., Liu, W., Huang, F., Shi, H. L., et al. (2015a). Harmiinin, asetyylikoliiniesteraasin estäjän, vaikutukset APP/PS1-siirtogeenisten hiirten ja skopolamiinin aiheuttamien muistihäiriöisten hiirten avaruudelliseen oppimiseen ja muistiin. Eur. J. Pharmacol. 768, 96-107. doi: 10.1016/j.ejphar.2015.10.037
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Zhang, L., Liu, L., Wu, X. J., Cheng, X. M. ja Wang, C. H. (2015b). Peganum harmalan siemenistä peräisin olevat kokonaisalkaloidit parantavat hiirten oppimiskykyä ja muistia. Chin. Tradit. Pat. Med. 37, 478-482.
Heneka, M. T., Carson, M. J., El Khoury, J., Landreth, G. E., Brosseron, F., Feinstein, D. L., et al. (2015). Neuroinflammaatio Alzheimerin taudissa. Lancet Neurol. 14, 388-405. doi: 10.1016/S1474-4422(15)70016-5
CrossRef Full Text | Google Scholar
Herraiz, T., Gonzalez, D., Ancin-Azpilicueta, C., Arán, V. J., and Guillén, H. (2010). Peganum harmalan beetakarboliinialkaloidit ja ihmisen monoamiinioksidaasin (MAO) estäminen. Food Chem. Toxicol. 48, 839-845. doi: 10.1016/j.fct.2009.12.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Jang, Y. J., Kim, J., Shim, J., Kim, C. Y., Kim, C. Y., Jang, J. H., Lee, K. W., et al. (2013). Kofeiiniton kahvi ehkäisee skopolamiinin aiheuttamaa muistin heikkenemistä rotilla. Behav. Brain Res. 245, 113-119. doi: 10.1016/j.bbr.2013.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. J., Kim, B., Kim, B., Park, H. J., Zhang, J. B., J. B., Kwon, Y., Kim, D. H. ym. et al. (2017). 1-palmitoyyli-2-linoleoyyli-3-asetyyliglyserolin parantava vaikutus skopolamiinin aiheuttamaan muistihäiriöön asetyylikoliiniesteraasin eston ja LTP-aktivoinnin kautta. Behav. Brain Res. 324, 58-65. doi: 10.1016/j.bbr.2017.01.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, B. (2016). Tutkimus Peganum harmalan alkaloidien kulkeutumisesta veri-aivoesteen läpi ja niiden vaikutuksen mekanismi rottien aivojen välittäjäaineisiin. Doctor dissertation, Shanghai University of Traditional Chinese Medicine, Shanghai.
Jiménez, J., Riveron-Negrete, L., Abdullaev, F., Espinosa-Aguirrec, J., and Rodríguez-Arnaiza, R. (2008). β-karboliinialkaloidien harmiinin ja harmaliinin sytotoksisuus ihmisen solumäärityksissä in vitro. Exp. Toxicol. Pathol. 60, 381-389. doi: 10.1016/j.etp.2007.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Kaur, R., Singh, V., and Shri, R. (2017). Ganoderma-lajien antiamnestiset vaikutukset: mahdollinen kolinerginen ja antioksidanttinen mekanismi. Biomed. Pharmacother. 92, 1055-1061. doi: 10.1016/j.biopha.2017.06.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Kouémou, N. E., Taiwe, G. S., Moto, F. C. O., Pale, S., Gwladys, N. T., Njapdounke, J. S. K., et al. (2017). Dichrocephala integrifolian nootrooppiset ja neuroprotektiiviset vaikutukset Alzheimerin taudin skopolamiinihiirimalliin. Front. Pharmacol. 8:847. doi: 10.3389/fphar.2017.00847
CrossRef Full Text | Google Scholar
Kumar, A., and Singh, A. (2015). Katsaus Alzheimerin taudin patofysiologiaan ja sen hoitoon: päivitys. Pharmacol. Rep. 67, 195-203. doi: 10.1016/j.pharep.2014.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, S. H., Lee, H. K., Lee, H. K., Kim, J. A., Hong, S. I., Kim, H. C., Jo, T. H., et al. (2010). Klorogeenihapon neuroprotektiiviset vaikutukset skopolamiinin aiheuttamaan muistinmenetykseen asetyylikoliiniesteraasin vastaisen ja antioksidatiivisen toiminnan kautta hiirillä. Eur. J. Pharmacol. 649, 210-217. doi: 10.1016/j.ejphar.2010.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, H. E., Jeon, S. J., Ryu, B., Park, S. J., Ko, S. Y., Lee, Y., et al. (2016). Swertisiini, C-glukosyyliflavoni, parantaa skopolamiinin aiheuttamaa muistin heikkenemistä hiirillä sen adenosiini A1-reseptorin antagonistisella ominaisuudella. Behav. Brain Res. 306, 137-145. doi: 10.1016/j.bbr.2016.03.030
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, S., Kim, J., Seo, S. G., Choi, B. R., Han, J. S., Lee, K. W., et al. (2014). Sulforafaani lievittää skopolamiinin aiheuttamaa muistin heikkenemistä hiirillä. Pharmacol. Res. 85, 23-32. doi: 10.1016/j.phrs.2014.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Liu, Y., Li, W., Wang, Z., Guo, P., Li, L., et al. (2018). Ginsenosidi Re: n vaikutusten metabolinen profilointi Alzheimerin taudin hiirimallissa. Behav. Brain Res. 337, 160-172. doi: 10.1016/j.bbr.2017.09.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Cheng, X. M., and Wang, C. H. (2017a). Katsaus Peganum-suvun perinteisiin käyttötarkoituksiin, fytokemiaan, farmakologiaan, farmakokinetiikkaan ja toksikologiaan. J. Ethnopharmacol. 203, 127-162. doi: 10.1016/j.jep.2017.03.049
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Zhang, Y. P., Zhang, Y. P., G., Deng, G., Wang, W. W. Y. W., Qi, L. L. S. L., Cheng, M. M. X. M. ym. et al. (2017b). Analogisten β-karboliinialkaloidien harmaliinin ja harmiinin altistumisominaisuudet monilääkeresistenssiproteiini 2:n effluksikuljettajan perusteella. Front. Pharmacol. 8:541. doi: 10.3389/fphar.2017.00541
CrossRef Full Text | Google Scholar
Lin, J. J., Huang, L., Yu, J., Xiang, S. Y., Wang, J. L., Zhang, J. R., et al. (2016). Fukoksantiini, merellinen karotenoidi, kumoaa skopolamiinin aiheuttamat kognitiiviset haitat hiirillä ja estää asetyylikoliiniesteraasia in vitro. Mar. Drugs 14:67. doi: 10.3390/md14040067
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, M. T., and Beal, M. F. (2006). Mitokondrioiden toimintahäiriö ja oksidatiivinen stressi neurodegeneratiivisissa sairauksissa. Nature 443, 787-795. doi: 10.1038/nature05292
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, W., Yang, Y. D., Cheng, X. M., Gong, C., Li, S. P., He, D. D., et al. (2014). Asetyyli- ja butyylikoliiniesteraasi-inhibiittorien inhiboivien aktiivisuuksien nopea ja herkkä havaitseminen UPLC-ESIMS/MS:llä. J. Pharm. Biomed. Anal. Peganum harmalan antenniosista saadun uutteen ja alkaloidifraktioiden antiamnestinen vaikutus skopolamiinin aiheuttamiin muistihäiriöihin hiirillä. J. Ethnopharmacol. 204, 95-106. doi: 10.1016/j.jep.2017.04.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Louis, E. D., Jiang, W., Gerbin, M., Mullaney, M. M. ja Zheng, W. (2010). Veren harmanen- ja harmiinipitoisuuksien välinen suhde familiaalisessa essentiaalisessa vapinassa, sporadisessa essentiaalisessa vapinassa ja kontrolleissa. Neurotoxicology 31, 674-679. doi: 10.1016/j.neuro.2010.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, C., Dong, L. M., Lv, J. W., Wang, Y., Fan, B., Wang, F., et al. (2018). 20(S)-protopanaxadioli (PPD) lievittää skopolamiinin aiheuttamaa muistin heikkenemistä kolinergisten ja antioksidanttisten järjestelmien säätelyn ja Egr-1: n, c-Fos: n ja c-Junin ilmentymisen kautta hiirissä. Chem. Biol. Interact. 279, 64-72. doi: 10.1016/j.cbi.2017.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Mahmoudian, M., Jalipour, H., ja Dardashti, P. S. (2002). Peganum harmalan myrkyllisyys: katsaus ja tapausselostus. Iran. J. Pharmacol. Ther. 1, 1-4.
Google Scholar
Malik, J., Kaur, J., and Choudhary, S. (2017). Lactuca sativa Linn. ja sen fraktioiden standardoitu uute kumoaa skopolamiinin aiheuttaman muistinmenetyksen hiirillä: mahdollinen kolinerginen ja antioksidanttinen mekanismi. Nutr. Neurosci. 1-12. doi: 10.1080/1028415X.2017.1291166 .
PubMed Abstract | CrossRef Full Text | Google Scholar
Morris, R. G., Garrud, P., Rawlins, J. A., and O’Keefe, J. (1982). Paikkanavigointi heikentynyt rotilla, joilla on hippokampusvaurio. Nature 297, 681-683. doi: 10.1038/297681a0
CrossRef Full Text | Google Scholar
Nilsen, L. H., Melø, T. M., Sæther, O., Witter, M. P., and Sonnewald, U. (2012). Muuttunut neurokemiallinen profiili Alzheimerin taudin McGill-R-Thy1-APP-rotan mallissa: pitkittäinen in vivo 1H MRS-tutkimus. J. Neurochem. 123, 532-541. doi: 10.1111/jnc.12003
PubMed Abstract | CrossRef Full Text | Google Scholar
Oh, J. H., Choi, B. J., Chang, M. S., and Park, S. K. (2009). Nelumbo nuciferan siemenuute parantaa muistia rotilla, joilla on skopolamiinin aiheuttama muistinmenetys koliiniasetyylitransferaasin ilmentymisen induktion kautta. Neurosci. Lett. 461, 41-44. doi: 10.1016/j.neulet.2009.05.045
PubMed Abstract | CrossRef Full Text | Google Scholar
Patel, K., Gadewar, M., Tripathi, R., Prasad, S. K. ja Patel, D. K. (2012). Katsaus beetakarboliinialkaloidin ”Harmine” lääketieteelliseen merkitykseen, farmakologiseen aktiivisuuteen ja bioanalyyttisiin näkökohtiin. Asian Pac. J. Trop. Biomed. 2, 660-664. doi: 10.1016/S2221-1691(12)60116-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Rijpma, A., Meulenbroek, O., ja Rikkert, M. O. (2014). Kolinesteraasin estäjät ja lisäravinteet Alzheimerin taudissa: satunnaistettujen kontrolloitujen tutkimusten systemaattinen katsaus. Ageing Res. Rev. 16, 105-112. doi: 10.1016/j.arr.2014.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Saxena, G., Singh, S. P., Agrawal, R., and Nath, C. (2008). Donepetsiilin ja takriinin vaikutus oksidatiiviseen stressiin intraserebraalisessa streptotsotsiinin aiheuttamassa dementian mallissa hiirillä. Eur. J. Pharmacol. 581, 283-289. doi: 10.1016/j.ejphar.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Scali, C., Prosperi, C., Giovannelli, L., Bianchi, L., Pepeu, G., ja Casamenti, F. (1999). β (1-40) Amyloidipeptidin injektio rottien nucleus basalikseen indusoi mikrogliareaktion ja tehostaa aivokuoren γ-aminovoihapon vapautumista in vivo. Brain Res. 831, 319-321. doi: 10.1016/S0006-8993(99)01492-4
CrossRef Full Text | Google Scholar
Shi, X. Y., Liu, W., Zhang, L., Li, S. P., Cheng, X. M., Xi, Y., et al. (2014). Harmaliinin, harmiinin ja niiden metaboliittien farmakokinetiikka rotilla, joille on annettu Peganum harmala L. Chin:n alkaloidien kokonaisuutteita. Tradit. Pat. Med. 36, 1169-1175. doi: 10.3969/j.issn.1001-1528.2014.06.013
CrossRef Full Text | Google Scholar
Singh, S., Kaur, H., and Sandhir, R. (2016). Fraktaaliset ulottuvuudet: uusi paradigma avaruudellisen muistin ja oppimisen arvioimiseksi Morrisin vesilabyrintin avulla. Behav. Brain Res. 299, 141-146. doi: 10.1016/j.bbr.2015.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Svob Strac, D., Muck-Seler, D. ja Pivac, N. (2015). Neurotransmitterimittaukset Alzheimerin tautia sairastavien potilaiden aivo-selkäydinnesteessä: katsaus. Psychiatr. Danub. 27, 14-24.
Google Scholar
Tse-Susanna, Y. H., Mak, I. T., and Dickens, B. F. (1991). Harmaanin ja β-karboliinialkaloidien antioksidatiiviset ominaisuudet. Biochem. Pharmacol. 42, 459-464. doi: 10.1016/0006-2952(91)90305-O
CrossRef Full Text | Google Scholar
Vermeiren, Y., Van Dam, D., Aerts, T., Engelborghs, S., and De Deyn, P. P. (2014). Monoaminergiset välittäjäaineiden muutokset kuolemanjälkeisillä aivoalueilla masentuneilla ja aggressiivisilla Alzheimerin tautia sairastavilla potilailla. Neurobiol. Aging 35, 2691-2700. doi: 10.1016/j.neurobiolaging.2014.05.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Verri, M., Pastoris, O., Dossena, M., Aquilani, R., Guerriero, F., Cuzzoni, G., ym. et al. (2012). Mitokondriomuutokset, oksidatiivinen stressi ja neuroinflammaatio Alzheimerin taudissa. Int. J. Immunopathol. Pharmacol. 25, 345-353. doi: 10.1177/039463201202500204
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, C. H., Zhang, Z. X., Wang, Y. H., and He, X. J. (2015). Sytotoksiset indolialkaloidit ihmisen leukemiasolulinjoja vastaan myrkyllisestä Peganum harmala -kasvista. Toxins 7, 4507-4518. doi: 10.3390/toxins7114507
PubMed Abstract | CrossRef Full Text | Google Scholar
Weng, R., Shen, S. S., Tian, Y. L., Burton, C., Xu, X. Y., Liu, Y., et al. (2015). Metabolomiikan lähestymistapa paljastaa integroidun metabolisen verkon, joka liittyy serotoniinin puutteeseen. Sci. Rep. 5:11864. doi: 10.1038/srep11864
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshiyama, Y., Kojima, A., Ishikawa, C., and Arai, K. (2010). Donepetsiilin anti-inflammatorinen vaikutus parantaa tau-patologiaa, synaptista menetystä ja neurodegeneraatiota tauopatia-hiirimoodissa. J. Alzheimers Dis. 22, 295-306. doi: 10.3233/JAD-2010-100681
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, L. (2013). Tutkimus Peganum harmalan kokonaisalkaloidien kalvopäällysteisistä tableteista. Master Dissertation, Shanghai University of Traditional Chinese Medicine, Shanghai.
Zhao, T., Ding, K. M., Zhang, L., Cheng, X. M., Wang, C. H., and Wang, Z. T. (2013). Peganum-suvun kasveista peräisin olevien β-karboliini- ja kinoliinialkaloidijohdannaisten asetyylikoliiniesteraasia ja butyylikoliiniesteraasia estävät vaikutukset. J. Chem. 2013:717232. doi: 10.1155/2013/717232
CrossRef Full Text | Google Scholar
Zhou, X. L., Li, Y. F., Shi, X. Z., and Ma, C. (2016). Katsaus amyloidi β -tasoa Alzheimerin taudissa vaimentaviin terapeuttisiin lääkkeisiin: neurotransmission, tulehduksen, oksidatiivisen stressin ja kohonneiden kolesterolitasojen kohdentaminen. Am. J. Transl. Res. 8, 246-269.
PubMed Abstract | Google Scholar
.
Leave a Reply