Burkholderia cepacia -kompleksi-infektio aikuisten kystisen fibroosin yksikössä Madridissa | Enfermedades Infecciosas y Microbiología Clínica
Esittely
Burkholderia cepacia -kompleksi (BCC) on noussut merkittäväksi taudinaiheuttajaksi kystistä fibroosia sairastavilla potilailla cepacia-oireyhtymän riskin (kuolemaan johtava nekrotisoiva keuhkokuume, johon liittyy bakteerikantahyökkäys) vuoksi, organismin synnynnäinen moniresistenssi antibiooteille ja bakteerikantojen tarttuvuus potilaiden välillä sosiaalisessa kontaktissa.1 CF-potilaiden läheinen ja pitkäaikainen kontakti ja yhteiset sumuttimet helpottavat BCC:n hankkimista ja leviämistä.2,3 On osoitettu, että BCC-bakteerien hankkiminen liittyy sairaalahoitoon ja ristiininfektioon sosiaalisen kontaktin kautta CF:ssä.
Burkholderia-suvun taksonomiaa on tarkistettu useaan otteeseen viime vuosikymmeninä. 1990-luvun puolivälissä ”B. cepacia” -kantojen osoitettiin kuuluvan ainakin viiteen eri lajiin, joita kutsuttiin yhdessä B. cepacia -kompleksiksi.4 Taksonomiset lisäanalyysit paljastivat, että BCC:n sisällä oli vielä useampia lajeja, ja tällä hetkellä on kuvattu 17 B. cepacia -kompleksin lajia4-7: B. cepacia, B. multivorans, B. cenocepacia, B. stabilis, B. vietanmiensis, B. dolosa, B. ambifaria, B. anthina, B. pyrrocinia, B. ubonensis, B. latens, B. diffusa, B. arboris, B. seminalis, B. metallica, B. lata ja B. contaminans8 .
B. ubonensis -lajia lukuun ottamatta kaikkia näitä lajeja on eristetty CF-potilaiden ysköksistä,6,7 B. cenocepacia ja B. multivorans ovat vallitsevia.9
B. cenocepacia jakautuu neljään alatyyppiin (IIIa, IIIb, IIIc ja IIId), joita koodataan neljällä geenin recA:n alleelilla, ja kantojen frekvenssissä ja virulenssissa on eroja. Lisäksi B. cenocepacia -bakteeria pidetään yhtenä vakavimmista patogeeneistä, koska siihen liittyy usein heikentynyt eloonjäämisikä ja suurin riski sairastua kuolemaan johtavaan cepacia-oireyhtymään.10 B. cenocepacia -bakteerilajit ovat luontaisesti resistenttejä monille antibiooteille, kuten aminoglykosideille ja polymysiini B:lle, ja ne vaativat usein yhdistelmähoitoa, jotta infektio saadaan tukahdutettua CF:n yhteydessä.11
BCC-bakteerien aiheuttamat infektiot CF-potilailla korreloivat usein lisääntyneeseen sairastuvuuteen ja kuolleisuuteen, ja näiden organismien synnynnäinen resistenssi useille eri antibiooteille vaikeuttaa infektoituneiden potilaiden hoitoa.12,13 Resistenssi johtuu useista eri mekanismeista, kuten rajoitetusta läpäisevyydestä, muutoksista lipopolysakkaridirakenteessa ja useiden monilääkeainepoistopumppujen läsnäolosta, indusoitavista kromosomaalisista beetalaktamaaseista ja muuttuneista penisilliiniin sitoutuneista proteiineista. Lisäksi useilla B. cepacia -kompleksin kannoilla on kuvattu in vitro biofilmin muodostumista, mikä voi osaltaan edistää niiden kykyä selviytyä CF-keuhkoympäristössä tarjoamalla lisäsuojaa antibiootteja vastaan.14-16
BCC-infektoituneiden potilaiden hoidon tulisi perustua mieluiten herkkyystestien tuloksiin, ja siihen kuuluu usein yhdistelmähoito, jossa käytetään kahta tai kolmea antibioottia, joilla on synergistinen teho.12,17,18BCC-kannoilla tehdyt in vitro -herkkyystutkimukset osoittavat, että keftatsidiimin, siprofloksasiinin, meropeneemin, tetrasykliinien tai suurten tobramysiiniannosten murtopistepitoisuuksilla on bakteriostaattinen teho huomattavaa osaa näistä kannoista vastaan.19-21 Tämän vuoksi näitä antibiootteja käytetään usein BCC-infektoituneiden CF-potilaiden hoitoon. Lisäksi kotrimoksatsolia käytetään edelleen usein kroonisten BCC-infektioiden hoidossa, vaikka näiden täydentävien antibioottien herkkyystestit osoittivat, että niiden teho monia BCC-kantoja vastaan on heikko18,22.
Tämän tutkimuksen tavoitteena oli arvioida BCC:n isolaatit ja herkkyys ja analysoida kliinisiä vaikutuksia.
Menetelmät
Kuumefaattista infektiota sairastavien potilaiden yskökset analysoitiin lopullisten BCC-isolaattien löytämiseksi La Princesan sairaalan aikuisten CF-yksikössä, joka on toiminut maaliskuusta 1997 lähtien. Nämä näytteet käsiteltiin mikrobiologian osastolla vakiomenettelyllä23; käytimme spesifistä selektiivistä elatusainetta ja kvantitatiivista raitaa käyttäen perinteistä näytteen sarjalaimennusmenettelyä. Yskökset homogenisoitiin N-asetyylikysteiinillä ennen viljelyä. Laboratoriossamme käytetyt elatusaineet olivat: veriagar, bakitrasiini-suklaaagar, manitolisuolaagar, MacConkey-agar, Sabouraud-kloranfenikoliagar ja B. cepacia -bakteerin selektiivinen elatusaine BCSA (Biomèrieux). Levyjen inkubaatioaika oli 3-5 päivää 35 °C:ssa. Bacitracin chocolate agar inkuboitiin CO2-ilmakehässä.
BCC-kantojen alustava tunnistaminen suoritettiin MicroScanilla (Siemens) ja Api 20 NE:llä (Biomerieux). Nämä toimenpiteet suoritettiin valmistajan suositusten mukaisesti.24
Sen jälkeen kannat lähetettiin Centro Nacional de Microbiología -laitokseen (Majadahonda, Madrid) lajin ja genotyypin vahvistamista ja määrittämistä varten. Tässä tutkimuksessa käytettiin seuraavia menetelmiä: Api 20 NE (biomerieux, Marcy l’Etoile) ja GN2 Microplate (BIOLOG, Hayward, CA) sekä molekyylimenetelmät. Kaikki menetelmät suoritettiin valmistajan suositusten mukaisesti.
Kromosomaalisen DNA:n uutto
DNA:n uutto suoritettiin kaupallisella QIAamp DNA Mini Kit -kitillä (QIAGEN, GmbH, Hilden, Saksa) valmistajan ohjeiden mukaisesti.
PCR-analyysi
Geenien monistaminen suoritettiin 25μl:n lopullisessa tilavuudessa käyttäen PuReTaq Ready-To-Go PCR Beads -kittiä (Amersham Biosciences, Buckinghamshire, Yhdistynyt kuningaskunta), joka sisälsi 5μl uutettua DNA:ta ja 10 pmol kutakin aluketta: fD1 ja rP225 16S rDNA:n osalta ja BCR1 ja BCR426 recA:n osalta. Lämpösyklitys suoritettiin TaKaRa PCR Thermal Cycler v. III mod TP600:ssa (TAKARA BIO Inc., Otsu, Shiga) seuraavissa olosuhteissa 16S rDNA:n osalta: 94 °C 5 minuutin ajan ensimmäisen syklin aikana, 35 sykliä, joissa 15 sekuntia 94 °C:n lämpötilassa, 15 sekunnin ajan 55 °C:n lämpötilassa tapahtuva hehkutus ja pidennys 72 °C:n lämpötilassa 1 minuutti ja 50 sekuntia. Olosuhteet recA:n monistamiseksi olivat seuraavat:
Visualisoimme 2μl kutakin PCR-tuotetta agaroosigeelielektroforeesilla, jossa agaroosikonsentraatio oli säädetty 1,5 %:iin ja jossa käytettiin 1 × TAE-puskuria. Kaikissa geeleissä oli molekyylikokomarkkereita: Marker X 0,07-12,2 kbp (Roche Applied Sciences, Mannheim, Saksa) ja GeneRuler 100bp DNA Ladder (Fermentas GmbH, St. Leon-Rot, Saksa) 16s rDNA- ja recA-tuotteille.
B. cenocepacia -bakteeriksi tunnistetuille kannoille tehtiin PCR-menetelmä RecA-IIIA-ryhmän (BCRG3A1 ja BCRG3A2) ja RecA-IIIB-ryhmän (BCRG3B1 ja BCRG3B2) spesifisillä alukkeilla aiemmin kuvatuissa olosuhteissa.24
Kymmenen μl PCR-tuotteita visualisoitiin agaroosigeelielektroforeesilla samoissa edellä kuvatuissa olosuhteissa.
Nukleotidisekvenssianalyysi
16s rDNA:n ja recA:n PCR-tuotteet sekvensoitiin käyttäen alukkeina fD1:tä ja rP2:ta sekä BCR1:tä. Sekvensointireaktiot valmistettiin Big Dye Terminator v 3.1:llä (Applied Biosystem, Yhdysvallat) 10μl:n lopputilavuudessa valmistajan ohjeiden mukaisesti ja analysoitiin ABI PRISM 3100 -geenianalysaattorin kapillaarielektroforeesijärjestelmällä (Applied Biosystem, Yhdysvallat). Sekvenssit koottiin SeqMan 3.61 -ohjelmistolla (DNA Star, Inc, Madison, WI, USA). Analyysissä käytettiin myös Basic Local Alignment Search Tool -ohjelmaa (BLAST: www.ncbi.nlm.nih.gov) oikean geenin identiteetin selvittämiseksi.
PFGE-analyysi
Kantojen suhde analysoitiin pulssikenttägeelielektroforeesilla (PFGE). Tulppien valmistelu, lyysi, solujen pesu ja restriktiomädätys suoritettiin aiemmin kuvatulla tavalla25,26 pienin eroin. Käytettiin restriktioentsyymiä XbaI (40U, Fermentas GmbH, St. Leon-Rot, Saksa). PFGE suoritettiin Valdezate et al:n Stenotrophomonas maltophilia -bakteerille kuvaaman protokollan27 mukaisesti käyttäen DRIII Chef System -järjestelmää (Bio-Rad Laboratories, Hercules, Yhdysvallat) ja molekyylipainomarkkerina lambda-faagin konsentraattoreita (Biolabs, New England, Yhdistynyt kuningaskunta). Kuvat saatiin Quantity One v. 4.6.1 -ohjelmistolla (BioRad). Kuvien analysointi suoritettiin visuaalisesti, ja isolaatteja pidettiin genotyyppisesti erottamattomina, jos niillä oli identtinen kaistakuvio.
Antibioottiherkkyys suoritettiin mikrolaimennuksella MicroScanilla ja levydiffuusiolla samanaikaisesti. Molempia menetelmiä pidettiin CLSI:n taitekohtina.28 Siprofloksasiinin ja imipeneemin osalta käytettiin vastaavasti levofloksasiinin ja meropeneemin taitekohtia. Seuraavia antibiootteja tutkittiin: keftatsidiimi, siprofloksasiini, levofloksasiini, kotrimoksatsoli, minosykliini, imipeneemi ja meropeneemi.
Potilaita, joilla oli BCC, tutkittiin seuraavien muuttujien avulla: ikä (alussa ja tällä hetkellä), sukupuoli, paino (alussa ja tällä hetkellä), geenimutaatio Cystic Fibrosis Transmembrana Regulator, hengitystoiminnan kehittyminen, joka määritettiin prosenttiosuutena ensimmäisen sekunnin aikana uloshengitettävän tilavuuden teoreettisen arvon mukaan (FEV1) ensimmäisestä eristämisestä lähtien, sekä Brasfieldin ja Shawchmanin klinikoiden röntgenkuvaukset BCC:n eristämisen alkaessa ja nyt.
Ko-kolonisaatio muiden mikro-organismien kanssa arvioitiin.
Brasfieldin pistemäärä arvioitiin asteikolla 0-5 (matalasta korkeaan) radiologisten merkkien mukaan: ilmansulkeuma, lineaariset varjostumat, nodulaariset kystiset leesiot, segmentaalinen tai lobaarinen konsolidoituminen ja kokonaisvaikutelma vakavuudesta. Saatu kokonaispistemäärä vähennettiin 25:een. Pienin saavutettu arvo vastasi vakavampaa radiologiaa. Rintakehän radiologia ja sitä vastaava Brasfield-pistemäärä suoritettiin vuosittain.
Kliininen pistemäärä Shwachman arvioi 4 kohtaa, joiden kunkin maksimipistemäärä oli 25: yleinen aktiivisuus, fyysinen tutkimus, kasvu ja ravitsemus sekä rintakehän röntgenkuvaus. Ihanteellinen pistemäärä oli 100, ja potilaiden tila luokiteltiin pistemäärän mukaan: erinomainen (86-100 pistettä), hyvä (71-85 pistettä), lievä (56-70 pistettä), kohtalainen (40-55 pistettä) tai vakava (alle tai yhtä suuri kuin 40 pistettä).
Tulokset
BCC:tä eristettiin 12:lla 70:stä aikuisesta CF-potilaasta (17,1 %) 10 vuoden aikana. Kahdelle potilaalle oli tehty keuhkonsiirto, toinen heistä kuoli siirron jälkeen ja toisella BCC oli hävitetty vuonna 2005 ennen vuonna 2011 tehtyä siirtoa. Toisella potilaalla BCC hävitettiin vuonna 2009. Näitä potilaita tutkittiin vain muutaman kuukauden ajan, joten kliinistä kehitystä ei kirjattu. B. cenocepacia eristettiin neljältä potilaalta (33,3 %), B. contaminans kolmelta potilaalta (25 %), B. stabilis kahdelta potilaalta (16,7 %), B. vietnamiensis kahdelta potilaalta (16,7 %), B. cepacia yhdeltä potilaalta (8,3 %), B. multivorans yhdeltä potilaalta (8,3 %) ja B. lata yhdeltä potilaalta (8,3 %). B. cenocepacia -bakteerin alatyyppi IIIa tunnistettiin kahdella potilaalla neljästä (50 %) ja alatyyppi IIIb kahdella muulla potilaalla (50 %). Yhdellä potilaalla oli ensin B. cenocepacia ja sitten B. lata. Vastaavasti toisella potilaalla oli B. stabilis ja sitten B. contaminans. Tutkimuksessamme 50 %:lla BCC-potilaista oli Staphylococcus aureus -kantoja (taulukko 1).
Burkholderia cepacia -kompleksin eri lajien eristykset ja yhteiskolonisaatio muiden CF-taudinaiheuttajien kanssa potilailla, joilla esiintyi CF-tauti kroonisesti.
| Potilas | Isolaatio 1 | Isolaatio 2 | Ko-kolonisaatio | Havainnot | ||
| 1 | B. contaminans | H. influenzae | ||||
| 2 | B. cepacia | P. aeruginosa | ||||
| 3 | B. cenocepacia (sub. IIIa) | – | ||||
| 4 | B. multivorans | S. aureusH. influenzae | ||||
| 5 | B. vietnamiensis | S. aureus | ||||
| 6 | B. stabilis | S. aureus | ||||
| 7 | B. cenocepacia (sub. IIIb) | S. aureus | S. aureus | |||
| 8 | B. cenocepacia (sub. IIIb) | B. lata | P. aeruginosa | Hävinnyt | ||
| 9 | B. stabilis | B. contaminans | S. aureus | |||
| 10 | B. cenocepacia (sub IIIa) | – | Transplantoitu ja kuollut | |||
| 11 | B. vietnamiensis | S. aureus | Hävisi ja siirtyi | |||
| 12 | B. contaminans | – |
PFGE-analyysi osoittaa, että jokaisesta CF-potilaasta eristettiin sama kanta, mutta potilaskohtaisesti sama kanta oli erilainen, joten tämä varmentaa sen, että ristikkäistä verensiirtymää ei ole tapahtunut.
90 % BCC:stä oli herkkiä meropeneemille, 80 % kotrimoksatsolille, 60 % minosykliinille, 50 % keftatsidiimille ja 40 % levofloksasiinille, 20 % siprofloksasiinille ja 10 % imipeneemille.
50 % CF-potilaista oli miehiä, ja keski-ikä, jolloin näillä potilailla eristettiin ensimmäisen kerran BCC:tä, oli 24,4 vuotta (SD: 7,71). Potilaista 41,7 %:lla oli F508del/muu mutaatio, 33,3 %:lla F508del/F508-mutaatio ja 25 %:lla muu/muu mutaatio.
Aluksi Brasfieldin ja Shwachmanin pistemäärä laskettiin kaikille tähän tutkimukseen osallistuneille potilaille, ja keskimääräinen pistemäärä oli 18,6 ja 82,3. Nykyinen Brasfieldin ja Shwachmanin pistemäärä on kuitenkin suoritettu kolonisoituneilla potilailla. Keskimääräinen pistemäärä oli 21,1 ja 81. Vain yhdellä potilaalla oli diabetes ja kuudella potilaalla haiman vajaatoiminta. Taulukossa 2 on esitetty niiden CF-potilaiden kliiniset ominaisuudet, joilla oli BCC.
Kystistä fibroosia sairastavien potilaiden kliiniset ominaisuudet.
| Sukupuolen esiintyvyys (%) | |
| Mies | 6 (50 %) |
| Nainen. | 6 (50 %) |
| Iän keskiarvo (SD) | |
| Ensisijainen infektio (n=12) | 24.4 vuotta (7.71) |
| Nykyinen (n=9) | 29 vuotta (8.04) |
| Painon keskiarvo (SD) | |
| Primaari-infektio (n=12) | 57.9kg (8.5) |
| Nykyinen (n=9) | 58.7kg (8.6) |
| Mutaatiofrekvenssi (%) | |
| F508del/F508del (n=12) | 4 (33. 3%) |
| F508del/muu (n=12) | 5 (41.7 %) |
| Muu/muu (n=12) | 3 (25 %) |
| Brasfieldin pistekeskiarvo | |
| Ensisijainen infektio (n=12) | 18.6 |
| Nykyinen (n=9) | 21.1 |
| Shwachmanin pistekeskiarvo | |
| Ensisijainen infektio (n=12) | 82.3 |
| Nykyinen (n=9) | 81 |
| Diabeteksen yleisyys (%) | |
| Nykyinen (n=9) | 0 (0 %) |
| Pankreaty insuf. Frekvenssi (%) | |
| Nykyinen (n=9) | 6 (66.6 %) |
Kuvassa 1 on esitetty keuhkofunktioiden (%FEV1) kehittyminen niillä potilailla, joilla oli ollut yli BCC-eristys.
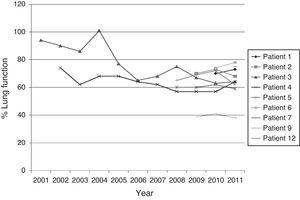
Kroonisten CF-potilaiden keuhkojen toiminnan kehitys BCC:n ensimmäisestä eristämisestä ysköksissä.
Keskustelu
Tutkimuksia, jotka liittyvät sellaisten potilaiden kliiniseen kehitykseen, joilla on eristetty BCC-lajia, on vähän, ja yleinen käsitys on, että B. cenocepacia -laji liittyy suurempaan sairastuvuuteen ja kuolleisuuteen CF-potilailla.19 Tämän vuoksi Espanjassa ei ole paljon tuoreita tietoja BCC:tä sairastavista potilaista. Hospital Universitario de Cruces -sairaalassa tehty tutkimus osoittaa, että kolonisaation esiintyvyys BCC:n kanssa on lisääntynyt.29
On tärkeää, että BCC-lajien tunnistaminen suoritetaan erikoistuneessa keskuksessa, koska fakultatiivit auttavat valvomaan näiden lajien kolonisoimien potilaiden tarkkaa seurantaa, koska nämä lajit voivat kehittyä haitallisesti.
Van Peltin ym. tekemästä tutkimuksesta käy ilmi, että API 20 NE:n havainto oli tarkempi kuin MicroScanin. API 20NE:llä tunnistettiin oikein 90 % isolaateista, kun taas MicroScanilla tunnistettiin oikein 68 %. He suosittelevat BCSA-levyjen käyttöä B. cepacia -bakteerin ensimmäiseen eristämiseen suoraan kliinisestä materiaalista. Näiden kasvualustojen herkkyys näytti olevan erinomainen (96 %); spesifisyys ei ollut 100 %. Oli melko silmiinpistävää havaita, että automaattisten määritysten, kuten MicroScanin, tarkkuus oli riittämätön. Tämän analyysin tärkein tulos on se, että molekyylitunnistus PCR-RFLP-analyysin avulla on parempi kuin biokemialliset ja mikrobiologiset lajintunnistusmenetelmät, joskin on korostettava, että API20 NE:llä saadut tulokset olivat tyydyttäviä30 .
Tutkimuksessamme B. cenocepacia, B. contaminans, B. vietnamiensis, B. stabilis, B. multivorans, B. cepacia ja B. lata eristettiin 12:n tutkittavan CF-potilaan hengitysteiden eritteistä, ja B. cenocepacia oli yleisimmin esiintyvä laji, kuten useimmissa CF-potilaita käsittelevässä eurooppalaisessa kirjallisuudessa kuvailluissa aineistoissa on kuvattu19. Tämä löydös ei kuitenkaan vastaa portugalilaista tutkimusta (Susana Correia et cols), jossa yleisimmät lajit olivat B. cepacia 57 % ja B. stabilis 13 %. Tämä saattaa johtua siitä, että käytettiin ei-steriilejä suolaliuoksia, jotka olivat luonnostaan B. cepacian saastuttamia.19 Infarmed havaitsi nämä saastuneet liuokset rutiininomaisen mikrobiologisen tarkastuksen yhteydessä.19 Tutkimuksessamme B. cepacia ja B. stabilis -bakteereja eristettiin pienemmässä määrin, kuten muissakin tutkimuksissa Euroopassa ja Amerikassa.19
B. cenocepacia -eristyksissä oli sama osuus B. cenocepacia -alatyyppien IIIa ja IIIb välillä.
Yksellä potilaista oli B. cenocepacia ensimmäisenä eristyksenä ja B. lata toisena eristyksenä, minkä jälkeen se hävisi. Toisella potilaalla oli B. vietnamiensis vuonna 2004, joka hävitettiin, ja hänelle tehtiin keuhkonsiirto vuonna 2011, ja toisella potilaalla eristettiin B. cenocepacia alatyyppi IIIa vuonna 2004, mutta hän kuoli samana vuonna keuhkonsiirron jälkeen. Keuhkonsiirron selviytymistulokset ovat huonoimmat potilailla, jotka ovat kolonisoituneet B. cenocepacia -bakteerin kanssa, joten jotkin elinsiirtoyksiköt vasta-aiheistavat elinsiirron tässä tapauksessa. On tunnustettu, että B. cenocepacialla on huonompi ennuste kuin B. multivoransilla, jonka elossaoloaika on lyhyempi, kun sitä verrataan Pseudomonas aeruginosa -kontrollilajeihin.31 Cepacia-oireyhtymästä on raportoitu molemmilla näillä lajeilla.26 Oireyhtymän tarkkaa patofysiologiaa ymmärretään huonosti, eikä tarkkaa kuolleisuuslukua ole tiedossa, vaikka sen uskotaankin lähentelevän 100:aa %:aa.32
Potilaillamme on alhaiset FEV1-arvot. Suurella osalla potilaista tilan tila oli huonontunut jo ennen BCC:n eristämistä muiden patogeenien aiheuttaman kolonisaation ja taudin etenemisen seurauksena. Kliinisesti vakaiden potilaiden FEV1-arvoissa ja ravitsemustilassa ei havaittu merkittäviä muutoksia. On näyttöä siitä, että keuhkojen kolonisaatiota ei välttämättä havaita tavanomaisilla viljelymenetelmillä jonkin aikaa (jopa 2 vuotta) BCC:n hankkimisen jälkeen.33 Lisäksi ei ole selvää, tapahtuuko ajoittaisessa eristämisessä uuden kannan aiheuttama uudelleeninfektio vai onko kyseessä alkuperäisen kannan uusiutuminen.20 Suurimmassa osassa tapauksista eri eristyksissämme ei havaittu alkuperäisten BCC-kantojen korvautumista.
Rekisteröitiin tapauksia, joissa sama kanta (samalla genotyypillä), joka tartutti potilasta sitkeästi useiden vuosien ajan, hävisi antibioottihoidolla tai sillä ei ollut ilmeistä vaikutusta muiden potilaiden kliiniseen kuvaan. Ei ole selvää, miksi eri BCC-lajien kannat eroavat toisistaan pysyvyydeltään, epidemiologialtaan ja patogeenipotentiaaliltaan CF:ssä ja miksi samoihin kantoihin voi liittyä hyvin erilaisia kliinisiä kehityssuuntia.19 Se riippuu kullekin yksittäiselle potilaalle luonteenomaisista tekijöistä, muiden patogeenien samanaikaisesta kolonisaatiosta ja muista tekijöistä, joita ei ole vielä selvitetty, mikä korostaa tämäntyyppisten tutkimusten tekemisen tärkeyttä.19
Antibioottiresistenssiä pidetään tärkeänä BCC-organismien virulenssitekijänä.14 Vaikka hoitoa ohjataan yleensä mikrobilääkeherkkyystestien perusteella, BCC-organismien hävittäminen onnistuu harvoin.21 Tämän epäonnistumisen selittämiseksi on esitetty useita hypoteeseja, mukaan lukien riittämättömät antibioottipitoisuudet tai antibiootin inaktivoituminen ysköksissä, CF-potilaiden heikentynyt isännän puolustuskyky, biofilmin muodostuminen, ”inokulum”-vaikutus ja näiden organismien kasvunopeus in vivo.34
Elke ym. raportoivat belgialaisessa tutkimuksessa, että meropeneemi, minosykliini ja keftatsidiimi olivat aktiivisimmat antibiootit BCC-eristystä vastaan ja siprofloksatsiinilla ja trimetopriimillä/sulfametoksatsolilla oli alhaisin aktiivisuus.35 Tutkimuksessamme havaittiin kuitenkin, että meropeneemi oli aktiivisin 90 %:n herkkyydellä, ja sen jälkeen tulivat trimetopriimillä/sulfametoksatsolilla 80 %:lla trimetopriimi/sulfametoksatsolilla 80 %:lla, minosykliinillä 60 %:lla minosykliiniä 50 %:lla keftatsidiimi. Vaikka BCC-organismit ovat tyypillisesti resistenttejä aminoglykosideille, suuret tobramysiiniannokset estivät suurimman osan testatuista kannoista. Nebuloitua tobramysiiniä, jonka huippupitoisuudet ysköksessä ovat korkeat, käytetään yhä useammin CF-potilaiden hoidossa.36-38
Siten nämä korkeammat pitoisuudet olisi otettava huomioon arvioitaessa tämän antibiootin käyttökelpoisuutta.35. Useat raportit vahvistavat, että sumutettu tobramysiini on erittäin lupaava BCC-infektoituneiden CF-potilaiden hoidossa: esimerkiksi Weidmann ym.39 kuvailivat äskettäin BCC-organismien täydellistä hävittämistä CF-potilaiden keuhkoista käyttämällä sumutetun tobramysiinin ja amiloridin yhdistelmää. Lisäksi sumutetun ja suonensisäisesti annettavan meropeneemin ja tobramysiinin yhdistelmähoito johti myös onnistuneeseen hoitoon naispuolisella CF-potilaalla, joka kärsi cepacia-oireyhtymästä, vaikka jälkimmäisen potilaan ysköksenäytteet jäivät positiivisiksi B. cenocepacia -bakteerin suhteen.39
BCC-lajit ovat luontaisesti vastustuskykyisiä monille antibiooteille, kuten aminoglykosideille ja polymysiini B:lle, ja ne vaativatkin usein yhdistelmähoitoa infektioiden tukahduttamiseksi CF:ssä.11 Antibiootteja polymysiiniä, gentamysiiniä ja vankomysiiniä käytetään suurina pitoisuuksina B. cepacia Selective Agarissa, joka on erittäin tehokas väliaine niiden eristämiseen CF:n ysköksistä.11 Nzula ym.13 vertasivat kuuden BCC-lajin antibioottiherkkyyttä ja totesivat, että se oli hyvin vaihtelevaa lukuun ottamatta synnynnäistä polymysiiniresistenssiä eikä liittynyt tutkittujen isolaattien taksonomiseen statukseen. Effluksin, kromosomaalisten beetalaktamaasien erittymisen ja BCC-bakteerien ulkokuoren läpäisemättömyyden on arveltu vaikuttavan antibioottiresistenssiin14 .
BCC-bakteerien biosidiresistenssin molekulaarista perustaa on sitä vastoin tutkittu vain vähän, vaikka nämä organismit on yhdistetty moniin desinfiointiaineiden ja muiden infektiovastaisten liuosten kontaminaatiotapauksiin.40
Kliinisen mikrobiologian rutiinilaboratorioille BCC-lajin tunnistaminen on erilainen tehtävä ja siten myös haaste. Selektiivisillä väliaineilla eristetyt kannat, jotka on alustavasti tunnistettu BCC:hen kuuluviksi kaupallisia järjestelmiä käyttäen, olisi vahvistettava kuvatuilla klassisilla biokemiallisilla testeillä.41
BCC:n varhainen toteaminen on erittäin tärkeää sekä CF-potilaan että CF-yhteisön kannalta. Tuore tutkimus5 osoitti kuitenkin, että alle puolet tutkimukseen osallistuneista yhdysvaltalaisista keskuksista käyttää B. cepacia -spesifisiä selektiivisiä elatusaineita tai inkuboi viljelmiä pitkiä aikoja, jotka molemmat parantavat tämän organismin saantia. Näiden ajanmukaisten viljelytekniikoiden käyttö ei ole teknisesti vaativaa, ja sen pitäisi olla odotettu hoitostandardi kaikissa CF-keskuksissa maailmanlaajuisesti.
Tässä tutkimuksessa hävitimme B. cenocepacia -bakteerin vain yhdeltä potilaalta; toinen potilas kuoli välittömästi elinsiirron jälkeen, eikä kummallakaan potilaalla ollut cepacia-oireyhtymää eikä hän kärsinyt merkittävästä kliinisen tilan heikkenemisestä, vaikka tarkkailujakso olikin lyhytaikainen, koska he hankkivat B. cepacia -bakteerin äskettäin.
BCC:n jäsenten ja muiden B. cepacian kaltaisten organismien aiheuttamien infektioiden parempi diagnosointi auttaa kliinisten lopputulostutkimusten tulosten tulkinnassa ja antaa siten ratkaisevaa tietoa kyseessä olevien tiettyjen kantojen patogeenisuudesta ja/tai tarttuvuudesta.5
Interintäristiriita
Kellään kirjoittajista ei ole ilmoitettavaa eturistiriidoista
.
Leave a Reply