¿Qué es la electronegatividad?
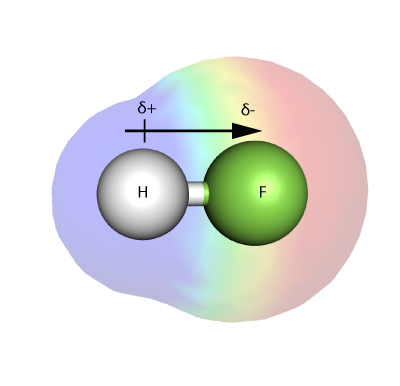
ELECTRONEGATIVIDAD
La electronegatividad es una medida de la fuerza con la que un átomo -en una molécula- es capaz de atraer electrones en un enlace hacia sí mismo.
Factores que afectan a la electronegatividad:
1) El número atómico
El número atómico es el número de protones en el núcleo de un átomo.
Determina las propiedades químicas de un elemento y su lugar en la tabla periódica.
Cuanto mayor sea el número atómico, más fuerte será la electronegatividad.
2) El radio atómico
El radio atómico de un elemento químico suele medirse por la distancia desde el centro del núcleo hasta el límite de la capa más externa de electrones.
Cuanto mayor es el radio atómico, más débil es la electronegatividad.
Ejemplo de radio atómico de un átomo de oxígeno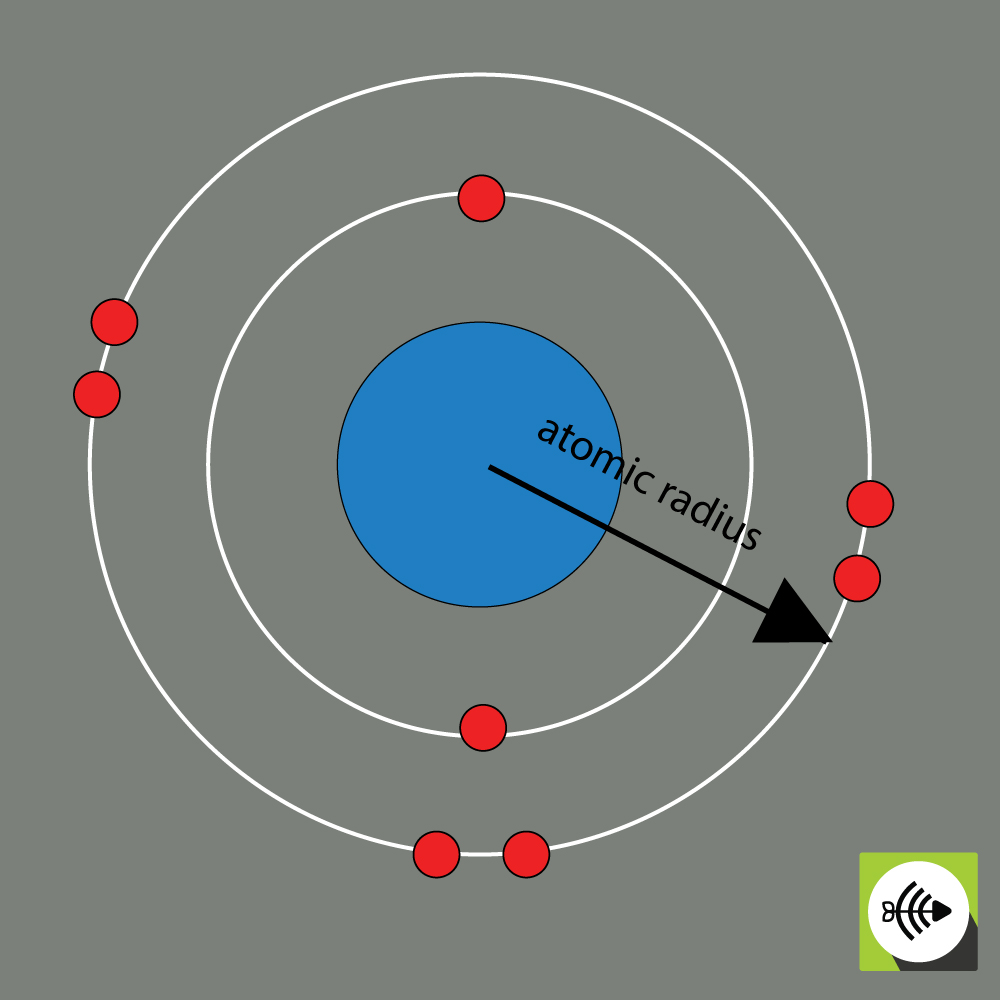
¿En qué se mide la electronegatividad?
La medida más común para la electronegatividad es la escala de Pauling, diseñada por el dos veces premio Nobel Linus Pauling. La escala de electronegatividad de los elementos indica la fuerza con la que cada elemento (en relación con los demás) puede atraer los electrones de enlace hacia sí mismo. Cuanto más alto sea el número de electronegatividad, más intentará el átomo atraer electrones hacia sí mismo.
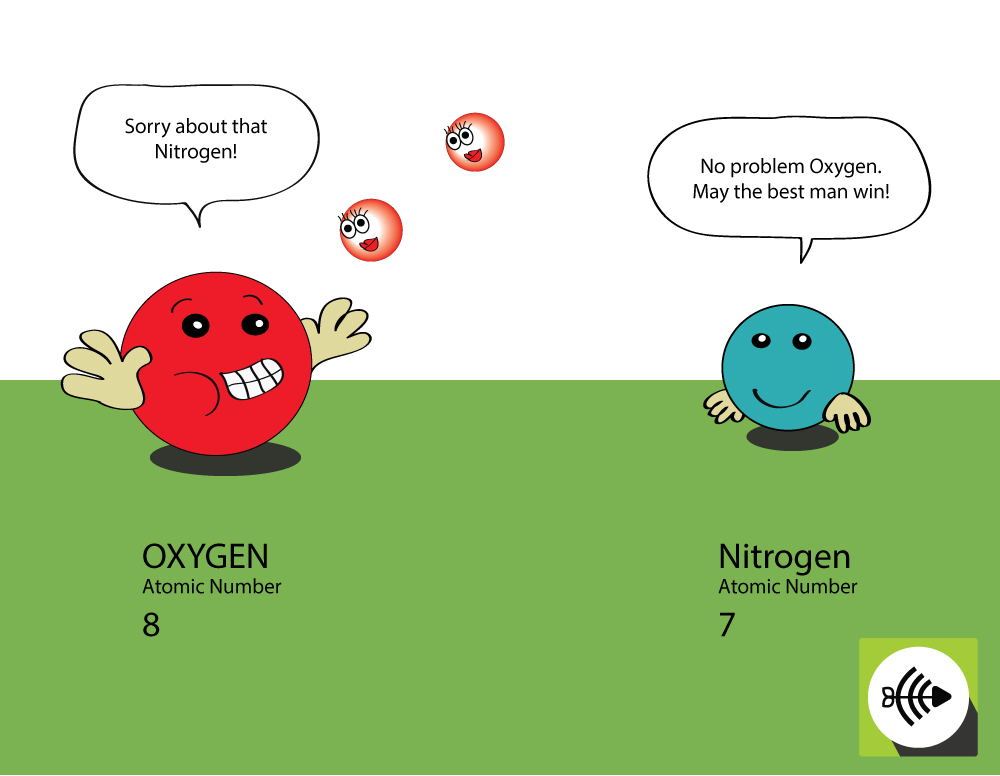
¿Por qué el oxígeno es más electronegativo que el nitrógeno?
El oxígeno es mayor en número atómico
- El oxígeno tiene 8 protones en el núcleo mientras que el nitrógeno sólo tiene 7.
- Un par de electrones de enlace experimentará más atracción desde el núcleo del oxígeno que desde el del nitrógeno, por lo que la electronegatividad del oxígeno es mayor.
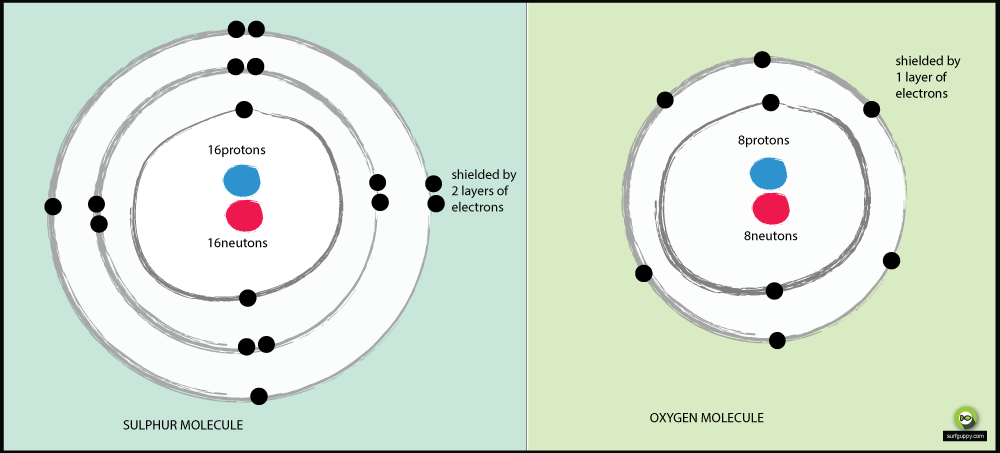
¿Por qué el azufre es menos electronegativo que el oxígeno?
Razones por las que el oxígeno es más electronegativo que el azufre:
- El oxígeno tiene 2 niveles de energía, el azufre tiene 3
- Los electrones de enlace del azufre están más alejados del núcleo del átomo
- Cuando los electrones de enlace están más alejados del núcleo del átomo, hay menos atracción desde el núcleo
- El par de electrones de enlace en el oxígeno experimentará más atracción desde su núcleo que los electrones de enlace del azufre
- Por lo tanto, el oxígeno es un átomo más electronegativo
Por favor, lea sobre los electrones de valencia antes de continuar. Electrones de valencia

El átomo más pequeño tiene una electronegatividad más alta
Tendencias de electronegatividad presentes en la tabla periódica
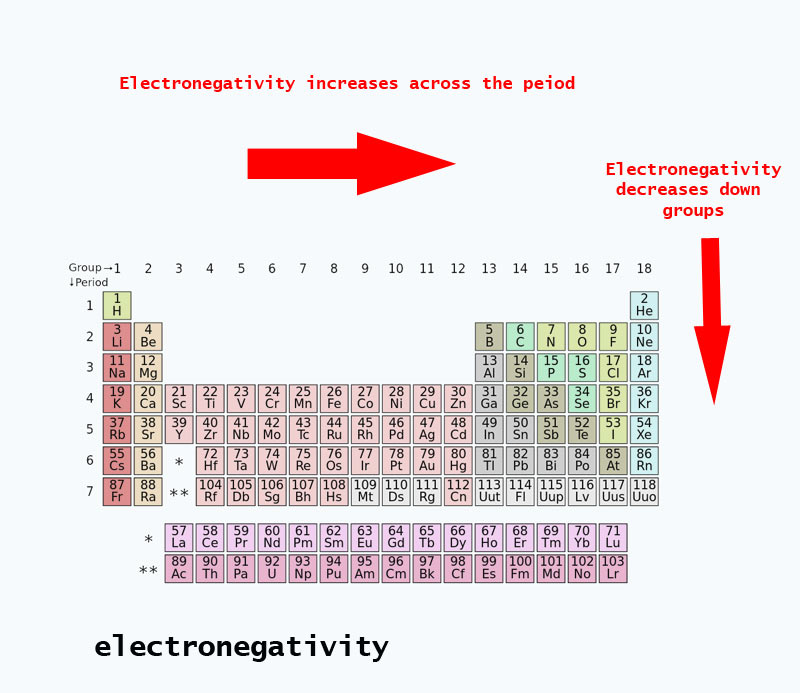
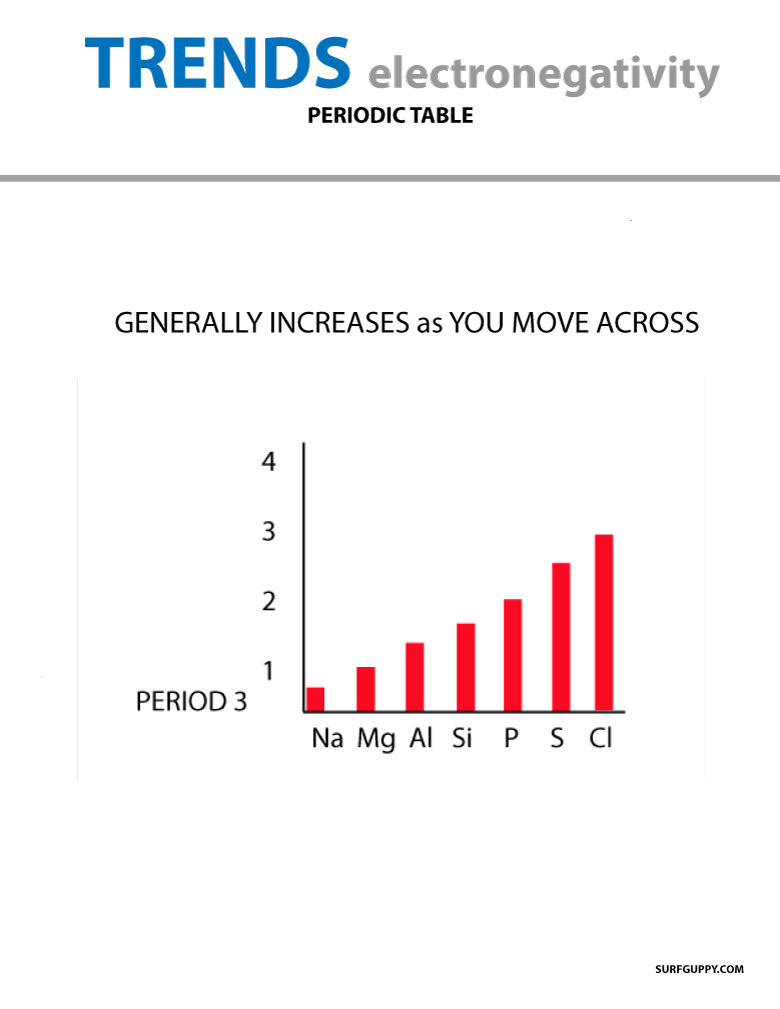
Cuando te mueves a través de la tabla periódica, el número de protones en el núcleo aumenta (sin aumentar el nivel de energía), por lo tanto la electronegatividad aumenta.
Cuando el número atómico aumenta hacia abajo en un grupo, también hay un aumento en los niveles de energía. El radio atómico es mayor por lo tanto la electronegatividad disminuye.
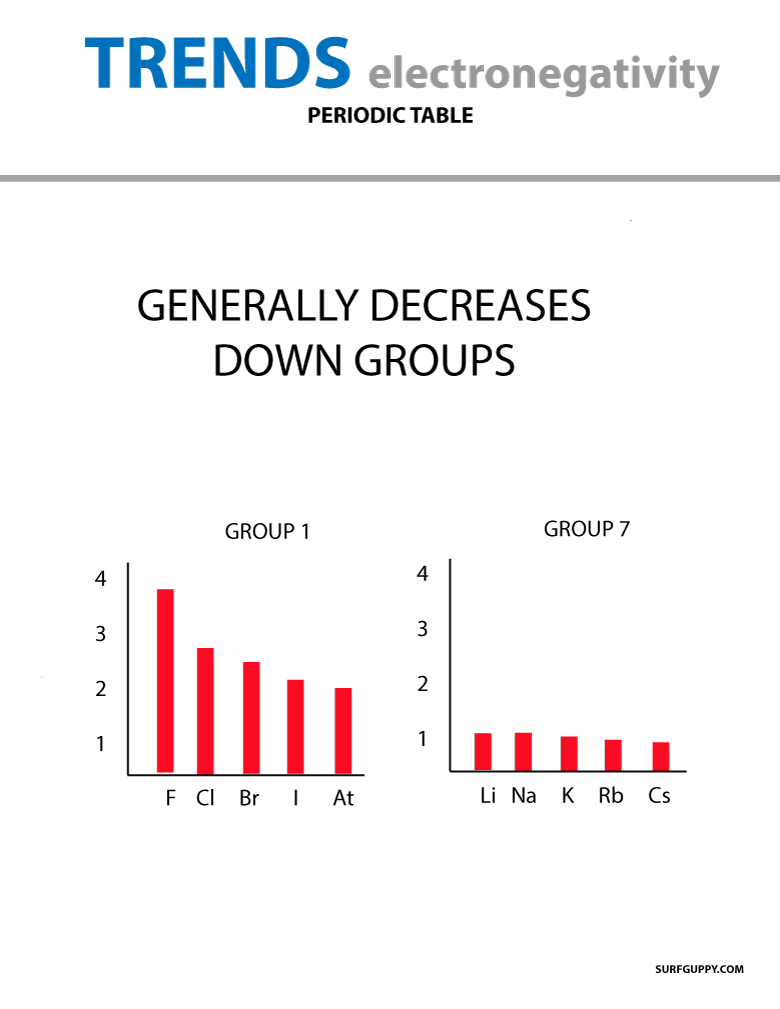
Tabla periódica de la electronegatividad
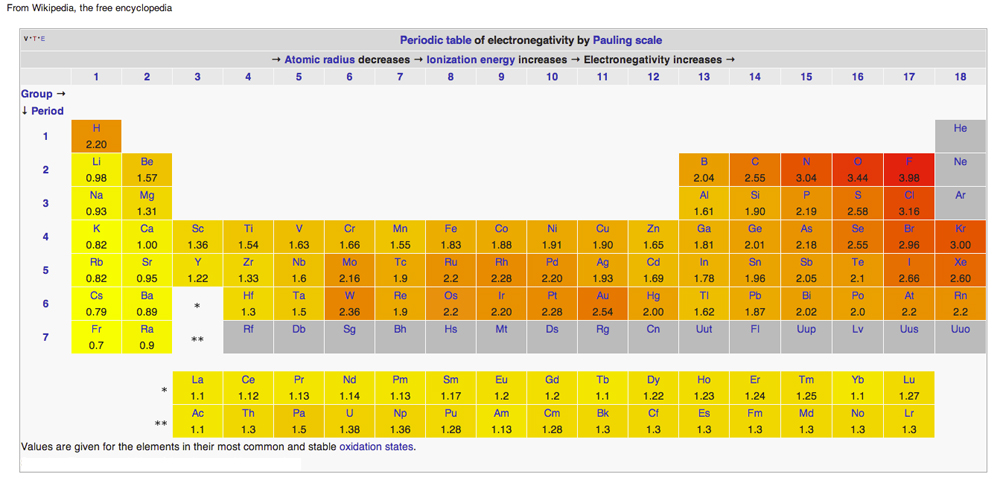 Diagrama de Wikipedia publicado bajo licencias Creative Common
Diagrama de Wikipedia publicado bajo licencias Creative Common
Leave a Reply