Pueden los niveles de FT3 facilitar la detección de inflamación o catabolismo y desnutrición en pacientes en diálisis? | Nefrología
INTRODUCCIÓN
La alteración de la función tiroidea que afecta a pacientes eutiroideos con afecciones graves se ha asociado a una disminución de la supervivencia. Nos referimos al síndrome de T3 baja para describir las alteraciones de la función tiroidea que afectan a un alto porcentaje de la población (hasta el 75% de los pacientes hospitalizados)1 y que implican una disminución de la FT3, una T4 libre (FT4) normal o ligeramente baja y una tirotropina (TSH) normal. Estos cambios se interpretan como un mecanismo de adaptación del organismo ante la enfermedad y se producen cuando hay una disminución de la conversión periférica de T4 y FT3, sin que exista una enfermedad específica del tiroides. También se ha descrito una alta prevalencia de niveles bajos de FT3 en pacientes con enfermedad renal crónica (ERC) sin antecedentes de enfermedad tiroidea2, y los niveles de FT3 se han identificado como predictores independientes de mortalidad tanto en pacientes en hemodiálisis (HD)3 como en diálisis peritoneal (PD)4. No se sabe si la causa de esta reducción de la FT3 es sólo el mecanismo de adaptación fisiológica que reduce el metabolismo basal cuando hay enfermedad, o si es una alteración asociada a la ERC o a la diálisis y su corrección podría ayudar a mejorar la supervivencia de estos pacientes. Los niveles de FT3 pueden ser bajos en los pacientes con ERC debido a varios mecanismos, tales como 1) la desnutrición: Una disminución de la ingesta de alimentos podría llevar a una reducción de la conversión de T4 en FT3 y, finalmente, a una disminución del gasto energético y a la detención del catabolismo proteico; 2) inflamación: En la ERC se produce una inflamación crónica que también puede estar asociada a la disminución de la FT3 durante la diálisis;4,5 3) la insuficiencia renal propiamente dicha: Se produce por la acumulación de toxinas urémicas que alteran la función tiroidea, como la acidosis metabólica o la disminución de la excreción de yodo; o alteraciones asociadas a las técnicas de diálisis como el uso de heparina durante la HD o las pequeñas pérdidas de T4 o T3 en el efluente peritoneal.2 Por lo tanto, la reducción de la función tiroidea en los pacientes en diálisis podría ser un marcador de malnutrición-inflamación, o ser secundario a la insuficiencia renal crónica o a la técnica particular de diálisis utilizada.
El objetivo principal de este estudio fue evaluar la incidencia del síndrome de T3 baja que afecta a los pacientes estables sometidos a diálisis (HD y PD) y su asociación con los diferentes marcadores de malnutrición e inflamación.
MATERIAL Y MÉTODO
Se trata de un estudio descriptivo, transversal, en el que participaron pacientes crónicos en diálisis (32 en HD y 11 en DP) en el Hospital General de Segovia durante el mes de abril de 2008. Todos los pacientes llevaban al menos 3 meses en diálisis crónica y estaban estables desde el punto de vista clínico. Se definió como «estable» el hecho de no tener ingresos hospitalarios, infecciones intercurrentes o enfermedades registradas durante el mes anterior al estudio. Once pacientes fueron excluidos posteriormente del estudio: Cuatro debido a una enfermedad tiroidea previamente identificada y siete que tomaban medicación que podía afectar a la función tiroidea.
La TSH, la FT4 y la FT3 del corte transversal se midieron mediante inmunoanálisis basado en electroquimioluminiscencia (ECLIA), utilizando un analizador E170 (Roche Diagnostics, Mannheim, Alemania). La sensibilidad de las pruebas de TSH, FT4 y FT3 fue de 0,005mcU/l, 0,3pmol/l y 0,4pmol/l, respectivamente. Los valores de referencia fueron: TSH 0,4-5mcU/l, FT4 11-23pmol/l y FT3 3,9-6,8pmol/l. Se midieron los anticuerpos antitiroideos (anti-TPO y anti-TG) mediante una prueba de inmunoabsorción (Aeskulisa Aesku Diagnostics, Alemania) para descartar enfermedades autoinmunes (se consideraron positivos los valores superiores a 150U/ml para anti-TPO o 50U/ml para TG). Al mismo tiempo, se analizaron los parámetros bioquímicos y hematológicos asociados a la nutrición y la inflamación: albúmina, prealbúmina, transferrina, colesterol, hematocrito, creatinina, pH, bicarbonato y proteína C reactiva (PCR), utilizando los métodos de laboratorio habituales en nuestro hospital. Los niveles de la hormona del crecimiento (GH) y del factor de crecimiento similar a la insulina (IGF-1) se establecieron también mediante radioinmunoanálisis en un laboratorio de referencia. Los valores se expresan en ng/ml. Las pruebas se realizaron antes de la primera sesión de diálisis de la semana; los pacientes que debían someterse a diálisis por la tarde recibieron instrucciones de ayunar al menos cuatro horas antes.
La ingesta media de calorías y proteínas diarias se estableció mediante la encuesta dietética de tres días (programa informático Dietsource 3.0 NovartisÆ) y se corrigió en función del peso ideal del paciente. Se registró el porcentaje de lípidos e hidratos de carbono, así como la ingesta de sodio, potasio y fósforo.
El estado nutricional del paciente se evaluó mediante mediciones antropométricas que se realizaron a mitad de semana después de la diálisis utilizando técnicas estándar6 e incluyeron: altura, peso, índice de masa corporal (IMC), pliegue cutáneo del tríceps (TSF), circunferencia del brazo (AC) y circunferencia muscular del brazo (AMC). Los resultados se estandarizaron calculando el porcentaje de cada caso en relación con el percentil 50 de los datos obtenidos de una población de adultos españoles normales de la misma edad y sexo7,8, considerando déficits moderados-graves aquellos casos que superaban el 80% de la población normal.
Para obtener una valoración más precisa del estado nutricional y de la composición corporal, se realizó un análisis vectorial de bioimpedancia (BIVA) a mitad de semana después de la diálisis (Vectorial BIA 101; Akern, Florencia, Italia), que midió la resistencia (R), la reactancia (Xc), el ángulo de fase (PA), el intercambio sodio-potasio (I Na/K), el agua corporal total (TBW), el agua extracelular (ECW), el agua intracelular (ICW), la masa celular, el índice de masa celular (masa celular/altura2) (BCMI), la masa grasa (FM), la masa libre de grasa (FFM) y la masa muscular. Estos datos se compararon con los valores de sujetos normales de la misma edad y peso.9
La comorbilidad se estimó mediante el índice de Charlson, modificado por Beddhu.10 La dosis de diálisis se midió calculando el KT/V, y la ingesta proteica se estimó a partir del índice catabólico proteico normalizado para el peso actual (nPCR).
Análisis estadístico
El análisis estadístico se realizó mediante el paquete informático SPSS, versión 11.0 para Windows. Los valores se expresaron como porcentajes o medias ± DE; un valor de p
RESULTADOS
Las características clínicas de los 32 pacientes se encuentran en la tabla 1. La media de KT/V en HD fue de 1,6 ± 0,27, y en DP la media semanal de KT/V fue de 2,07 ± 0,27.
Los valores medios de hormonas tiroideas fueron los siguientes: TSH 2,2 ± 1,5mcU/ml, FT4 14,7 ± 2,3pmol/l y FT3 4,0 ± 0,71pmol/l. Sólo dos pacientes (6,3%) presentaron valores bajos de FT4 y otros dos pacientes presentaron aumento de TSH, mientras que 17 pacientes (53,1%) presentaron niveles bajos de FT3. No encontramos correlación entre los niveles de FT3, FT4 y TSH. Ningún paciente presentó anticuerpos antitiroideos. No hubo diferencias significativas entre los niveles de FT3 según el sexo (4,2 ± 0,7 para los hombres frente a 3,8 ± 0,6 para las mujeres; ns); los niveles de FT3 fueron significativamente mayores en DP que en HD (4,5 ± 0,4 frente a 3,8 ± 0,7; p = 0,016). No hubo diferencias en los niveles de FT3 según el tipo de diálisis. Sin embargo, los pacientes en DP presentaron mayores concentraciones de TSH (3,5 ± 1,3 vs. 1,7 ± 1,3mcU/ml; p = 0,002), y el IMC también fue mayor en los pacientes en DP (30,6 ± 3,3 vs. 24,8 ± 4,4; p = 0,002) en comparación con los pacientes en HD.
Para determinar a qué se asociaba la disminución de FT3 en diálisis, comparamos los datos clínicos, sociodemográficos, analíticos, antropométricos y de BIVA de los pacientes con FT3 baja con los valores normales obtenidos en nuestro laboratorio (
DISCUSIÓN
Recientemente, se han descrito niveles bajos de FT32-4 que no están causados por una enfermedad tiroidea sino que son el resultado de un deterioro en la conversión periférica de FT4 a FT3 en un alto porcentaje de pacientes en diálisis. Este fenómeno puede ser comparable a otras incidencias descritas en casos de diversas enfermedades crónicas o agudas,1 y se conoce como síndrome del enfermo eutiroideo o síndrome de la T3 baja. Sin embargo, la ERC se diferencia del resto de casos de síndrome del enfermo eutiroideo porque no se acompaña de un aumento de la T3 inversa (rT3).11 Esto se debe a que, a pesar de que el aclaramiento de rT3 en los pacientes renales es menor, parece haber una redistribución de rT3 desde el espacio vascular al extravascular y un aumento de la captación celular de rT3.
Nuestros datos confirman la alta incidencia de pacientes con niveles bajos de FT3 (53%) sometidos a diálisis y sin ninguna enfermedad tiroidea conocida, que probablemente se deba a una conversión periférica deficiente de T4 y FT3, dado que los niveles de FT3 no se correlacionaron con los de FT4 o TSH. Se ha sugerido que la acumulación de toxinas urémicas o la acidosis metabólica pueden contribuir a una disminución de la FT3.12 No encontramos ninguna relación entre los niveles de pH y bicarbonato y los niveles de FT3. Tampoco encontramos ninguna correlación con la dosis de diálisis medida mediante KT/V ni con el tiempo que los pacientes llevaban en diálisis. Hay que tener en cuenta que, en general, las dosis de diálisis de nuestros pacientes eran altas (la media de KT/V de los pacientes en HD fue de 1,6 ± 0,27 y la media de KT/V semanal en DP fue de 2,07 ± 0,27) y que la acidosis se corregía relativamente bien (pH 7,34 ± 0,6 y bicarbonato 22,7 ± 2,8). En cuanto al tipo de diálisis, encontramos que los pacientes en diálisis en DP tenían mayores niveles de FT3, lo que contradice ligeramente los resultados previstos dado que en DP se pueden esperar mayores pérdidas de T4 y T3 en el efluente.13 Sin embargo, también se ha demostrado que estas pérdidas son mínimas: Menos de 10μg de T4 y menos de 0,1μg de T3 al día, lo que supone menos del 10% y del 1% respectivamente respecto a la tasa de producción de T4 y T3. Como resultado, nuestros hallazgos confirman que la falta de conversión periférica como respuesta a la desnutrición es mucho más importante que la pérdida peritoneal, y en el caso de este estudio, los pacientes con EP registraron mejores resultados nutricionales, incluyendo un mayor IMC. Coincidimos con los hallazgos de otros autores y creemos que la disminución de la FT3 en los pacientes en diálisis es principalmente la respuesta adaptativa del organismo a la enfermedad con el objetivo de reducir el metabolismo basal y evitar los catabolismos2. La función tiroidea no sólo se ve alterada por el ayuno, sino también por la composición de la dieta; así, una disminución de la ingesta de hidratos de carbono provoca una mayor reducción de la FT3 que una disminución de la ingesta de proteínas. Una ingesta calórica insuficiente, incluso con una ingesta proteica adecuada, puede causar el «síndrome del enfermo eutiroideo».14 No encontramos ninguna correlación entre los niveles de FT3 y la ingesta calórica total (kcal/día) o la ingesta calórica corregida según el peso ideal o real. Tampoco encontramos diferencias en la composición de la dieta entre los pacientes con FT3 normal y disminuida y por ello somos reacios a apoyar la hipótesis de que la disminución de la FT3 en los pacientes en diálisis se deba a una ingesta insuficiente. Sin embargo, sí encontramos una asociación entre los niveles de FT3 y algunos parámetros bioquímicos y antropométricos de desnutrición, como la prealbúmina, la transferrina, el IMC, la CA, la CMA o la masa muscular medida mediante bioimpedancia. Por lo tanto, parece que los niveles de FT3 están asociados a la desnutrición pero no a la falta de ingesta de calorías. Además, encontramos una correlación inversa con los niveles de PCR. Durante las infecciones o la sepsis se produce una reducción de las hormonas tiroideas a través de varios mecanismos, sin embargo, se produce fundamentalmente por una disminución de la conversión periférica de FT4 a T3. La reducción de las hormonas tiroideas se asocia a la gravedad del proceso15 y parece que, al menos en parte, está mediada por las citoquinas.16,17 La inflamación crónica que se produce en la IRC también parece asociarse a una disminución de la FT3 en la HD.4,5 En los estudios de Zocalli et al. se encontró una disminución de los niveles de FT3 en ambos tipos de pacientes en diálisis al compararlos con sujetos sanos; también indican que los niveles de FT3 se correlacionan de forma inversa con los niveles de interleucina 6 y PCR. También debe considerarse la posibilidad de que la disminución de la FT3 sea el resultado de la enfermedad o de la edad, que se asocia a una reducción del metabolismo energético basal, sin embargo en nuestro estudio no se encontró correlación entre la FT3 y la edad o la comorbilidad en general, sin embargo, sí hubo correlación con los parámetros de inflamación.
Recientemente, la Sociedad Internacional de Nutrición Renal y Metabolismo (ISRNM)18 ha sugerido sustituir el término «malnutrición» por el de «desgaste proteico-energético» (PEW) para definir esta situación que afecta a los pacientes en diálisis, dado que «malnutrición» en el sentido más estricto de la palabra significa «ingesta insuficiente» y, la situación que suele observarse en estos pacientes es un metabolismo alterado (exceso de metabolismo o falta de anabolismo), promovido por las citoquinas inflamatorias, que conduce a la pérdida de reservas proteicas o energéticas. Creemos que la disminución de la FT3 es un mecanismo adaptativo del organismo para defenderse del desgaste proteico, que no está causado por la falta de ingesta, sino por la inflamación o la falta de sustancias anabolizantes que se asocian a la IRC. Teniendo en cuenta esto, los resultados de un estudio realizado por Lim et al.2 son interesantes porque aunque las dosis de FT3 administradas a sujetos normales no alteraron el balance proteico, los pacientes con EH con niveles bajos de FT3 experimentaron un aumento del catabolismo. Este dato sugiere que los pacientes que experimentan una disminución de la conversión periférica de T4 a FT3 se están defendiendo de una situación catabólica y que la T3 empeoraría la malnutrición proteica al aumentar el catabolismo.
Actualmente, todavía no existe un marcador fiable de la masa muscular y del catabolismo proteico en los pacientes en diálisis, dado que la creatinina sérica o la generación de urea pueden verse afectadas por la dosis de diálisis. Según las recomendaciones de la ISRNM18 , la pérdida de masa muscular debería incluirse en los criterios de la PEW dado que puede ser muy importante tanto clínica como pronósticamente. Dada la buena correlación encontrada en nuestro estudio entre los niveles de FT3 y la masa muscular, y teniendo en cuenta que la FT3 probablemente varía rápidamente en las enfermedades catabólicas, sugerimos que los niveles de FT3 se utilicen como un indicador precoz del catabolismo y como un marcador para medir la respuesta a determinadas terapias que pretenden tratarlo, por ejemplo, para evaluar la respuesta a los suplementos nutricionales o a las sustancias anabolizantes.
CONCLUSIÓN
La mitad de nuestros pacientes en diálisis presentaron niveles disminuidos de FT3 en suero sin alteración de TSH o FT4 (síndrome de FT3 baja). Esta reducción parece estar causada por la alteración de la conversión periférica de FT4 a FT3. Estos niveles se correlacionan fundamentalmente con los parámetros de desnutrición e inflamación y podrían considerarse un marcador precoz de catabolismo o PEW.
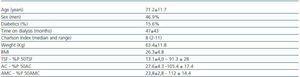
Tabla 1. Características sociodemográficas y antropométricas
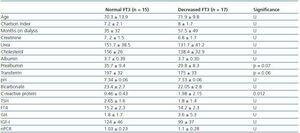
Tabla 2. Diferencias sociodemográficas y analíticas entre pacientes con FT3 normal (>3,95) y pacientes con FT3 disminuida
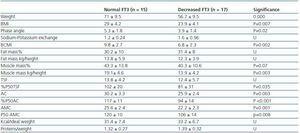
Tabla 3. Diferencias antropométricas y de BIVA entre pacientes con FT3 normal (> 3,95) y pacientes con FT3 disminuida
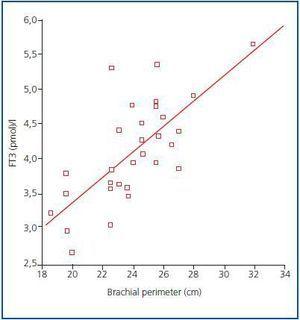
Figura 1.
Leave a Reply