¿Por qué el #»HF» tiene un punto de ebullición más bajo que el agua aunque el #»F» sea más electronegativo que el #»O»?
Hay muchos factores complicados. Esto es lo que he podido encontrar:
- El agua puede formar una red de enlaces de hidrógeno más equilibrada (dos aceptores y dos donantes, en lugar de un donante y tres aceptores), haciendo que el sistema a granel interactúe más uniformemente y, por tanto, sea más fuerte en su conjunto.
- El agua forma una red de enlaces de hidrógeno más extensa (un entorno local tetraédrico tridimensional, en lugar de un entorno bidimensional en zigzag), haciendo que el sistema a granel sea menos fácilmente vaporizable.
- El agua generalmente tiene un ángulo de interacción más óptimo, ya que se ajusta más a la geometría de los electrones de la molécula y alinea las interacciones a lo largo del dipolo molecular, mientras que el #»HF» tendría un enlace de hidrógeno más fuerte (en términos de números brutos) si las interacciones fueran lineales.
¡DISCLAIMER: Respuesta larga! También muy visual.
La unión de hidrógeno es la fuerza intermolecular más fuerte tanto en #»HF «# como en #»H»_2 «O «#. La fuerza de interacción depende de la distancia de interacción, el ángulo de interacción y la extensividad de la red.
Cuando extraemos todas las interacciones de enlace de hidrógeno, y suponemos agua pura y #»HF» puro, obtenemos (aislando un conjunto selecto de moléculas de una matriz infinita)#»»^()##»»^()#:
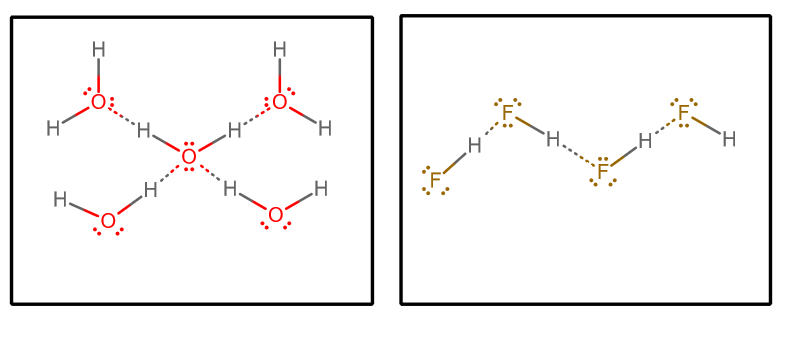
Entonces podríamos considerar algunos factores:
- Número de donantes y aceptantes de enlaces de hidrógeno
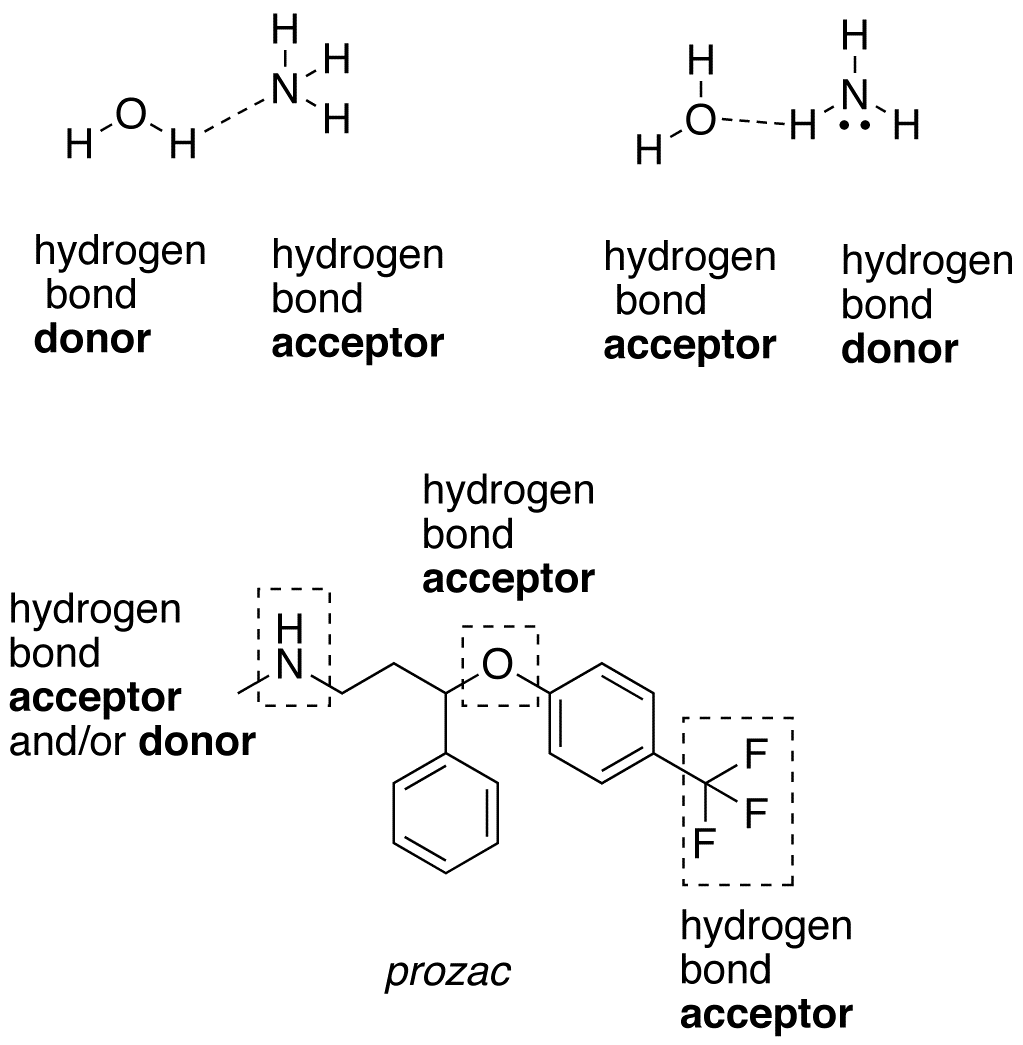
Cada molécula de agua puede aceptar dos interacciones de enlace de hidrógeno (a través de los pares solitarios) y donar dos interacciones de enlace de hidrógeno (a través de los hidrógenos).
Por otro lado, cada molécula de #»HF «# acepta tres interacciones de enlace de hidrógeno (a través de los pares solitarios) y dona sólo una (a través de los hidrógenos).
Se podría argumentar entonces que el agua tiene una red de enlace de hidrógeno más equilibrada, lo que hace que el sistema a granel sea menos capaz de vaporizarse en general. Esto apoyaría el punto de ebullición más alto del agua sobre el #»HF «#.
- Electronegatividades de #bb(«F»)# y #bb(«O»)#
#»F «# es más electronegativo, así que mantiene su densidad de electrones más fácilmente; así, se espera que los pares solitarios sean donantes más débiles de interacciones de enlace de hidrógeno que los pares solitarios en #»O «#.
Esto parecería predecir que cada interacción individual de enlace de hidrógeno es más débil, lo que apoyaría el mayor punto de ebullición del agua sobre el #»HF «#, PERO esto se contradice con el siguiente punto.
- Promedio de las fuerzas de enlace de hidrógeno en bruto en #bb(«HF»)# vs. agua
#»O»-«H «cdotcdotcdot: «O»-#, #DeltaH_(«H»-«bond») ~~ «21 kJ/mol «#
#»F»-«H «cdotcdot: «F»-#, #DeltaH_(«H»-«bond») ~~ «161.5 kJ/mol «#
Estos datos de Wikipedia sugieren que el #»HF «# tiene interacciones de enlace de hidrógeno más fuertes entre las moléculas de #»HF «# que en el agua.
Esto no apoyaría la prueba experimental de que el #»HF» # tiene un punto de ebullición mucho más bajo, pero esto también es sólo un número en bruto y no considera, por ejemplo, los ángulos de interacción en el sistema a granel.
- Ángulos de enlace de hidrógeno observados y dimensiones de interacción
#»HF «#, siendo una molécula lineal, se ha visto que tiene interacciones de enlace de hidrógeno en zigzag, en dos dimensiones, con ángulos de #116^@#. Un ángulo más óptimo sería de #180^@#, ya que eso daría interacciones dipolares más directas. Esto limita la fuerza de la unión de hidrógeno de #»HF «#.
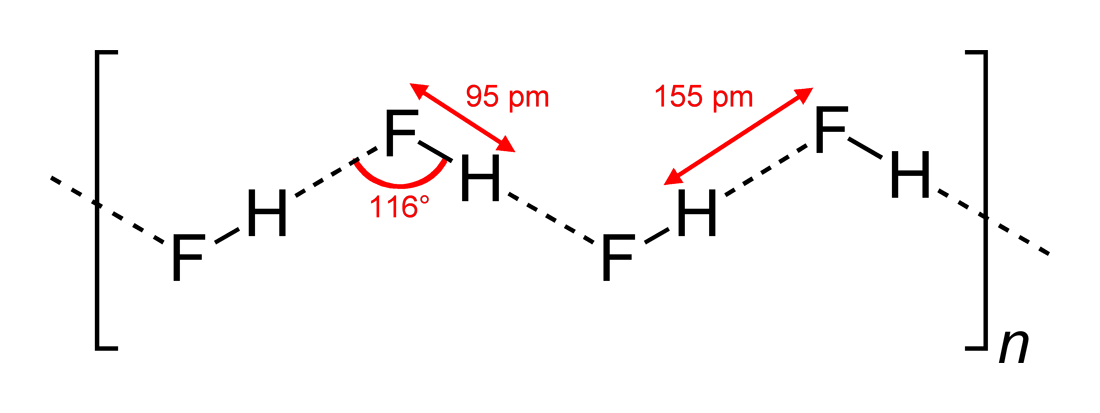
El agua, al ser una molécula doblada con una geometría de electrones tetraédrica, puede tener una unión de hidrógeno en tres dimensiones.
Aquí hay un ejemplo de la red tetraédrica que se encuentra en el entorno local de una interacción de enlace de hidrógeno en el agua:
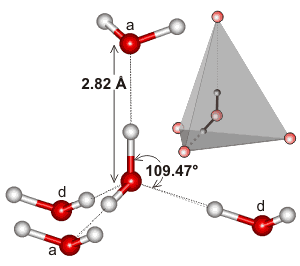
Puede ser que la extensividad de la red de enlace de hidrógeno, y cómo tiende a coincidir con la geometría de electrones del agua, es lo que hace que el punto de ebullición del agua sea tan alto. Esto apoyaría el punto de ebullición más alto de agua sobre #»HF «#.
En general, éstos son los factores menos desafiantes que yo podría pensar en:
- El agua puede hacer una red de enlace de hidrógeno más equilibrada (dos aceptores y dos donantes, en vez de un donante y tres aceptores), haciendo el sistema de bulto más uniformemente interactuando y así más fuerte como un todo.
- El agua forma una red de enlaces de hidrógeno más extensa (un entorno local tetraédrico tridimensional, en lugar de un entorno bidimensional en zigzag), haciendo que el sistema a granel sea menos fácilmente vaporizable.
- El agua generalmente tiene un ángulo de interacción más óptimo, ya que se ajusta más a la geometría de los electrones de la molécula y alinea las interacciones a lo largo del dipolo molecular, mientras que el #»HF «# tendría un enlace de hidrógeno más fuerte (en términos de números brutos) si las interacciones fueran lineales.
Leave a Reply