Fronteras en Oncología
Antecedentes
La osteoporosis inducida por la radiación y las fracturas por insuficiencia (FI) resultantes son muy comunes. La incidencia de FIs reportada en la literatura después de irradiaciones abdominales o pélvicas varía entre el 7 y el 45% (1-8). En determinadas situaciones oncológicas, como el tratamiento hormonal del cáncer de mama y de próstata, los clínicos están familiarizados con la osteoporosis y el riesgo de fractura relacionados con el tratamiento (9-13). La absorciometría de rayos X de doble energía (DEXA) se solicita de forma rutinaria y se toman medidas preventivas contra la osteoporosis como el calcio, la vitamina D o los bifosfonatos de forma profiláctica durante el seguimiento de los pacientes. Sin embargo, no hay una evaluación rutinaria de la salud ósea, y no hay conciencia de la toxicidad ósea relacionada con la radiación y los FI entre los oncólogos de radiación. Aunque los FI se encuentran a menudo en el seguimiento de los pacientes después de las irradiaciones abdominales o pélvicas y se observan hoy en día con una frecuencia muy alta después de las irradiaciones estereotácticas, no se tiene en cuenta la DEXA u otras mediciones alternativas de la densidad mineral ósea (DMO) en la práctica de la radiooncología (1-8, 14-16). Debido al desconocimiento de los FI por parte de los oncólogos radioterápicos, estos FI a menudo no se reconocen o a veces se pueden considerar como las metástasis óseas del cáncer primario, lo que da lugar a una mala praxis y a exámenes innecesarios y a un estrés psicológico para los pacientes.
Recientemente hemos demostrado un riesgo de fractura vertebral del 9,6% en pacientes que fueron tratados con irradiación abdominal (8). Creemos que el hueso debe ser considerado como un órgano de riesgo para la planificación de la radioterapia y la DMO debe ser medida y seguida regularmente en estos pacientes antes y después de la irradiación. Los oncólogos radioterápicos pueden determinar la salud ósea de sus pacientes y los FI no reconocidos utilizando su herramienta más importante: el sistema de planificación de la radioterapia.
La DMO es la medida de la densidad mineral ósea y del calcio y se determina mediante DEXA (17, 18). La DEXA se considera actualmente el método de referencia para la cuantificación de la DMO y se ha demostrado que se correlaciona con el riesgo de fractura y la eficacia del tratamiento (17, 18). Varios estudios han demostrado que las unidades Hounsfield (UH) derivadas de la tomografía computarizada (TC), tienen una fuerte correlación con la DMO proporcionada por la DEXA (19-22). Los valores de UH pueden proporcionar una estimación fiable de la resistencia ósea regional y la DMO, y pueden utilizarse para descartar la osteoporosis con gran precisión (19-22). Además, la TC, en comparación con la DEXA, permite una identificación más precisa de las fracturas vertebrales (23). Las tomografías computarizadas de diagnóstico y planificación de la radiación se solicitan para estadificar la enfermedad, planificar el tratamiento con radiación o para el seguimiento de los pacientes de forma rutinaria. Podemos utilizar las UH derivadas de la TC en estos pacientes para determinar y controlar la DMO y, por lo tanto, podemos evitar el coste adicional y la exposición a la radiación adicional de la medición de la DEXA. Además de estas ventajas, las vistas vertebrales sagitales reconstruidas fácilmente a partir de TC pueden utilizarse para evaluar fracturas óseas no reconocidas y no sintomáticas.
El objetivo del presente estudio es demostrar la pérdida de densidad mineral ósea y las fracturas vertebrales no diagnosticadas mediante la medición de las UH y la reconstrucción sagital de las vértebras a partir de las TC importadas al sistema de planificación del tratamiento para los pacientes que son tratados con radioterapia abdominal.
Métodos
Se incluyeron en el grupo de estudio 57 pacientes consecutivos operados de adenocarcinoma gástrico que recibieron radioterapia abdominal adyuvante. Treinta y cuatro pacientes consecutivos con enfermedad en fase inicial que no necesitaron tratamiento adyuvante tras la cirugía constituyeron el grupo de control.
En los pacientes irradiados, la radiación se administró con fotones de 6 o 15 MV mediante planificación del tratamiento conformada, de intensidad modulada o de arco volumétrico modulado. La dosis de radiación prescrita fue de 46 Gy en 23 fracciones con 2 Gy por día, o 45 Gy en 25 fracciones con 1, 8 Gy por día, 5 días por semana, durante 5 semanas. Todas las pacientes recibieron 5-fluorouracilo en bolo o en infusión, un ciclo antes, dos ciclos concomitantes y un ciclo después de la radioterapia. Se obtuvo el consentimiento informado de todos los pacientes y el estudio fue aprobado por el comité ético local del hospital.
Las tomografías de planificación y diagnóstico se obtuvieron utilizando escáneres de TC multidetector (LightSpeed de 16 cortes o VCT de 64 cortes; GE Healthcare, Waukesha, WI) mediante cortes de 3 o 5 mm de grosor. Las tomografías abdominales se importaron desde el sistema de comunicación y archivo de imágenes de radiología al sistema de planificación del tratamiento Eclipse (TPS) (Varian Medical Systems, Palo Alto, CA). En el grupo de estudio, la primera tomografía ya estaba en el sistema de planificación del tratamiento para la planificación de la radiación. La segunda se obtuvo 1 año después de la radioterapia y se importó al sistema de planificación del tratamiento. En el grupo de control se importaron al sistema de planificación las tomografías abdominales obtenidas justo después de la cirugía y 1 año después. Los cuerpos vertebrales T12-L1-L2 fueron contorneados para determinar la dosis media de radiación para cada cuerpo vertebral en los pacientes irradiados por un oncólogo radioterápico. A continuación, un radiólogo experimentado que utilizó el TPS determinó los valores medios de UH de las mismas vértebras para todos los pacientes. Los valores medios de UH para ambos grupos de pacientes se volvieron a medir 1 año después.
Se calcularon los valores de UH al principio del estudio y los obtenidos 1 año después para cada cuerpo vertebral en cada grupo y se determinó el porcentaje de cambio en las UH (Δ%HU). Aunque se planificó la duración de las mediciones de UH al principio y 1 año después, se continuó con el seguimiento regular de los pacientes durante al menos 5 años después del tratamiento para conocer los resultados oncológicos. Las fracturas por compresión vertebral, si se desarrollaron, se determinaron a partir de la reconstrucción sagital de las vértebras a partir de las tomografías computarizadas durante los seguimientos.
Técnica de medición de las UH
Las UH se midieron en las secciones transversales axiales de las regiones trabeculares de los cuerpos vertebrales T12, L1, L2. Cada cuerpo vertebral se dividió en tres segmentos axiales y las UH se calcularon colocando una región de interés (ROI) rectangular sobre un área de hueso trabecular en el cuerpo vertebral. Se trató de evitar el plexo venoso basivertebral posteriormente y el hueso esclerótico subcondral. Las mediciones se detallan en la figura suplementaria 1. Se promediaron los valores medios de HU de tres segmentos axiales en cada vértebra para determinar el valor final de HU para cada cuerpo vertebral. HUpre representa el valor de HU medido en la TC inicial tanto para el grupo de estudio como para el de control, mientras que, HUpost define el valor de HU medido después de 1 año.
Análisis estadísticos
La disminución porcentual de la atenuación ósea (Δ%HU) para cada vértebra se calculó con la siguiente ecuación:
Se realizaron análisis de ji-cuadrado para demostrar las diferencias entre la edad, el sexo y las características tumorales de los grupos. Se utilizó la prueba t de Student para determinar las diferencias entre los valores de UH pre y post en cada grupo y entre dos grupos, y para tres niveles de dosis de radiación (<20 Gy, 20-40 Gy y >40 Gy) en el grupo de estudio. Para evaluar directamente el efecto de la dosis de radiación en el cambio de Δ%HU, se realizó un análisis de correlación de Pearson sobre Δ%HU y la dosis de radiación. Consideramos un valor p de < 0,05 como significativo. El análisis estadístico se realizó utilizando el software Statistical Package for Social Sciences (SPSS) 17.0.
Resultados
Los detalles del paciente y del tratamiento se presentan en la Tabla 1. No hubo diferencias estadísticamente significativas entre los grupos con respecto a la edad, el género, el tipo de resección quirúrgica y la localización del tumor. En ambos grupos se midieron los valores medios de UH de las vértebras T12, L1 y L2. Al principio del estudio, no había diferencias estadísticamente significativas en los valores de UH medidos para todas las vértebras entre los grupos de estudio y de control. Mientras que los valores medios de UH de las vértebras T12, L1 y L2 disminuyeron significativamente en el grupo de estudio (p < 0,001 para cada vértebra) después de 1 año, no se encontraron cambios significativos en los valores de UH en el grupo de control (p: 0,09-0,08-0,24, respectivamente) durante el mismo período. La tabla 2 resume los cambios en las UH de los grupos de estudio y de control.
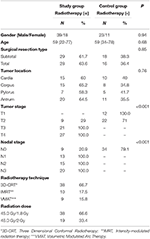
Tabla 1. Características de los pacientes y del tratamiento.

Tabla 2. Comparación de las UH en los dos grupos mismos y entre los dos grupos para cada vértebra.
Las dosis medias de radiación para las vértebras T12, L1 y L2 en el grupo de estudio fueron de 34,55 ± 11,1; 31,82 ± 12,4; 30,37 ± 13,6 Gy, respectivamente. Se encontró una correlación negativa y significativa entre Δ%HU y la dosis de radiación recibida por cada vértebra. A medida que la dosis de radiación aumentaba, las UH disminuían en cada vértebra. Esto se resume en las Figuras 1-3.
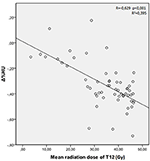
Figura 1. Correlación entre Δ%HU y la dosis de radiación recibida por la vértebra T12.
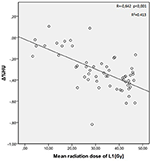
Figura 2. Correlación entre Δ%HU y la dosis de radiación recibida por la vértebra L1.
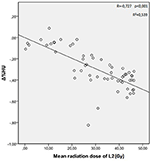
Figura 3. Correlación entre Δ%HU y la dosis de radiación recibida por la vértebra L2.
La relación entre la dosis de radiación recibida por la vértebra y el cambio de HU se resumió en la Tabla 3. Aunque la disminución en los valores de UH fueron estadísticamente significativos en los niveles de dosis de radiación por encima de 20 Gy, los valores de UH no se alteraron significativamente en las dosis de radiación por debajo de 20 Gy, excepto para las vértebras L2.

Tabla 3. Cambio en las UH con respecto a los grupos de dosis de radiación.
Fracturas
Mientras que ningún paciente del grupo de control tuvo fracturas, 4 de los 57 pacientes (%7) del grupo irradiado desarrollaron fracturas vertebrales a lo largo del estudio. Mientras que dos de las fracturas vertebrales se observaron en mujeres, dos de ellas se observaron en varones. Las fracturas se identificaron en los meses 16, 18, 20 y 26 después de la irradiación, con una mediana de seguimiento de 24 meses (rango: 12-36 meses). Se observaron fracturas en la vértebra L1 en tres pacientes, y en la vértebra L2 en un paciente. Las dosis medias de radiación recibidas por cada vértebra fracturada fueron las siguientes: 39, 28,5, 22,3, 31 Gy. Las características de los pacientes con fracturas vertebrales se resumen en la Tabla Suplementaria 1 y en la Figura Suplementaria 2.
Discusión
La radioterapia conduce a la osteoporosis por mecanismos directos e indirectos y los FI se desarrollan frecuentemente después de las irradiaciones pélvicas o abdominales en la práctica clínica (1-8). Los FI en la columna vertebral y la región pélvica son comunes y representan un importante efecto secundario tardío de la radioterapia. Sin embargo, los oncólogos radioterápicos no son conscientes de la osteoporosis y la toxicidad ósea inducidas por la radiación. Debido al desconocimiento de la toxicidad ósea inducida por la radiación, no se presta especial atención a la prevención de esta importante complicación tardía. Nosotros, en nuestro estudio anterior (8), tratamos de enfatizar la importancia de este problema y reportamos una incidencia muy alta de fracturas vertebrales después de irradiaciones abdominales como en los pacientes irradiados por tumores pélvicos (1-7).
Los radiooncólogos durante la planificación del tratamiento de radiación prestan mucha atención a la dosis de radiación recibida por cada órgano en riesgo. Aunque las tasas de toxicidad tardía de grado III/IV para estas complicaciones muy seguidas no superan ciertos porcentajes, la toxicidad ósea relacionada con la radioterapia abdominal o pélvica y las fracturas resultantes son realmente más altas que las conocidas toxicidades tardías de grado III/IV. Mientras que las limitaciones de dosis están bien definidas para los órganos que se sabe que están en riesgo y son determinantes para la aprobación del plan final, este no es el caso del tejido óseo.
Incluso en la última versión de los Criterios Terminológicos Comunes para Acontecimientos Adversos (CTCAE) versión 5.0 no hay una definición específica de la toxicidad ósea resultante de la irradiación (24). No existen criterios de evaluación de la toxicidad ósea en la práctica de la oncología radioterápica. Ni en las tablas de puntuación de toxicidad tardía de LENT-SOMA, ni en el informe Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC), se ha definido el hueso como órgano de riesgo, y no se ha definido ninguna restricción de dosis y volumen para este tejido (25, 26). Sin embargo, los estudios anteriores y nuestro estudio recientemente publicado demostraron que la osteoporosis y el riesgo de fractura deben tenerse en cuenta seriamente, y deben tomarse las precauciones necesarias durante el seguimiento de los pacientes irradiados para prevenir las fracturas relacionadas con la radiación (1-8).
DEXA es el método de referencia para la cuantificación de la DMO y la detección rutinaria de la osteoporosis. Los oncólogos radioterápicos no solicitan DEXA para sus pacientes que reciben irradiación pélvica o abdominal. No consultan a estos pacientes con el endocrinólogo para evaluar el riesgo de fractura y la presencia de osteoporosis antes de cualquier tratamiento de radiación. Sin embargo, como oncólogos radioterápicos, podemos utilizar nuestro sistema de planificación para determinar la DMO y el riesgo de osteoporosis. Estas evaluaciones se pueden realizar fácilmente a través de tomografías computarizadas solicitadas para la estadificación de la enfermedad, o para la planificación del tratamiento de radiación y para el seguimiento de los pacientes. Podemos determinar la disminución de la DMO, la osteoporosis y las fracturas inadvertidas midiendo los valores de UH del hueso a partir de las TC de los pacientes importadas al sistema de planificación, y construyendo imágenes sagitales de las zonas óseas irradiadas.
Recientemente se ha sugerido que los valores de UH del hueso derivados de la TC pueden utilizarse para identificar a los pacientes con disminución de la DMO y osteoporosis (19-22, 27-30). Pickhardt et al. (22) definieron claramente cómo se pueden medir los valores de UH óseos y utilizarlos como alternativa a la DEXA para establecer diagnósticos de DMO y osteoporosis. En estos estudios, mientras que los valores de UH ósea inferiores a 100 se consideran indicativos de osteoporosis, los valores de UH entre 100 y 160 se consideran indicativos de osteopenia, y los valores de UH superiores a 160 demuestran una densidad mineral ósea normal (19-22). Los pacientes con valores de UH superiores a 160 tienen una densidad ósea normal y, por tanto, no es necesario realizar una medición DEXA ni preocuparse por la salud ósea. Los pacientes con valores de UH entre 100 y 160 pueden considerarse osteopénicos y necesitan una intervención temprana para prevenir la osteoporosis y el riesgo de fractura en el futuro. Los pacientes con valores de UH inferiores a 100 deben ser considerados como osteoporóticos. Los valores de UH bajos deben alertar al oncólogo radioterápico sobre el riesgo de fractura ulterior en las zonas óseas que serán expuestas a la radiación. Estos pacientes deben ser consultados con el endocrinólogo antes de administrar cualquier tratamiento de radiación. En los estudios en los que se compararon las UH con la DEXA para la densidad mineral ósea y la determinación de la osteoporosis, se detectaron fracturas vertebrales en algunos pacientes que, según la DEXA, no eran osteoporóticos, durante la determinación de las UH a partir de las tomografías computarizadas (22, 29-31).
En nuestro estudio, tratamos de encontrar una forma fácil para que los oncólogos radioterápicos diagnostiquen la osteoporosis y determinen el riesgo de fractura. Si implementamos estas mediciones en la rutina diaria durante la planificación del tratamiento de radiación, podemos determinar la osteopenia, la osteoporosis y el riesgo de fractura en los pacientes que recibirán radioterapia abdominal o pélvica e intervenir a tiempo para prevenir la toxicidad ósea tardía de la radiación.
Aunque no hubo diferencias estadísticamente significativas en los valores de HU de las vértebras T12, L1, L2 obtenidos al inicio y 1 año después en el grupo de control, los valores de HU disminuyeron significativamente en los pacientes irradiados. Encontramos fracturas vertebrales sólo en los pacientes irradiados. Cuatro pacientes de 57 tuvieron fracturas vertebrales tras una mediana de seguimiento de 24 meses, con una tasa de incidencia acumulada de fracturas del 7%. Aunque el tiempo de seguimiento fue corto y la mayoría de las fracturas fueron asintomáticas, en nuestro estudio anterior informamos de una tasa de fracturas del 9,6%, con un tiempo de seguimiento más largo, y la mayoría de estas fracturas fueron sintomáticas (8). El alto riesgo de fractura ósea en estos pacientes merece atención y el hueso debe ser considerado como un órgano de riesgo. El tiempo reportado para el desarrollo de fracturas después de la radioterapia varió entre 2 y 63 meses (2, 14). Curiosamente, las fracturas como toxicidad tardía por radiación de grado IV se observan con mayor incidencia que otras toxicidades tardías por radiación bien conocidas, como la fibrosis por radiación, la cistitis, la proctitis, etc.
La disminución de la UH fue dependiente de la dosis. Hubo un mayor riesgo de disminución de los valores de UH óseos con mayores dosis de radiación recibidas por las vértebras. Sin embargo, se observó que la disminución de los valores de UH no fue significativa para los cuerpos vertebrales que fueron expuestos a dosis de radiación inferiores a 20 Gy.
En la literatura, existen hallazgos contradictorios en cuanto a la dosis de radiación en la que se observa la pérdida de DMO. Mientras que un estudio demostró la pérdida de DMO en pacientes tratados con una irradiación pélvica de 22,5 Gy, otro estudio no demostró ninguna correlación entre la dosis de radiación y el riesgo de fractura por insuficiencia (32, 33). Wei et al. (33) informaron de que incluso las dosis de radiación vertebral de 5 Gy dan lugar a una reducción significativa de la DMO y a fracturas por insuficiencia en pacientes tratados con radioterapia abdominal. También recomendaron limitar las dosis de radiación a los cuerpos vertebrales, especialmente en los pacientes con valores de UH bajos detectados durante la planificación de la radioterapia. Por lo tanto, debemos definir una restricción de dosis para las vértebras dentro del campo de radiación. Las restricciones de dosis pueden variar en función de los valores de UH medidos durante la planificación de la radioterapia. Deberíamos intentar disminuir las dosis medias de radiación para los huesos vertebrales dentro del campo de radiación, especialmente en los ancianos y en los pacientes ya osteoporóticos.
Conclusiones
La osteoporosis inducida por la radiación y las fracturas por insuficiencia (FI) resultantes son muy comunes. La disminución de la DMO, la osteoporosis y las fracturas inadvertidas pueden detectarse midiendo los valores HU del hueso a partir de los TAC de los pacientes importados al sistema de planificación, y reconstruyendo las imágenes sagitales de las zonas óseas irradiadas. En los pacientes con valores HU óseos ya bajos detectados durante la planificación de la radiación, se puede intervenir de forma temprana para restaurar la salud ósea y prevenir futuras fracturas relacionadas con la radiación. Para prevenir la toxicidad ósea relacionada con la radiación, la dosis de radiación a los huesos vertebrales con valores de HU ya bajos en el momento de la planificación del tratamiento debe limitarse por debajo de 20 Gy.
Declaración de disponibilidad de datos
Los materiales descritos en el artículo, incluidos todos los datos brutos relevantes, pueden estar disponibles libremente para cualquier científico que desee utilizarlos con fines no comerciales, sin violar la confidencialidad de los participantes y pueden obtenerse del autor correspondiente.
Declaración de ética
Nuestro estudio se ha realizado de acuerdo con la Declaración de Helsinki. El estudio fue aprobado por el comité de ética del Hospital de Educación e Investigación Dr. Lutfi Kirdar Kartal (2017/514/109/2). Se ha obtenido el consentimiento informado por escrito de todos los participantes en el estudio.
Contribuciones de los autores
GY: garante de la integridad de todo el estudio. GY y CG: conceptos y diseño del estudio. NC: investigación de la literatura. GY, CG, IK, OS y NC: estudios clínicos. GY: análisis estadístico. OS: preparación del manuscrito. CG: edición del manuscrito. Todos los autores leyeron y aprobaron el manuscrito final.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Material suplementario
El material suplementario para este artículo puede encontrarse en línea en: https://www.frontiersin.org/articles/10.3389/fonc.2020.00742/full#supplementary-material
Abreviaturas
IFs, fracturas por insuficiencia; DEXA, absorciometría de rayos X de doble energía; DMO, densidad mineral ósea; TC, tomografía computarizada; HU, unidad Hounsfield; Δ%HU, cambio porcentual en HU; ROI, Región de interés; SPSS, Paquete estadístico para las ciencias sociales; CTCAE, Criterios terminológicos comunes para eventos adversos; QUANTEC, Análisis cuantitativo de los efectos del tejido normal en la clínica.
1. Oh D, Huh SJ. Fractura por insuficiencia después de la radioterapia. Radiat Oncol J. (2014) 32:213-20. doi: 10.3857/roj.2014.32.4.213
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Higham CE, Faithfull SJ. Salud ósea y radioterapia pélvica. Clin Oncol. (2015) 11:668-78. doi: 10.1016/j.clon.2015.07.006
CrossRef Full Text | Google Scholar
3. Shih KK, Folkert MR, Kollmeier MA, Abu-Rustum NR, Sonoda Y, Leitao MM Jr, et al. Fracturas por insuficiencia pélvica en pacientes con cáncer de cuello uterino y endometrio tratadas con radiación pélvica postoperatoria. Gynecol Oncol. (2013) 128:540-3. doi: 10.1016/j.ygyno.2012.12.021
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Uezono H, Tsujino K, Moriki K, Nagano F, Ota Y, Sasaki R, et al. Fractura por insuficiencia pélvica después de la radioterapia definitiva para el cáncer cervical uterino: análisis retrospectivo de los factores de riesgo. J Radiat Res. (2013) 54:1102-9. doi: 10.1093/jrr/rrt055
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Igdem S, Alco G, Ercan T, Barlan M, Ganiyusufoglu K, Unalan B, et al. Fracturas por insuficiencia después de la radioterapia pélvica en pacientes con cáncer de próstata. Int J Radiat Oncol Biol Phys. (2010) 77:818-23. doi: 10.1016/j.ijrobp.2009.05.059
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Schmeler KM, Jhingram A, Iyer RB, Sun CC, Eifel PJ, Soliman PT, et al. Fracturas pélvicas después de la radioterapia para el cáncer de cuello uterino: implicaciones para los sobrevivientes. Cancer. (2010) 116:625-30. doi: 10.1002/cncr.24811
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Kim HJ, Boland PJ, Meredith DS, Lis E, Zhang Z, Shi W, et al. Fracturas del sacro después de la quimiorradiación para el carcinoma rectal: incidencia, factores de riesgo y evaluación radiográfica. Int J Radiat Oncol. (2012) 84:694-9. doi: 10.1016/j.ijrobp.2012.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Yaprak G, Gemici C, Temizkan S, Ozdemir S, Dogan BC, Seseogullari OO. Desarrollo de osteoporosis y fracturas vertebrales después de la irradiación abdominal en pacientes con cáncer gástrico. BMC Cancer. (2018) 18:972. doi: 10.1186/s12885-018-4899-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lustberg MB, Reinbolt RE, Shapiro CL. La salud ósea en la supervivencia del cáncer en adultos. J Clin Oncol. (2012) 30:3665-74. doi: 10.1200/JCO.2012.42.2097
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, Grupo de trabajo de directrices de la ESMO. Salud ósea en pacientes con cáncer: Guías de práctica clínica de la ESMO. Ann Oncol. (2014) 25:124-37. doi: 10.1093/annonc/mdu103
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Pfeilschifter J, Diel IJ. Osteoporosis debida al tratamiento del cáncer: patogénesis y manejo. J Clin Oncol. (2000) 18:1570-93. doi: 10.1200/JCO.2000.18.7.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Hadji P, Gnant M, Body JJ, Bundred NJ, Brufsky A, Coleman RE, et al. Pérdida ósea inducida por el tratamiento del cáncer en mujeres premenopáusicas: ¿necesidad de intervención terapéutica? Cancer Treat Rev. (2012) 38:798-806. doi: 10.1016/j.ctrv.2012.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Skolarus TA, Caram MV, Shahinian VB. Enfermedad ósea asociada a la privación de andrógenos. Curr Opin Urol. (2014) 24:601-7. doi: 10.1097/MOU.000000000101
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Boehling NS, Grosshans DR, Allen PK, McAleer MF, Burton AW, Azeem S, et al. Riesgo de fractura por compresión vertebral después de la radioterapia corporal estereotáctica para las metástasis espinales. J Neurosurg Spine. (2012) 16:379-86. doi: 10.3171/2011.11.SPINE116
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cunha MV, Al-Omair A, Atenafu EG, Masucci GL, Letourneau D, Korol R, et al. Vertebral compression fracture (VCF) after spine stereotactic body radiation therapy (SBRT): analysis of predictive factors. Int J Radiat Oncol Biol Phys. (2012) 84:343-9. doi: 10.1016/j.ijrobp.2012.04.034
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jawad MS, Fahim DK, Gerszten PC, Flickinger JC, Sahgal A, Grills IS, et al. Fracturas por compresión vertebral después de la radioterapia corporal estereotáctica: una gran evaluación multi-institucional y multinacional. J Neurosurg Spine. (2016) 24:928-36. doi: 10.3171/2015.10.SPINE141261
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Marshall D, Johnell O, Wedel H. Meta-análisis de la eficacia de las medidas de densidad mineral ósea para predecir la aparición de fracturas osteoporóticas. BMJ. (1996) 312:1254-9. doi: 10.1136/bmj.312.7041.1254
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. A reference standard for the description of osteoporosis. Bone. (2008) 42:467-75. doi: 10.1016/j.bone.2007.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schreiber JJ, Anderson PA, Rosas HG, Buchholz AL, Au AG. Unidades Hounsfield para evaluar la densidad mineral ósea y la fuerza: una herramienta para el manejo de la osteoporosis. J Bone Joint Surg Am. (2011) 93:1057-63. doi: 10.2106/JBJS.J.00160
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Schreiber JJ, Anderson PA, Hsu WK. Uso de la tomografía computarizada para evaluar la densidad mineral ósea. Neurosurg Focus. (2014) 37:E4. doi: 10.3171/2014.5.FOCUS1483
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Batawil N, Sabiq S. Unidad Hounsfield para el diagnóstico de la enfermedad de la densidad mineral ósea: un estudio de prueba de concepto. Radiography. (2016) 22:93-8. doi: 10.1016/j.radi.2015.11.004
CrossRef Full Text | Google Scholar
22. Pickhardt PJ, Pooler BD, Lauder T, del Río AM, Bruce RJ, Binkley N. Cribado oportunista de la osteoporosis mediante tomografía computarizada abdominal obtenida para otras indicaciones. Ann Intern Med. (2013) 158:588-95. doi: 10.7326/0003-4819-158-8-201304160-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Lenchik L, Shi R, Register TC, Beck SR, Beck SR, Langefeld CD, et al. Medición de la densidad mineral ósea trabecular en la columna vertebral torácica mediante tomografía computarizada cuantitativa con compuerta cardíaca. J Comput Assist Tomogr. (2004) 28:134-9. doi: 10.1097/00004728-200401000-00023
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Criterios comunes de terminología para eventos adversos (CTCAE). Versión 5.0. Departamento de Salud y Servicios Humanos de los Estados Unidos, Institutos Nacionales de Salud Instituto Nacional del Cáncer. Maryland (2017).
25. Overgaard J, Bartelink H. Conferencia de consenso sobre efectos tardíos: RTOG/EORTC. Radiother Oncol. (1995) 35:1-82. doi: 10.1016/0167-8140(95)01548-U
CrossRef Full Text | Google Scholar
26. Bentzen SM, Constine LS, Deasy JO, Eisbruch A, Jackson A, Marks LB. Quantitative analyses of normal tissue effect in the clinic (QUANTEC): an introduction to the scientific issues. Int J Radiat Oncol Biol. Phys. (2010) 76(3 Suppl):S3-S9. doi: 10.1016/j.ijrobp.2009.09.040
CrossRef Full Text | Google Scholar
27. Buckens CF, Dijkhuis G, de Keizer B, Verhaar HJ, de Jong PA. Cribado oportunista de la osteoporosis en la tomografía computarizada de rutina? An external validation study. Eur Radiol. (2015) 25:2074-9. doi: 10.1007/s00330-014-3584-0
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Emohare O, Cagan A, Morgan R, Davis R, Asis M, Switzer J, et al. El uso de la atenuación de la tomografía computarizada para evaluar la osteoporosis después de las fracturas agudas de la vértebra torácica y lumbar. Geriatr Orthop Surg Rehabil. (2014) 5:50-5. doi: 10.1177/2151458514525042
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Alacreu E, Moratal D, Arana E. Cribado oportuno de la osteoporosis mediante TC de rutina en el sur de Europa. Osteoporos Int. (2017) 28:983-90. doi: 10.1007/s00198-016-3804-3
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Lee S, Chung CK, Oh SH, Park SB. Correlación entre la densidad mineral ósea medida por absorciometría de rayos X de doble energía y las unidades hounsfield medidas por TC de diagnóstico en la columna lumbar. Korean Neurosurg Soc. (2013) 54:384-9. doi: 10.3340/jkns.2013.54.5.384
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Miyabara Y, Holmes D, Camp J, Miller VM, Kearns AE. Comparación de la densidad mineral ósea calibrada y no calibrada por TC con la DEXA en mujeres menopáusicas. Climacteric. (2012) 15:374-81. doi: 10.3109/13697137.2011.618566
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Park SH, Kim JC, Lee JE, Park IK. Fractura por insuficiencia pélvica después de la radioterapia en pacientes con cáncer de cuello uterino en la era de la PET/TC. Radiat Oncol J. (2011) 29:269-76. doi: 10.3857/roj.2011.29.4.269
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Wei RL, Jung BC, Manzano W, Sehgal V, Klempner SJ, Lee SP, et al. Pérdida de densidad mineral ósea en las vértebras torácicas y lumbares después de la radiación para los cánceres abdominales. Radiother Oncol. (2016) 118:430-6. doi: 10.1016/j.radonc.2016.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply