Calor
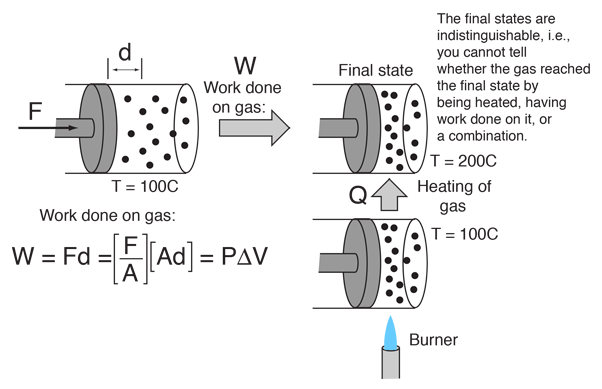
Este ejemplo de la intercambiabilidad del calor y el trabajo como agentes para añadir energía a un sistema puede ayudar a disipar algunas ideas erróneas sobre el calor. Encontré la idea en un pequeño artículo de Mark Zemansky titulado «The Use and Misuse of the Word ‘Heat’ in Physics Teaching». Una idea clave de este ejemplo es que si te presentan un gas a alta temperatura, no puedes decir si alcanzó esa alta temperatura por haber sido calentado, o por haber realizado trabajo sobre él, o una combinación de ambos.
Para describir la energía que tiene un objeto a alta temperatura, no es un uso correcto de la palabra calor decir que el objeto «posee calor» – es mejor decir que posee energía interna como resultado de su movimiento molecular. La palabra calor está mejor reservada para describir el proceso de transferencia de energía de un objeto a alta temperatura a otro a menor temperatura. Es cierto que se puede tomar un objeto a baja energía interna y elevarlo a una energía interna más alta calentándolo. Pero también puedes aumentar su energía interna realizando un trabajo sobre él, y como la energía interna de un objeto a alta temperatura reside en el movimiento aleatorio de las moléculas, no puedes saber qué mecanismo se utilizó para darle esa energía.
Al advertir a profesores y alumnos por igual sobre las trampas del mal uso de la palabra «calor», Mark Zemansky aconseja reflexionar sobre el jingle:
«Enseñar física térmica |
No te refieras al «calor en un cuerpo», ni digas «este objeto tiene el doble de calor que ese cuerpo». También se opone al uso del vago término «energía térmica» y al uso de la palabra «calor» como verbo, porque alimentan los conceptos erróneos, pero es difícil evitar esos términos. Él aconsejaría la introducción y el uso del concepto de energía interna lo antes posible. |
Zemansky señala la Primera Ley de la Termodinámica como una relación clarificadora. La Primera Ley identifica tanto el calor como el trabajo como métodos de transferencia de energía que pueden provocar un cambio en la energía interna de un sistema. A partir de ahí, ni las palabras trabajo ni calor tienen ninguna utilidad para describir el estado final del sistema – sólo podemos hablar de la energía interna del sistema.
| Equivalente mecánico del calor | Primera ley de la termodinámica | Cálculo |
Leave a Reply