Anatomía de los ganglios cardíacos y del sistema de conducción especializada auriculoventricular | Revista Española de Cardiología
INTRODUCCIÓN
Los estudios clásicos de Stannius1 en 1852 fueron los primeros en proponer que la conducción cardíaca era miogénica. Hace aproximadamente un siglo se demostró que el tejido muscular especializado era el responsable del inicio y la propagación de los latidos del corazón. En 1906, Sunao Tawara2 confirmó la existencia de un haz muscular descrito por His3 en 1893. También en 1906, Keith y Flack4 confirmaron la existencia del sistema His-Tawara. Un año después describieron la estructura del nodo sinoauricular (SA).5
Aunque Purkinje6 fue el primero en describir las fibras ventriculares especializadas, desconocía su importancia en la estructura del corazón, y fue Tawara2 quien demostró que el haz muscular descrito por His era continuo con las fibras ventriculares de Purkinje.6 Los estudios de Tawara han sido traducidos recientemente al inglés,7 aunque la primera traducción de parte de su obra a este idioma fue realizada por Robb8 en su libro de texto de 1965. Estos trabajos son de lectura básica para todos los investigadores que quieran estudiar el sistema de conducción cardíaco (SC).
COMPONENTES DEL SISTEMA DE CONDUCCIÓN ATRIOVENTRICULAR
El haz muscular que conecta las aurículas con los ventrículos fue descrito por His3 como un «haz penetrante». Sin embargo, His no observó la continuación histológica de este haz en la aurícula derecha con el nodo auriculoventricular (AV), los ventrículos o las células de Purkinje ventriculares. Fue Tawara2 quien reconoció esta conexión mientras trabajaba en su doctorado bajo la dirección de Aschoff. Anteriormente, en 1893, tanto Kent9 como His3 habían descrito conexiones musculares AV que fueron motivo de gran confusión durante muchos años.10 Posteriormente, se observó que estas conexiones no se encontraban en los corazones sanos, sino en los enfermos.
A partir de los hallazgos de Kent y His, tanto los cardiólogos clínicos como los fisiólogos buscaron la estructura responsable de generar el impulso cardíaco. Se sospechaba que estaba situada en la zona de unión entre la vena cava superior y la aurícula derecha; en condiciones experimentales es la última parte del corazón que deja de latir (el llamado ultimum moriens). En 1907, Keith y Flack5 distinguieron el SA o nodo sinusal en todos los mamíferos que estudiaron, incluido el ser humano. Se creía que sus células constitutivas eran el lugar de origen del impulso cardíaco.
El SC surge en el nodo SA, que se encuentra en la parte superior anterior de la aurícula derecha (Figura 1). El nodo AV se encuentra en una posición inferior y posterior en la aurícula. El SC se extiende desde el nodo AV hasta el haz de His penetrante y luego se divide en las ramas izquierda y derecha del haz, que descienden a través del tabique interventricular, envueltas en una vaina de tejido conectivo que las aísla del tejido muscular circundante. En el interior del miocardio son continuas con la red de Purkinje (Figura 1).
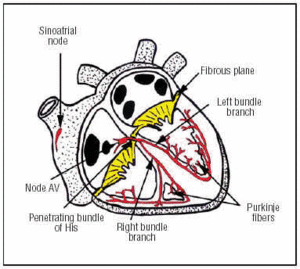
Fig. 1. Representación esquemática del sistema de conducción cardíaco (rojo). El haz de His penetrante perfora el plano fibroso auriculoventricular (AV).
Áreas de interés morfológico-macroscópico
Varias áreas de interés macroscópico ayudan a localizar el SC cardíaco. El nodo SA, que es subepicárdico (Figura 2a), está encajado en la unión entre la musculatura de la vena cava superior y la del apéndice auricular. Su base es opuesta a la cresta terminal. La distancia entre el nodo SA y el epicardio es de 0,3±0,1 mm.11 En aproximadamente el 10% de las personas, el nodo no se extiende hacia la vena cava inferior, sino que se sitúa en forma de herradura alrededor de la parte inferior del orificio de la vena cava superior.12 El nodo AV se encuentra en la base del tabique auricular, en el vértice de una zona triangular ilustrada por primera vez por Koch.13 Este triángulo está situado en la superficie endocárdica de la aurícula derecha (Figuras 2b y c), está delimitado anteriormente por la inserción de la valva septal de la válvula tricúspide y posteriormente por un tendón fibroso conocido como tendón de Todaro. Este tendón es la continuación fibrosa subendocárdica de la válvula de Eustaquio, y se inserta en la musculatura auricular que separa el orificio del seno coronario de la fosa oval. El vértice de este triángulo está formado superiormente por la unión de los bordes anterior y posterior mencionados anteriormente, que corresponde al cuerpo fibroso central (CFB) del corazón. La base del triángulo está formada por el orificio del seno coronario junto con el vestíbulo de la aurícula derecha que sostiene la valva septal de la válvula tricúspide. Esta base es conocida por los electrofisiólogos como istmo septal, y es aquí donde se realiza la ablación por radiofrecuencia de la vía lenta en pacientes con taquicardia reentrante del nódulo AV.14
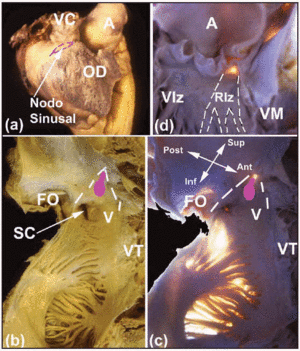
Fig. 2. A: vista epicárdica lateral de la aurícula derecha con el sitio del nodo SA mostrado por la línea rosa discontinua. B y C: vistas endocárdicas (normal y con transiluminación) de las paredes posterior y septal de la aurícula derecha para mostrar la fosa oval (OF) y los límites del triángulo de Koch (líneas blancas discontinuas), el tendón de Todazo (TT) y la inserción de la cúspide septal de la válvula tricúspide (TV). El vestíbulo (V) de la aurícula derecha y el orificio del seno coronario (SC) forman el límite inferior. La ubicación del nodo AV se muestra mediante un nódulo ovalado (rosa). D: vista del ventrículo izquierdo para mostrar el septo membranoso (transiluminación). Este es el punto de emergencia del haz de His y su continuidad con las ramas derecha e izquierda del haz. La rama izquierda del haz de His está marcada con líneas blancas discontinuas. A: aorta; AA: apéndice auricular; VC: vena cava superior; VD: ventrículo derecho; VI: ventrículo izquierdo; VM: válvula mitral.
La continuación de la conducción AV se produce a través del haz de His penetrante, la única parte del eje conductor que perfora el CFB. El CFB está formado por la unión del tejido conectivo de las valvas de las válvulas cardíacas aórtica y mitral con la valva septal de la válvula tricúspide -el llamado trígono fibroso derecho- y la parte membranosa del tabique interventricular. En muchos corazones de mamíferos, el trígono es fibroso, pero los corazones bovinos tienen una masa central de hueso o cartílago (el os cordis). Por el contrario, el tejido fibroso del CFB del cachalote es muy laxo. La porción membranosa o septum, que puede variar en longitud, es una buena guía para localizar el haz AV de His. Este aparece por encima de esta porción membranosa después de cruzar el trígono fibroso derecho (Figura 2d), y luego se divide en las ramas izquierda y derecha del haz. La rama derecha atraviesa la musculatura septal en la base del músculo papilar medial del ventrículo derecho. A continuación, se convierte en un fino cordón que penetra profundamente en la trabeculación septomarginal o banda moderadora que conecta los músculos papilares medial y anterior. El origen de la rama izquierda se encuentra por debajo de la comisura entre las cúspides derecha y no coronaria de la válvula aórtica; luego desciende a través del subendocardio del tabique interventricular (Figura 2d). Su recorrido es a veces visible debido a la lámina fibrosa brillante que lo recubre. La parte proximal de la rama izquierda es mucho más larga que la de la derecha. Ocasionalmente se observa en los corazones fetales o infantiles una tercera rama llamada «tracto sin salida «15 que continúa el haz de His en dirección antero-superior hacia la raíz de la aorta.
Estructura de los ganglios y del sistema de conducción auriculoventricular
Los estudios en los que las técnicas histológicas empleadas fueron similares a las utilizadas por Tawara2 y trabajadores posteriores como Davies16 y Truex et al17 (por mencionar sólo algunos) han demostrado que el SC de los seres humanos está dispuesto de manera bastante similar al de otros mamíferos (con ligeras variaciones entre especies y entre corazones). Tawara2 informó de la separación de los miocitos especializados de los miocitos normales o de trabajo por una fina lámina de tejido conectivo visible al microscopio óptico, y en ello se basan los criterios propuestos por Aschoff18 y Mönckeberg19 para la identificación histológica del miocardio especializado. En pocas palabras, los miocitos especializados se distinguen de los miocitos de trabajo cuando se observan al microscopio óptico, y pueden «seguirse» de una sección histológica a la siguiente. En su monografía, Robb8 prefirió definir el tejido conductor con el término «sistema conector» en lugar de «conductor», porque las preparaciones histológicas definen mejor la morfología celular que la función. También observó diferencias en la textura del miocardio especializado en función de la frescura del material de autopsia y de los métodos de fijación y tinción utilizados. Tawara2 era consciente de ello y señaló la heterogeneidad de la morfología de los miocitos especializados incluso en secciones histológicas del corazón. Dentro de una misma especie, las diferencias más evidentes están relacionadas con la edad de los individuos examinados.20 En los últimos años se han utilizado diferentes marcadores moleculares e inmunohistoquímicos para localizar el tejido conductor en corazones embrionarios de humanos y otros mamíferos. Sin embargo, no se ha encontrado ningún marcador específico que pueda resaltar este tejido en humanos adultos.
En el corazón humano normal, los ganglios SA y AV no cumplen los criterios de Aschoff y Mönckeberg18,19 porque no están aislados eléctricamente del miocardio circundante por tejido conectivo o graso. Más bien, entran en contacto con las fibras de trabajo auricular tras una pequeña zona compuesta por células de transición. En el nodo SA, Keith y Flack5 distinguieron entre las células sinusales y las de trabajo. Sin embargo, Tawara2 indicó las dificultades que encontró para diferenciar las células del nodo AV de las del haz de His. Por ello, propuso que la diferencia entre ellas era puramente anatómica. Sobre la base de esta definición, la porción del SC completamente envuelta por el CFB se denomina haz penetrante o haz de His (Figura 3a). La porción auricular desde el sistema de conducción proximal hasta el haz de His se denomina nodo AV (Figura 3b). Esta distinción anatómica es lógica porque el aislamiento del haz de His penetrante le impide entrar en contacto directo con la actividad eléctrica de la aurícula aferente. Por tanto, cualquier actividad auricular debe dirigirse previamente a través del nodo AV.
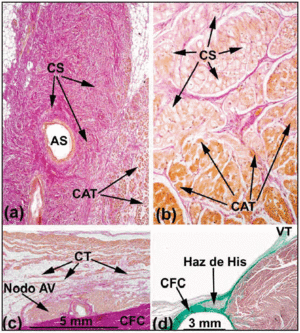
Fig. 3. Secciones histológicas sagitales del nodo sinoauricular (SA) del corazón humano (a;x10) y porcino (b;x40) teñidas con el método de van Gieson. Obsérvese el contacto entre las células sinusales (SC) y las células auriculares de trabajo (WAC). Las células sinusales se caracterizan por ser más claras y estar incrustadas en una mayor cantidad de tejido conectivo (rojo). c: sección teñida con el método de van Gieson de la zona media del triángulo de Koch. Obsérvese la forma del nodo AV compacto y las células transicionales (CT) en contacto con la superficie convexa del nodo compacto. d: Sección teñida con tricromía de Masson que muestra el haz penetrante de His rodeado de tejido fibroso (verde) del CFB. ANS: arteria del nodo sinusal; CFB: cuerpo fibroso central; TV: válvula tricúspide.
La función intrínseca del nodo SA es ser la fuente del impulso cardíaco. El nodo SA en los humanos es una estructura arqueada o fusiforme. Histológicamente se compone de células ligeramente más pequeñas que las células de trabajo normales que están dispuestas en haces. Estos se mezclan sin orden espacial, se tiñen débilmente y están incrustados en una densa matriz de tejido conectivo (Figuras 3 a y b). Con la edad, la cantidad de tejido conectivo aumenta con respecto al área ocupada por las células nodales.21 En la periferia del nodo, las células especializadas se mezclan con las del miocardio de trabajo (Figuras 3a y b). Además, se han descrito múltiples radiaciones o prolongaciones que se interdigitan con el miocardio auricular de trabajo. Estas penetran intramiocárdicamente en la cresta terminal y en la vena cava superior e inferior. El nodo SA está dispuesto alrededor de una arteria conocida como arteria del nodo sinusal, que puede discurrir de forma central o excéntrica dentro del nodo. En el 29% de los corazones humanos, esta arteria se ramifica dentro del nodo.11 El nodo SA también está íntimamente asociado con el sistema nervioso autónomo. Se ha sugerido que la mayoría de estas fibras nerviosas son parasimpáticas, concentrándose las fibras simpáticas alrededor de los vasos sanguíneos del nodo.23
La función inherente del nodo AV es retrasar el impulso cardíaco. En el ser humano, este nodo tiene una porción compacta y una zona de células de transición. La primera es semiovalada y se encuentra sobre el CFB (Figura 3c). En las secciones cercanas a la base del triángulo de Koch, la parte compacta del nodo se divide en dos extensiones o prolongaciones. La arteria que vasculariza el nodo AV suele encontrarse entre éstas. La longitud de estas prolongaciones varía de un corazón a otro.24 El tamaño de las células de transición es intermedio entre las del nodo AV y las células de trabajo auricular. Están rodeadas por una mayor cantidad de células conectivas que las que cubren las células de trabajo, pero no están aisladas del miocardio adyacente. Más bien, forman una especie de puente entre el miocardio de trabajo y el nodal, y recogen la información eléctrica de las paredes auriculares, transmitiéndola al nodo AV.
La controversia rodea la forma en que el impulso del nodo SA llega al nodo AV. Algunos autores han sugerido la existencia de tractos especializados entre ambos.25 Nuestros estudios no apoyan esta idea, sino que favorecen la hipótesis de que las propias fibras musculares de trabajo (y su disposición geométrica en las paredes auriculares) son las responsables de que la conducción sea más rápida en unas zonas de la aurícula que en otras.26
El nodo AV se continúa distalmente con el haz de His penetrante (Figura 3d), aunque existen ligeras diferencias en cuanto a la disposición celular entre estas dos estructuras, incluyendo la disposición del haz de His de forma más paralela. La explicación podría ser morfológica: el haz de His empieza a estar rodeado por el tejido conectivo del CFB, convirtiéndose así en un tracto conductor que lleva la información a los ventrículos.
El nodo AV del perro es más pequeño que el de los humanos, pero tiene un haz de His penetrante más largo.27 Algunos autores28 interpretan que una parte del nodo AV del perro se encuentra dentro del CFB. En el conejo, otros autores29 describen parte del haz de His como si formara parte del nodo AV, pero esto es un error (Figuras 4a-d). La diferencia morfológica más destacada entre el nodo AV del perro y los del conejo y el ser humano es que el primero no está cubierto por células de transición. En las ratas (con una frecuencia cardíaca en reposo 10 veces superior a la de los perros o los humanos), el nodo AV es proporcionalmente comparable al del perro, pero el BFC es más pequeño.
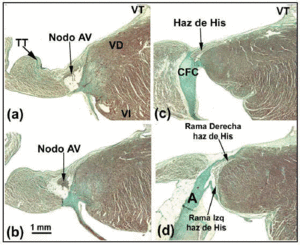
Fig. 4. Esta figura compuesta muestra el nodo auriculoventricular (AV) más el haz de His y sus ramas derecha e izquierda en el conejo. La barra horizontal en b representa 1 mm (igual para todas las imágenes). Tinción con tricrómico de Masson. A: aorta; TT: tendón de Todaro; VD: ventrículo derecho; VI: ventrículo izquierdo; VT: válvula tricúspide.
Cuando se sigue la trayectoria histológica del sistema de conducción hacia el haz de His penetrante, se observa que éste gira hacia la izquierda en muchos corazones humanos y emerge en la cresta muscular del tabique interventricular. Rodeado por el tejido conectivo del CFB, la longitud del haz de His puede variar antes de dividirse en las ramas izquierda y derecha del haz. La primera rama cae en cascada sobre el lado izquierdo del tabique interventricular (Figuras 5a y c). La división del haz de His se asemeja a un jinete en cuclillas sobre la cresta muscular del tabique interventricular (Figura 5a). Sin embargo, en ocasiones se desvía hacia la izquierda (Figura 5c). Cuando esto ocurre, la rama derecha penetra en el interior de la musculatura del septo (Figura 5b), apareciendo en el ventrículo derecho en asociación con la inserción del músculo papilar medial.
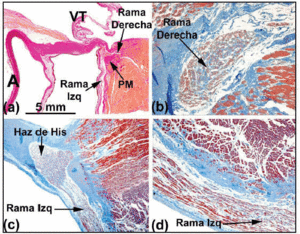
Fig. 5. a: sección teñida por Van Gieson que muestra el haz de His (corazón humano) sobre la porción membranosa (MP) del septo interventricular. b: en su origen, la rama derecha en este corazón es intramiocárdica y está rodeada de tejido conectivo (azul) (tinción de tricrómico de Jones, x20). c: la división del haz de His en este corazón está desplazada sobre el lado izquierdo de la cresta muscular del tabique interventricular, y desciende longitudinalmente bajo el endocardio del ventrículo izquierdo (tricromía de Jones, x5). d: obsérvese la vaina conectiva de recubrimiento (azul) de la rama izquierda (tricromía de Jones, x10). A: aorta; E: endocardio; TV: válvula tricúspide.
A lo largo de su curso proximal, las ramas derecha e izquierda del haz están cubiertas por una lámina fibrosa (figuras 5b y d). Como demostró Tawara2 (figura 6a), en el ser humano la rama izquierda suele estar dividida en tres fascículos con amplia intercomunicación. Estos fascículos se ramifican en el ápice ventricular y se extienden hacia el interior de los dos músculos papilares de la válvula mitral, pero también hacia atrás a lo largo de las paredes ventriculares hacia la base cardíaca. Más distalmente, en el ápice de los ventrículos del corazón humano, resulta casi imposible rastrear las ramificaciones de las fibras de Purkinje, ya que éstas pierden su capa fibrosa y se parecen mucho al miocardio de trabajo.
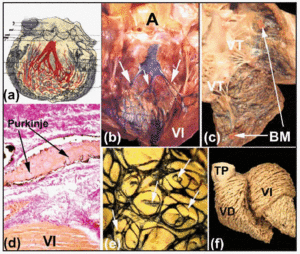
Fig. 6. a: diagrama de Tawara que muestra la disposición trifascicular de la rama izquierda del haz de His. b y c: un corazón de ternera fresco en el que se han abierto los ventrículos derecho e izquierdo. Las inyecciones subendocárdicas de tinta china revelan las ramas derecha e izquierda del haz y la red de Purkinje. Obsérvese en B los tres fascículos de la rama izquierda del haz (flechas), y en C la banda moderadora (MB). d: sección de un corazón de ternera (tinción de van Gieson, x100) obtenida tras inyectar tinta china en la red de Purkinje), que está envuelta en su origen por tejido conectivo (rojo). e: disposición subendocárdica de la red de Purkinje en el ventrículo izquierdo de una ternera. Obsérvese la disposición elíptica de la red y las ramificaciones de los bordes que penetran en el miocardio (flechas). f: disección de las fibras musculares ventriculares de un corazón humano adulto. Obsérvese la diferencia de disposición entre las capas medial y profunda del ventrículo izquierdo. A: aorta; TP: tronco pulmonar; LV: ventrículo izquierdo; TV: válvula tricúspide.
La inyección subendotelial de tinta china es uno de los métodos utilizados para observar estas láminas fibrosas y demostrar el curso subendocárdico de las ramas del haz derecho e izquierdo y sus ramificaciones en los corazones de ungulados (figuras 6b y d). Nuestros estudios sobre los corazones de las ovejas y los terneros muestran que estos varían un poco de los corazones humanos. Los corazones de terneros son más parecidos a los humanos en el sentido de que los fascículos de la rama izquierda suelen ser tres y se originan en la parte superior del tabique interventricular (figura 6b). Sin embargo, los corazones de oveja sólo muestran dos fascículos, y éstos aparecen en la mitad de la longitud de la pared septal. Tanto en el corazón de oveja como en el de ternera, pequeñas trabéculas musculares atraviesan la cavidad ventricular -el llamado «falso tendón»- que en su interior llevan ramificaciones distales de las ramas de His hacia los músculos papilares y las paredes ventriculares adyacentes. En el lado derecho del corazón, la banda moderadora tanto del corazón de oveja como del de ternera es más delgada que la de los humanos, pero en su interior siempre contiene una ramificación de la rama derecha del haz de His (Figura 6c).
En los corazones de ungulados la red subendocárdica de Purkinje tiene una disposición elíptica, tanto en el ventrículo izquierdo como en el derecho (Figura 6e). Además, de su contorno surgen ramas que penetran en las paredes ventriculares, dando lugar a nuevas ramas o a anastomosis con otras ramas (Figura 6e). Sin embargo, no se han demostrado ramas intramurales de la red de Purkinje en el corazón humano.30
Un punto controvertido en relación con la red de Purkinje es la existencia de células de transición entre el miocardio ventricular de trabajo y las fibras de Purkinje.31 Los estudios anatómicos e inmunohistoquímicos de Oosthoek et al,30 muestran que, en los corazones bovinos, existe una zona muy pequeña de células de transición donde las fibras de Purkinje pierden su cubierta de tejido conectivo. Sin embargo, no se han observado tales células en el corazón de oveja.32 Cuando las fibras de Purkinje pierden su cubierta de tejido conectivo, los impulsos eléctricos pasan del SC a los miocitos de trabajo de los ventrículos. La orientación espacial de las miofibrillas de trabajo en las paredes de los ventrículos determina la naturaleza anisotrópica de la conducción ventricular (Figura 6f).
CONCLUSIONES
Aunque existen diferencias entre las especies, la estructura de los ganglios, así como la del resto del sistema de conducción AV humano, es similar a la de los animales de laboratorio utilizados habitualmente. El nodo SA, la estructura que genera el impulso cardíaco, está situado en un extremo de la aurícula derecha. Los impulsos procedentes de él viajan posteriormente en las paredes auriculares a través de una intrincada pero precisa disposición espacial de las fibras auriculares de trabajo hasta llegar al final de la aurícula. En este extremo, las células transitorias del nodo AV reciben el impulso y lo retrasan antes de su transmisión a través del haz de His. Este último atraviesa el plano fibroso aislante entre las aurículas y los ventrículos, y transmite el impulso a través de dos ramas (las ramas derecha e izquierda del haz) hacia los ventrículos correspondientes. Cada una de estas ramas está aislada por una vaina conectiva de miocitos ventriculares en funcionamiento. Esta disposición permite el contacto entre los miocitos especializados y los de trabajo sólo en las ramificaciones distales del haz de His. De este modo, el sistema de conducción AV, descrito en gran medida por Tawara2 hace casi 100 años, está estructurado para dar orden a la transmisión de los impulsos cardíacos. Conocer la estructura y la localización del tejido conductor específico dentro del corazón podría ayudar a proporcionar soluciones a diferentes alteraciones del ritmo cardíaco.
Leave a Reply