8.3: Gases y presión
Objetivos de aprendizaje
- Describir la fase gaseosa.
La fase gaseosa es única entre los tres estados de la materia en el sentido de que existen algunos modelos simples que podemos utilizar para predecir el comportamiento físico de todos los gases-independientemente de sus identidades. No podemos hacer esto para los estados sólido y líquido. De hecho, el desarrollo de esta comprensión del comportamiento de los gases representa el punto de separación histórico entre la alquimia y la química moderna. Los primeros avances en la comprensión del comportamiento de los gases fueron realizados a mediados de 1600 por Robert Boyle, un científico inglés que fundó la Royal Society (una de las organizaciones científicas más antiguas del mundo).
¿Cómo es que podemos modelar todos los gases independientemente de su identidad química? La respuesta está en un grupo de afirmaciones llamadas teoría cinética de los gases:
- Los gases están compuestos por partículas diminutas que están separadas por grandes distancias.
- Las partículas de los gases están en constante movimiento, experimentando colisiones con otras partículas de gas y con las paredes de su contenedor.
- La velocidad de las partículas de gas está relacionada con la temperatura de un gas.
- Las partículas de gas no experimentan ninguna fuerza de atracción o repulsión entre sí.
¿Has notado que ninguna de estas afirmaciones está relacionada con la identidad del gas? Esto significa que todos los gases deberían comportarse de forma similar. Un gas que sigue perfectamente estas afirmaciones se llama gas ideal. La mayoría de los gases muestran ligeras desviaciones de estas afirmaciones y se denominan gases reales. Sin embargo, la existencia de gases reales no disminuye la importancia de la teoría cinética de los gases.
Una de las afirmaciones de la teoría cinética menciona las colisiones. Como las partículas de gas están en constante movimiento, también chocan constantemente entre sí y con las paredes de su contenedor. Hay fuerzas implicadas cuando las partículas de gas rebotan en las paredes del recipiente (Figura \(\PageIndex{1}\)). La fuerza generada por las partículas de gas dividida por el área de las paredes del recipiente da como resultado la presión. La presión es una propiedad que podemos medir para un gas, pero normalmente no tenemos en cuenta la presión para los sólidos o los líquidos.
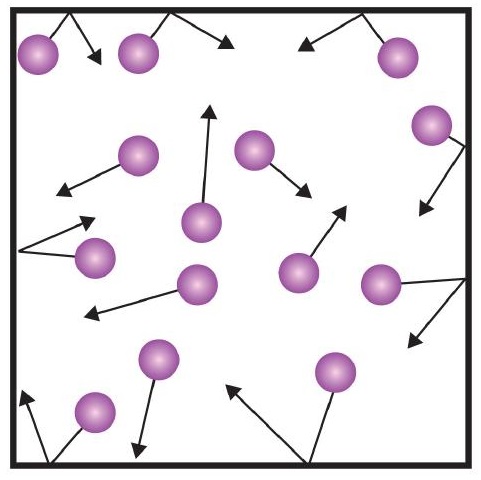
La unidad básica de presión es el newton por metro cuadrado (N/m2). Esta unidad combinada se redefine como pascal (Pa). Un pascal no es una cantidad de presión muy grande. Una unidad de presión más útil es el bar, que equivale a 100.000 Pa (1 bar = 100.000 Pa). Otras unidades comunes de presión son la atmósfera (atm), que se definió originalmente como la presión media de la atmósfera terrestre a nivel del mar; y los mmHg (milímetros de mercurio), que es la presión generada por una columna de mercurio de 1 mm de altura. La unidad milímetros de mercurio también se denomina torr, en honor al científico italiano Evangelista Torricelli, que inventó el barómetro a mediados del siglo XVI. Una definición más precisa de atmósfera, en términos de torr, es que hay exactamente 760 torr en 1 atm. Un bar equivale a 1,01325 atm. Dadas todas las relaciones entre estas unidades de presión, la capacidad de convertir de una unidad de presión a otra es una habilidad muy útil.
Ejemplo \N(\Nde la página{1}): Conversión de presiones
Escribir un factor de conversión para determinar cuántas atmósferas hay en 1,547 mmHg.
Solución
Dado que 1 mmHg es igual a 1 torr, la presión dada también es igual a 1,547 torr. Como hay 760 torr en 1 atm, podemos usar este factor de conversión para hacer la conversión matemática:
(\mathrm{1,547\: torr\times \dfrac{1\: atm}{760\: torr}=2.04\: atm})
Nota cómo las unidades de torr se cancelan algebraicamente.
Ejercicio \(\PageIndex{1}): Conversión de presiones
Escribe un factor de conversión para determinar cuántos milímetros de mercurio hay en 9,65 atm.
Responde
(\mathrm{9,65\: atm\times \dfrac{760\: mm Hg}{1\: atm}=7,334 \: mm Hg}\).
La teoría cinética también afirma que no hay interacción entre las partículas individuales del gas. Aunque sabemos que, de hecho, existen interacciones intermoleculares en los gases reales, la teoría cinética asume que las partículas del gas están tan separadas que las partículas individuales no se «sienten» unas a otras. Por lo tanto, podemos tratar las partículas del gas como pequeños trozos de materia cuya identidad no es importante para ciertas propiedades físicas.
Ejercicio de repaso de conceptos
-
¿Qué es la presión y qué unidades utilizamos para expresarla?
Respuesta
-
La presión es la fuerza por unidad de superficie; sus unidades pueden ser pascales, torr, milímetros de mercurio o atmósferas.
Lo más importante
- La fase gaseosa tiene ciertas propiedades generales características de esa fase.
Ejercicios
-
¿Qué es la teoría cinética de los gases?
-
Según la teoría cinética de los gases, las partículas individuales del gas están (siempre, frecuentemente, nunca) en movimiento.
-
¿Por qué un gas ejerce presión?
-
¿Por qué la teoría cinética de los gases nos permite suponer que todos los gases tendrán un comportamiento similar?
-
Ordenar las siguientes cantidades de presión de menor a mayor: 1 mmHg, 1 Pa y 1 atm.
-
¿Qué unidad de presión es mayor-el torr o la atmósfera?
-
¿Cuántos torr hay en 1.56 atm?
-
Convierte 760 torr en pascales.
-
Las presiones sanguíneas se expresan en milímetros de mercurio. ¿Cuál sería la presión arterial en atmósferas si la presión arterial sistólica de un paciente es de 120 mmHg y la presión arterial diastólica es de 82 mmHg? (En medicina, dicha presión arterial se reportaría como «120/82», que se habla como «ciento veinte sobre ochenta y dos»)
-
En la predicción del tiempo, la presión barométrica se expresa en pulgadas de mercurio (in. Hg), donde hay exactamente 25,4 mmHg en cada 1 in. Hg. ¿Cuál es la presión barométrica en milímetros de mercurio si se informa de que la presión barométrica es de 30,21 pulg. Hg?
Respuestas
-
Los gases están compuestos por partículas diminutas que están separadas por grandes distancias. Las partículas de gas están en constante movimiento, experimentando colisiones con otras partículas de gas y con las paredes de su contenedor. La velocidad de las partículas de gas está relacionada con la temperatura de un gas. Las partículas del gas no experimentan ninguna fuerza de atracción o repulsión entre sí.
-
Un gas ejerce presión al rebotar sus partículas contra las paredes de su recipiente.
-
1 Pa, 1 mmHg, y 1 atm
-
1.190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
Leave a Reply