Selvdestruerende myg og steriliserede gnavere: løftet om gen-drev
Austin Burt og Andrea Crisanti havde i otte år forsøgt at kapre myggenomet. De ønskede at omgå den naturlige udvælgelse og indsætte et gen, der ville svømme hurtigere gennem populationen end en mutation, der overleveres ved den sædvanlige arveproces. I baghovedet havde de en måde at forebygge malaria på ved at sprede et gen, der kunne slå myggepopulationer ud, så de ikke kunne overføre sygdommen.
Crisanti husker, at det mislykkedes igen og igen. Men endelig, i 2011, fik de to genetikere på Imperial College London de DNA-resultater tilbage, som de havde håbet på: Et gen, som de havde indsat i myggenes genom, havde spredt sig gennem populationen og nået mere end 85 % af insekternes efterkommere1.
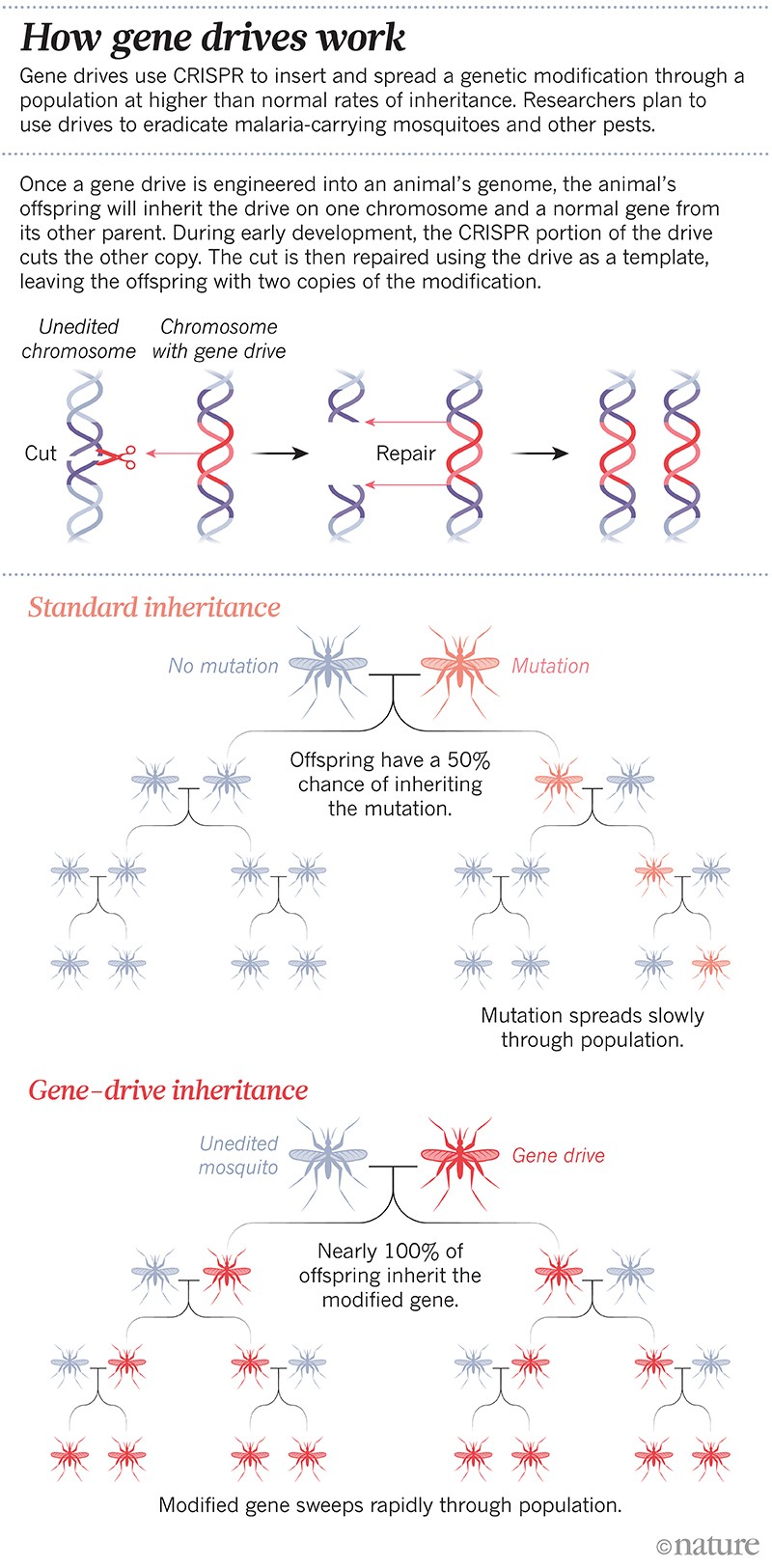
Det var det første konstruerede “gen-drev”: en genetisk ændring, der er designet til at sprede sig gennem en population med en højere arvehastighed end normalt. Gen-drev er hurtigt blevet en rutineteknologi i nogle laboratorier; forskerne kan nu fremstille et drev på få måneder. Teknikken er baseret på genredigeringsværktøjet CRISPR og nogle stykker RNA til at ændre eller lukke munden på et bestemt gen eller indsætte et nyt. I den næste generation kopierer hele drevet sig selv til sit partnerkromosom, således at genomet ikke længere har den naturlige version af det valgte gen, men i stedet har to kopier af gendrevet. På denne måde videregives ændringen til op til 100 % af afkommet i stedet for ca. 50 % (se “Hvordan gen-drev virker”).
Siden 2014 har forskere konstrueret CRISPR-baserede gen-drev-systemer i myg, frugtfluer og svampe og er i øjeblikket ved at udvikle dem i mus. Men det er kun begyndelsen af historien. Spørgsmålene om, hvorvidt et gen-drev er muligt, er blevet fortrængt af andre ubekendte spørgsmål: hvor godt de vil fungere, hvordan de skal testes, og hvem der skal regulere teknologien. Gene drives er blevet foreslået som en måde at reducere eller eliminere insektbårne sygdomme på, kontrollere invasive arter og endda vende insektmiddelresistens hos skadedyr. Der er endnu ikke blevet frigivet nogen manipuleret gendrev i naturen, men teknologien kan i princippet være klar allerede om tre år, siger Crisanti. Han samarbejder med Target Malaria, et nonprofit internationalt forskningskonsortium, der forsøger at bruge gen-drevne myg til malariakontrol i Afrika. Den 1. juli udsatte gruppen et testparti af myg – genetisk manipulerede, men endnu ikke udstyret med gen-drev – i en landsby i Burkina Faso.
Gen-drev ligner ikke noget økologisk fix, der nogensinde er blevet afprøvet før, siger Fredros Okumu, videnskabelig direktør ved Ifakara Health Institute i Dar es Salaam i Tanzania. “Gen-drev vil sprede sig af sig selv”, siger han. “Vi er nødt til at forberede folk og dele oplysninger åbent med alle de berørte lande.”
De tekniske udfordringer er ikke så skræmmende som de sociale og diplomatiske, siger bioingeniør Kevin Esvelt fra Massachusetts Institute of Technology (MIT) Media Lab i Cambridge, som var blandt de første til at bygge et CRISPR-baseret gen-drev. “Teknologier som denne har reelle konsekvenser for menneskers liv, som kan være næsten øjeblikkelige.”
I betragtning af de potentielle bekymringer omkring gen-drev udforsker Nature fem centrale spørgsmål om teknologien og dens anvendelser.
Vil gen-drev overhovedet virke?
Bygge et gen-drev for at manipulere eller udrydde en population er som at tage kampen op med den naturlige selektion, og den kamp er måske ikke let at vinde.
Så snart forskerne begyndte at lave gen-drev regelmæssigt i laboratorier, udviklede dyrene modstand mod dem – de ophobede mutationer, der forhindrede drivkræfterne i at blive spredt. I forsøg med to drev, der blev indsat i frugtfluer, blev der f.eks. hyppigt dannet genetiske varianter, der gav resistens2. Oftest ændrer mutationer en sekvens, som CRISPR er indstillet til at genkende, hvilket forhindrer, at genet redigeres. I forsøg med myg i bur så Crisanti og Tony Nolan, der forsker i Target Malaria, hvordan et gen-drev gradvist faldt i hyppighed over flere generationer på grund af resistente mutationer i målgenet3. Resultaterne rystede feltet. Ville resistens gøre gen-drev impotente?
Nødvendigvis ikke – hvis forskerne vælger det rigtige mål. Nogle gener er meget bevarede, hvilket betyder, at enhver ændring sandsynligvis vil dræbe deres ejere. Hvis disse gener vælges som mål for et drev, betyder det færre mutationer og mindre resistens. I september 2018 nedlagde Crisanti og hans team en population af Anopheles gambiae-myg i bur med 100 % effektivitet4 ved at lave et drev, der forstyrrer et frugtbarhedsgen kaldet doublesex. Med drevet på plads kan hunmyggene ikke bide og lægger ikke æg; i løbet af 8-12 generationer producerede burpopulationerne ingen æg overhovedet. Og fordi det er afgørende for forplantning, er doublesex modstandsdygtigt over for mutationer, herunder mutationer, der ville give resistens over for et drevkonstrukt.
Gruppen har gennemført ni burforsøg med mere end en million drevindsættelser rettet mod doublesex og har ikke set nogen resistens, siger Crisanti. Nu er holdet ved at tilpasse drevet til at skære ikke én, men to loci på doublesex-genet, ligesom man behandler en sygdom med en kombination af lægemidler. “Jeg vil sikre mig, at sandsynligheden for at udvikle resistens er meget, meget lille, før jeg siger, at teknologien er klar til at blive anvendt”, siger Crisanti.
I pattedyr har forskerne langt mere grundlæggende udfordringer end resistens at tage fat på. Sidste år konstruerede Kim Cooper og hendes kolleger på University of California, San Diego (UCSD), begyndelsen af et gen-drev i et pattedyr – et drev, der afbryder et gen i musen, Tyr, og som gør dyrenes pels hvid5. Drevet var kun 72 % effektivt til at kopiere sig selv i genomet og fungerede ikke godt i den mandlige kimlinje, siger Cooper. Hun formoder, at det skyldes, at celledeling sker på forskellige tidspunkter i forbindelse med dannelsen af æg og sædceller, hvilket tilsyneladende påvirker drevets evne til at kopiere fra et kromosom til et andet.
I dette forsøg formerede drevet sig ikke selv, og Cooper fulgte ikke egenskaben over flere generationer, så hun understreger, at det teknisk set ikke kan betragtes som et gendrev. “Der er stadig så meget arbejde, der skal gøres for at vise, at noget som dette overhovedet er muligt”, tilføjer hun.
Hvad er gen-drev ellers gode til?
Og selv om myggeapplikationer dominerer feltet, omfatter foreslåede anvendelser af gen-drev også bevarelse af sarte økosystemer og fremskyndelse af laboratoriearbejde.
Nogle organismer har genomer, der er udfordrende at manipulere, men det kan hjælpe forskerne med at studere dem. Tag Candida albicans, en ofte lægemiddelresistent svampesygdom hos mennesker. Som postdoktoral forsker ved Broad Institute og MIT i Cambridge, Massachusetts, udviklede Rebecca Shapiro et system6 til at drive mutationer ind i svampen med en effektivitet på næsten 100 %. Hun kan nu opdrætte svampen til at lukke to uafhængige gener ned og lade disse mutationer gå i arv til afkommet. “Det virker vanvittigt effektivt”, siger Shapiro, der nu arbejder på University of Guelph i Canada. På UCSD bruger Cooper gen-drivere til et lignende formål, nemlig til at skabe og studere komplekse egenskaber hos mus.
Genetic Biocontrol of Invasive Rodents (GBIRd)-programmet ønsker at gøre mere med gen-drive-mus end at studere dem i et laboratorium. GBIRd, et partnerskab mellem universiteter, regeringer og ikke-statslige organisationer, der ledes af den almennyttige gruppe Island Conservation, ønsker at bruge teknologien til at udrydde invasive gnavere fra øer, hvor de forårsager ødelæggelser i det oprindelige dyreliv. Pesticider anvendes i øjeblikket til dette formål, men de er dyre og vanskelige at anvende på større øer med menneskelig beboelse. De kan kun anvendes på ca. 15 % af øerne, siger Royden Saah, GBIRd’s programleder. “Vi forsøger at se på teknologier, der kan tage sig af de andre 85 %.”
GBIRd-medlemmer David Threadgill ved Texas A&M University i College Station og Paul Thomas ved University of Adelaide i Australien er ved at udvikle gen-drive-teknologier i mus, selv om Saah vurderer, at der vil gå flere år, før disse drev fungerer med succes.
I mellemtiden håber nogle myggeforskere at prøve noget mere subtilt end at udrydde insektpopulationerne fuldstændigt som et middel til at forebygge sygdomme. I et fortryk7 fra maj har Omar Akbari og hans kolleger på UCSD manipuleret Aedes aegypti-myg til at udtrykke et antistof, der beskytter insekterne mod alle fire store dengue-stammer. De er nu ved at fastgøre dette antistof til et drev for at se, om det vil sprede sig. Akbari er også ved at opbygge et gen-drev til alle formål, der aktiverer et toksin, når en hvilken som helst virus, ikke kun dengue, inficerer A. aegypti. “Vi ønsker at bygge en trojansk hest i myggen”, siger Akbari. “Når en myg bliver inficeret af en virus – uanset om det er dengue, Zika, chikungunya, gul feber eller noget andet – aktiverer den vores system, som dræber myggen.”
Kan gen-drev kontrolleres?
Hvor Kevin Esvelt nogensinde byggede et enkelt CRISPR-baseret gen-drev, vågnede han op med koldsved og tænkte på konsekvenserne. “Jeg indså, åh hey, det her kommer ikke kun til at handle om malaria, det her vil potentielt være noget, som enhver person, der kan lave en transgen frugtflue, kan bygge til at redigere alle frugtfluer.”
Det er derfor ikke overraskende, at da Esvelt og genetikeren George Church i 2014 byggede deres første gen-drev på Harvard Medical School i Boston, Massachusetts, byggede de samtidig et omvendt drev til at overskrive det oprindelige drev på kommando8.
Resten af feltet har fulgt trop og udviklet gen-drev med indbyggede kontroller, eksterne overrides eller begge dele. Det er det amerikanske Defense Advanced Research Projects Agency (DARPA), der er forskningsafdelingen under det amerikanske forsvarsministerium, der finansierer det meste af denne indsats. I 2017 meddelte DARPA’s Safe Genes-program, at det brugte 65 millioner USD på syv amerikanske forskerhold, der undersøger, hvordan man kan kontrollere, modvirke og omvende gen-drev. “Vi mindsker potentialet for misbrug, uanset om det er utilsigtet eller forbryderisk”, siger Renee Wegrzyn, programleder for Safe Genes.
Esvelt, der fik støtte i programmets indledende fase, udtænkte et selvudtømmende drev, der er kendt som et daisy-drev. Drevet er konstrueret til at miste et led ad gangen, som om man plukker en blomst fra en kæde, der er forbundet fra hoved til stilk, indtil det løber ud over flere generationer9.
På UCSD udvikler Akbaris DARPA-finansierede hold gendrev, der ikke skulle være i stand til at sprede sig ud over en målpopulation af myg eller fluer. Et sådant drev kræver kontinuerlig udgivelse i mange generationer. Når disse udgivelser stopper, bliver det fortyndet med vildtypeversioner af genet og udsletter sig selv inden for fire år. Det kan være længe nok til at udrydde en virus som Zika eller dengue fra en myggebestand, siger Akbari. “Det er noget, der efter min mening er lidt mere sikkert og stadig ret effektivt.” Holdet har allerede produceret flere versioner af disse drev til A. aegypti, den vigtigste vektor for denguevirus10.
The Target Malaria-holdet er også ved at udvikle en modforanstaltning, finansieret af DARPA, til at stoppe spredningen af doublesex-drevet i en population.
Hvordan kan gen-drev afprøves?
I stedet for en feltprøve – som DARPA Safe Genes-kontrakten udtrykkeligt forbyder, og som forskerne er enige om, at teknologien ikke er klar til – opskalerer holdene burforsøg og opbygger økologiske modeller for at undersøge fordelene og risiciene ved en vild udsætning på sikker vis.
I byen Terni i det centrale Italien har Crisanti og Nolan beriget deres myggebure med skiftende miljøforhold. “Vi ønsker at opskalere for at teste det på tværs af forskellige genetiske baggrunde under mere realistiske scenarier”, siger Nolan, som nu leder et laboratorium på Liverpool School of Tropical Medicine i Det Forenede Kongerige. Han og Crisanti ønsker at efterligne naturlig parringsadfærd – f.eks. at hanner danner sværme for at tiltrække hunner – for at se, hvordan det påvirker spredningen af et gen-drev.
Dynamikken i drivets spredning i disse bure er indtil videre “lovende”, siger Crisanti – drivet bliver effektivt viderebragt uden tegn på modstand. Hvis der ikke opstår nogen problemer i de større burforsøg, vil holdet overdrage teknologien til uafhængige grupper til afprøvning med henblik på at opnå myndighedsgodkendelse om ca. tre år, siger han.
Target Malaria-holdet er også ved at opbygge økologiske modeller af potentielle udsætningssteder for at finde ud af dynamikken på stedet. Den seneste undersøgelse11 modellerer myggebestandene i mere end 40 000 bosættelser i Burkina Faso og de omkringliggende lande. Den tager højde for floder, søer og nedbør samt feltdata om myggenes bevægelser. Resultaterne11 viser, at der er behov for gentagen introduktion, snarere end en enkelt udsætning, af modificerede myg over nogle få år på tværs af landsbyer for at reducere insekternes samlede antal.
“Teorien siger, at hvis man udsætter dem én gang, vil de i princippet sprede sig over hele kontinentet. Virkeligheden er, at det vil ske meget langsomt,” siger befolkningsbiolog Charles Godfray fra University of Oxford i Storbritannien, der samarbejder med Target Malaria og er hovedforsker i undersøgelsen.
En anden bekymring er, at gen-drev har potentiale til at ændre hele populationer og dermed hele økosystemer. De kunne i teorien også have en negativ indvirkning på menneskers sundhed ved at få malariaparasitten til at udvikle sig til at blive mere virulent eller til at blive båret af en anden vært, siger molekylærbiolog og bioetiker Natalie Kofler. Hun er den stiftende direktør for gruppen Editing Nature ved Yale University i New Haven, Connecticut, som har til formål at behandle miljøgenetiske teknologier på verdensplan. “Denne teknologi har potentiale til at være enormt kraftfuld og til at ændre forløbet af ting, som vi måske ikke kan forudsige”, siger Kofler.
Hvem beslutter, hvornår der skal bruges et gendrev?
For lægemiddelforsøg kan en virksomhed begynde at forberede en feltforsøg blot et år eller to i forvejen. Gen-drev vil kræve mere tid, siger Okumu. Sidste år var han en del af en videnskabelig arbejdsgruppe bestående af 15 medlemmer, organiseret af Foundation for the National Institutes of Health, som fremlagde en række anbefalinger12 om anvendelse af gen-drevne myg i Afrika syd for Sahara.
Rapporten understreger, at regeringer, lokalsamfund og lokale forskere skal bruge tid til at absorbere videnskaben og få beføjelse til at regulere teknologien. “Jeg siger dette med fuld overbevisning – i sidste ende er det landene selv, der er de bedste til at træffe disse beslutninger”, siger Okumu.
I 2017 samlede Kofler en gruppe af forskere og etikere for at drøfte de samfundsmæssige spørgsmål i forbindelse med gen-drev13. “De vigtigste spørgsmål drejer sig om retfærdighed”, siger Kofler. I diskussioner om udsætning af en genmanipuleret organisme i et afrikansk miljø har grupper, der historisk set er blevet marginaliseret, ret til at være en del af beslutningsprocessen, siger hun.
Okumu ønsker, at afrikanske forskere skal udvikle og afprøve gen-drive-teknologi lokalt, hvilket vil kræve respekt og vilje fra bidragsydere til at støtte sådanne bestræbelser. “Folk frygter det ukendte, og det ukendte bliver lige nu præsenteret fra et vestligt perspektiv”, siger Okumu. “Jeg ser frem til den dag, hvor vi kan bygge disse konstruktioner i vores egne laboratorier og på den måde opbygge lokal tillid.”
I august 2018 gav det nationale biosikkerhedsagentur i Burkina Faso Target Malaria tilladelse til at frigive en stamme af en genetisk modificeret steril hanmyg, den første af sin art på det afrikanske kontinent. I sidste uge frigav holdet omkring 6.400 myg, der er blevet genetisk manipuleret, men som ikke indeholder gen-drev. Forskerne håber, at udsætningen vil forbedre opfattelsen af forskningen og give data til fremtidige udsætninger.
Og selv om gen-drive-musene langt fra er klar til udsætning, arbejder GBIRd allerede sammen med risikovurdere, etikere og økologer for at finde en ø til et første feltforsøg. “Vi vil være sikre på, at vi gør det rigtigt”, siger Saah. “Uanset hvor hurtigt teknologierne bevæger sig, kan vi fremme samfundsvidenskaberne og etikken nu.”
Leave a Reply