Hvorfor har #”HF “# et lavere kogepunkt end vand, selv om #”F “# er mere elektronegativ end #”O “#?
Der er mange komplicerede faktorer. Dette er, hvad jeg kunne finde:
- Vand kan danne et mere afbalanceret hydrogenbindingsnetværk (to acceptorer og to donorer i stedet for én donor og tre acceptorer), hvilket gør bulksystemet mere ensartet interagerende og dermed stærkere som helhed.
- Vand danner et mere omfattende hydrogenbindingsnetværk (et tredimensionalt tetraedrisk lokalt miljø i stedet for et todimensionalt zigzag-miljø), hvilket gør bulksystemet mindre let fordampeligt.
- Vand har generelt en mere optimal vekselvirkningsvinkel, da den passer bedre til molekylets elektrongeometri og retter vekselvirkningerne langs den molekylære dipol, hvorimod #”HF “# ville have stærkere hydrogenbindinger (i form af rå tal), hvis vekselvirkningerne var lineære.
DISCLAIMER: LANGT SVAR! Også meget visuelt.
Hydrogenbinding er den stærkeste intermolekylære kraft i både #”HF “# og #”H”_2 “O “#. Interaktionsstyrken er afhængig af interaktionsafstanden, interaktionsvinklen og netværkets strækningsgrad.
Når vi trækker alle hydrogenbindingsinteraktioner ud og antager rent vand og ren #”HF “#, får vi (ved at isolere et udvalgt sæt molekyler fra en uendelig matrix)#””^()##””^()#:
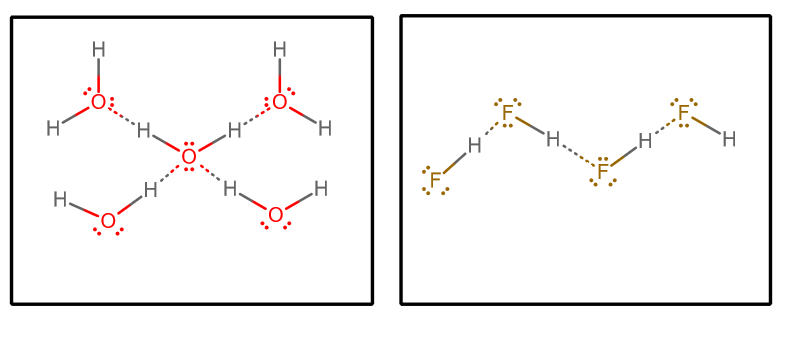
Vi kunne så overveje et par faktorer:
- Antal hydrogenbindingsdonorer og -acceptorer
Hvert vandmolekyle kan acceptere to hydrogenbindingsinteraktioner (via de ensomme par) og donere to hydrogenbindingsinteraktioner (via hydrogenserne).
På den anden side kan hvert #”HF “#-molekyle acceptere tre hydrogenbindingsinteraktioner (via de ensomme par) og kun afgive én (via hydrogenet).
Man kunne så argumentere for, at vand har et mere afbalanceret hydrogenbindingsnetværk, hvilket gør bulksystemet mindre i stand til at fordampe samlet set. Dette ville understøtte vands højere kogepunkt end #”HF “#.
- Elektronegativiteten af #bb(“F”)# og #bb(“O”)#
#”F “# er mere elektronegativ, så det holder lettere fast i sin elektrontæthed; derfor forventes de ensomme par at være svagere donorer af hydrogenbindingsinteraktioner end de ensomme par på #”O “#.
Dette synes at forudsige, at hver enkelt hydrogenbindingsinteraktion er svagere, hvilket ville understøtte vands højere kogepunkt end #”HF “#, MEN dette modsiges af følgende punkt.
- Gennemsnitlige rå hydrogenbindingsstyrker i #bb(“HF”)# vs. vand
#”O”-“H “cdotcdotcdot: “O”-#, #DeltaH_(“H”-“binding”) ~~ “21 kJ/mol “#
#”F”-“H “cdotcdotcdot: “F”-#, #DeltaH_(“H”-“binding”) ~~ “161.5 kJ/mol “#
Disse data fra Wikipedia tyder på, at #”HF “# har stærkere hydrogenbindingsinteraktioner blandt #”HF “#-molekyler end i vand.
Dette ville ikke understøtte det eksperimentelle bevis for, at #”HF “# har et meget lavere kogepunkt, men dette er også blot et rå tal og tager ikke højde for f.eks. vekselvirkningsvinkler i bulksystemet.
- Observerede hydrogenbindingsvinkler og vekselvirkningsdimensioner
#”HF “#, der er et lineært molekyle, er blevet set at have zigzag hydrogenbindingsvekslinger, i to dimensioner, med vinkler på #116^@#. En mere optimal vinkel ville være ved #180^@##, da det ville give mere direkte dipolinteraktioner. Dette begrænser hydrogenbindingsstyrken af #”HF “#.
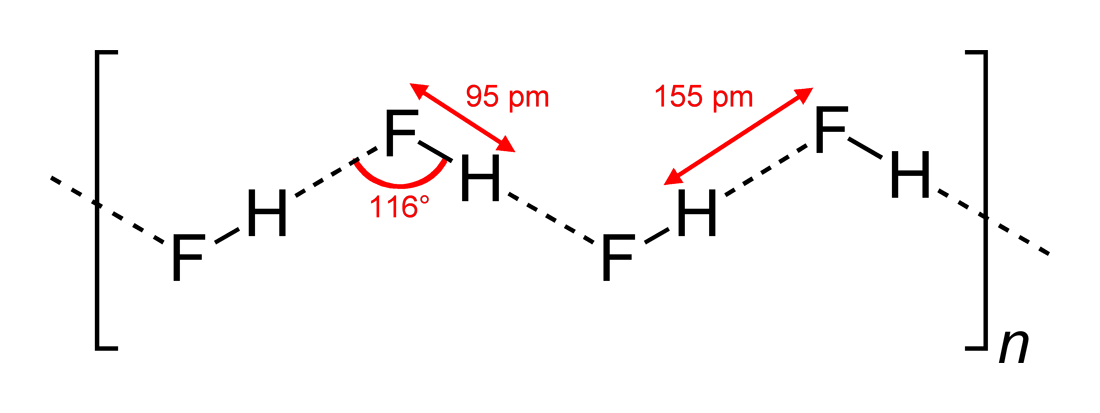
Vand, der er et bøjet molekyle med en tetraedrisk elektrongeometri, kan hydrogenbindes i tre dimensioner.
Her er et eksempel på den tetraedriske klynge, der findes i det lokale miljø i en brintbindingsvekselvirkning i vand:
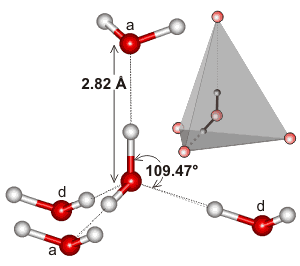
Det kan være, at det er udstrækningen af det brintbindende netværk, og hvordan det har tendens til at passe til vandets elektrongeometri, der gør vands kogepunkt så højt. Dette ville understøtte vands højere kogepunkt i forhold til #”HF “#.
Overordnet set er dette de mindst udfordrende faktorer, jeg kunne komme i tanke om:
- Vand kan lave et mere afbalanceret hydrogenbindingsnetværk (to acceptorer og to donorer, i stedet for en donor og tre acceptorer), hvilket gør bulksystemet mere ensartet interagerende og dermed stærkere som en helhed.
- Vand danner et mere omfattende hydrogenbindingsnetværk (et tredimensionalt tetraedrisk lokalt miljø i stedet for et todimensionalt zigzag-miljø), hvilket gør bulksystemet mindre let fordampeligt.
- Vand har generelt en mere optimal vekselvirkningsvinkel, da den passer bedre til molekylets elektrongeometri og retter vekselvirkningerne langs den molekylære dipol, hvorimod #”HF “# ville have stærkere hydrogenbindinger (i form af rå tal), hvis vekselvirkningerne var lineære.
Leave a Reply