Hvad er elektronegativitet?
ELECTRONEGATIVITET
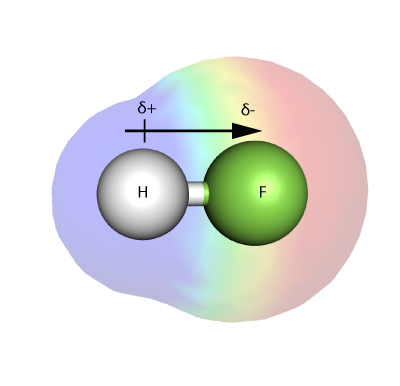
Elektronegativitet er et mål for, hvor stærkt et atom – i et molekyle – er i stand til at tiltrække elektroner i en binding til sig selv.
Faktorer, der påvirker elektronegativiteten:
1) Atomnummeret
Atomnummeret er antallet af protoner i atomets kerne.
Det bestemmer et grundstofs kemiske egenskaber og dets placering i det periodiske system.
Desto højere atomnummer, desto stærkere elektronegativitet.
2) Atomradius
Atomradius for et kemisk grundstof måles normalt ved afstanden fra atomkernens centrum til grænsen for det yderste lag af elektroner.
Desto større atomradius, desto svagere elektronegativitet.
Eksempel på atomradius for et oxygenatom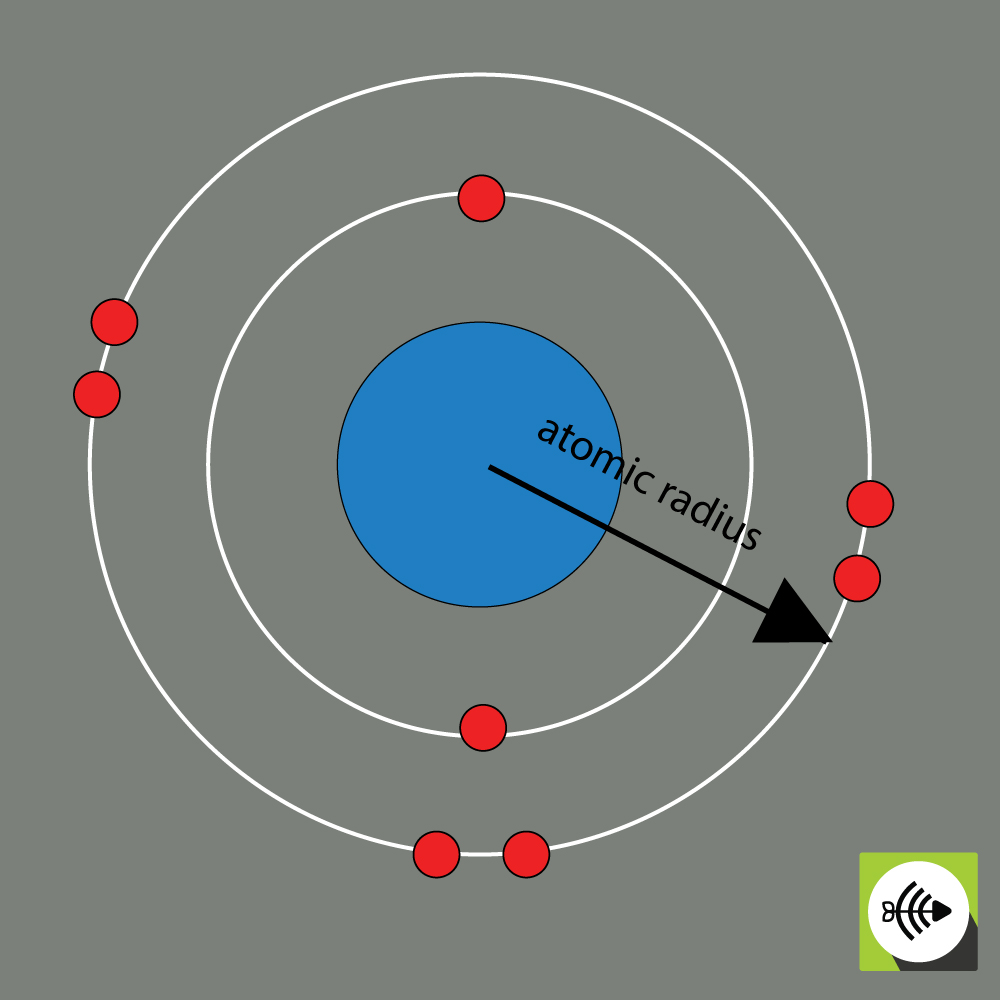
Hvad måles elektronegativitet i?
Den mest almindelige måling af elektronegativitet er Pauling-skalaen, der er designet af den dobbelte nobelprisvinder Linus Pauling. Elektronegativitetsskalaen for grundstoffer fortæller, hvor stærkt hvert grundstof (i forhold til hinanden) kan tiltrække de bindingselektroner til sig selv. Jo højere elektronegativitetstallet er, jo mere vil atomet forsøge at trække elektroner til sig.
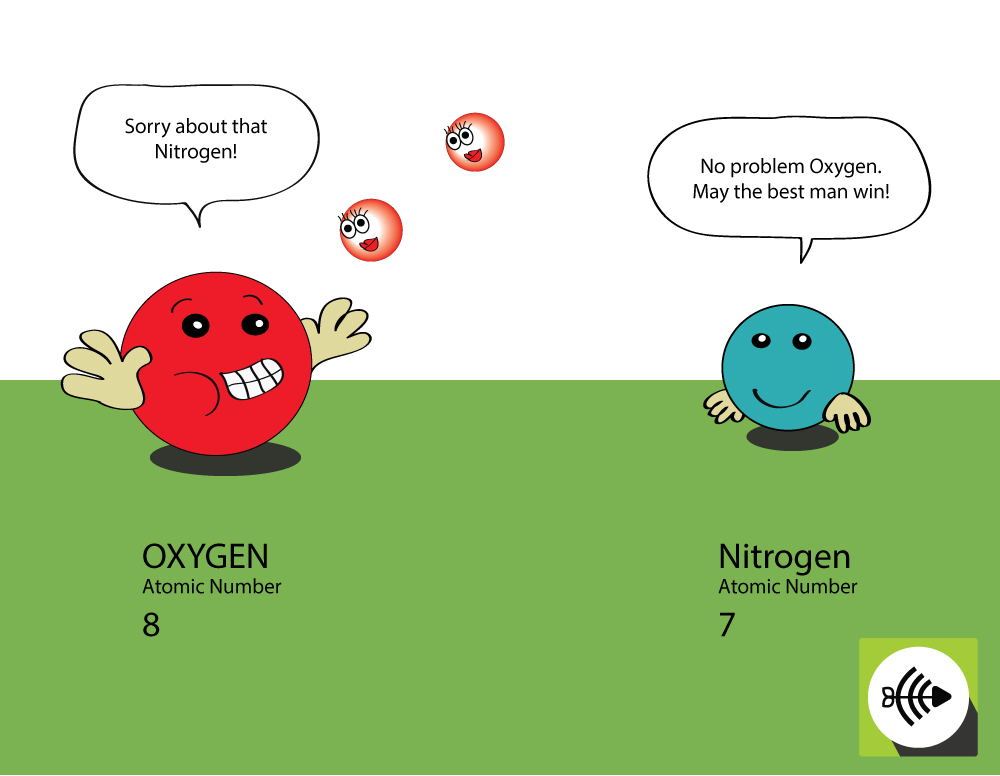
Hvorfor er oxygen mere elektronegativ end nitrogen?
Oxygen er højere i atomnummer
- Oxygen har 8 protoner i kernen, mens nitrogen kun har 7.
- Et bindingspar af elektroner vil opleve større tiltrækning fra iltens kerne end fra kvælstofs, og derfor er iltens elektronegativitet større.
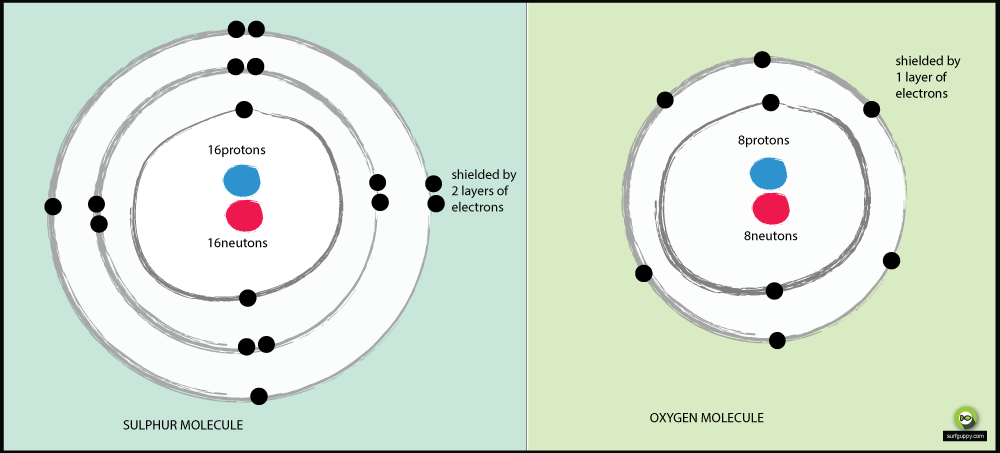
Hvorfor er svovl mindre elektronegativt end ilt?
Rejsager til, hvorfor ilt er mere elektronegativ end svovl:
- Oxygen har 2 energiniveauer, svovl har 3
- De bindingselektroner i svovl er længere væk fra atomets kerne
- Når bindingselektroner er længere væk fra atomets kerne, er der mindre tiltrækning fra atomkernen
- Bindingsparret af elektroner i oxygen vil opleve mere tiltrækning fra dets kerne end svovlens bindingselektroner
- Dermed er oxygen et mere elektronegativt atom
Læs venligst om valenselektroner, før du fortsætter. Valenselektroner

Det mindre atom har en højere elektronegativitet
Elektronegativitetstendenser findes i det periodiske system
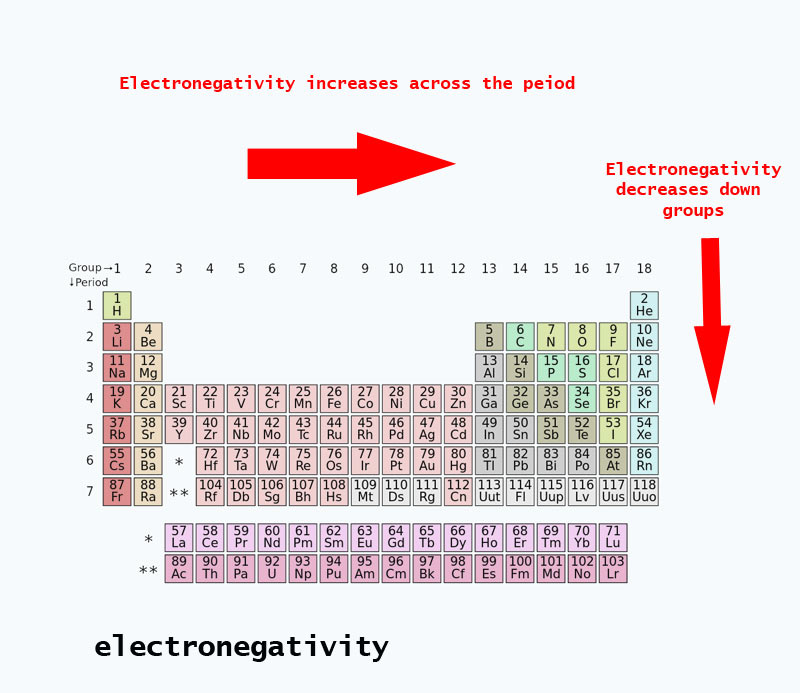
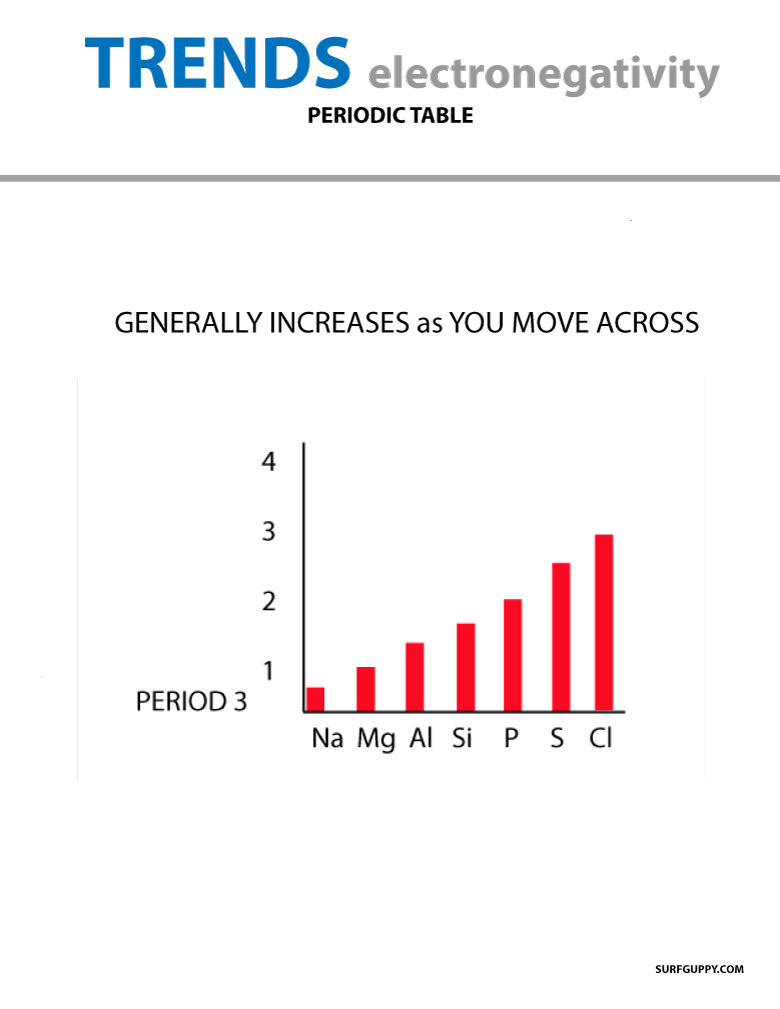
Når man bevæger sig på tværs af det periodiske system, stiger antallet af protoner i kernen (uden at energiniveauet stiger), og derfor stiger elektronegativiteten.
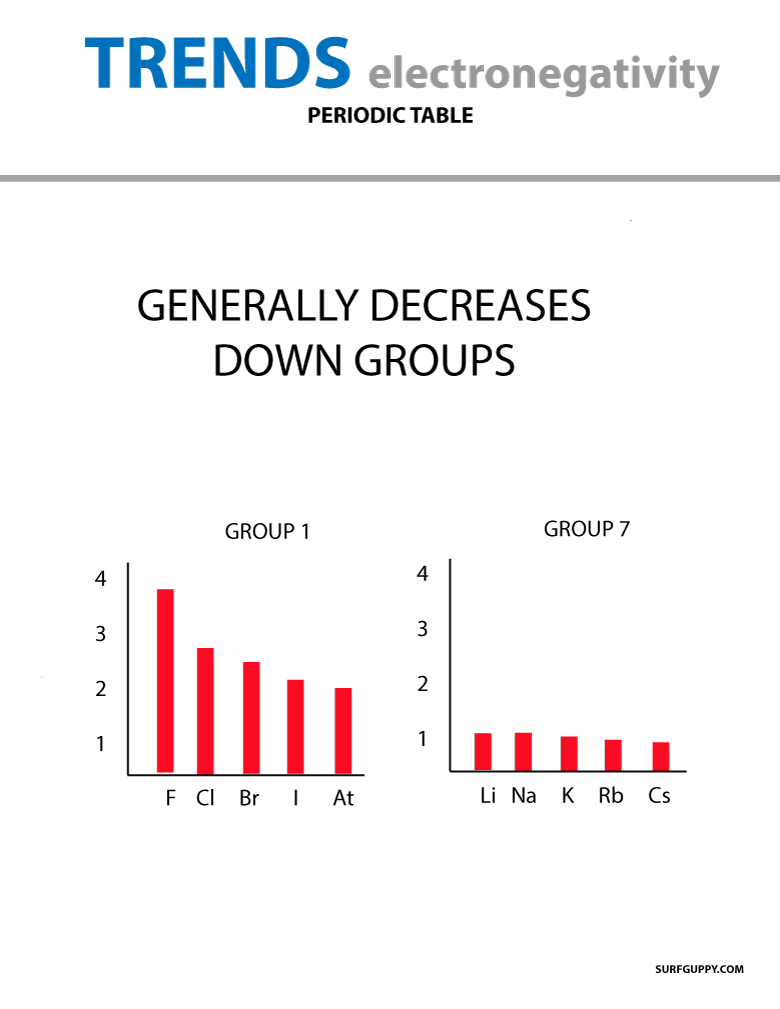
Når atomtallet stiger nedad i en gruppe, sker der også en stigning i energiniveauer. Atomradius er større, og derfor falder elektronegativiteten.
PERIODISK TABEL FOR ELECTRONEGATIVITET
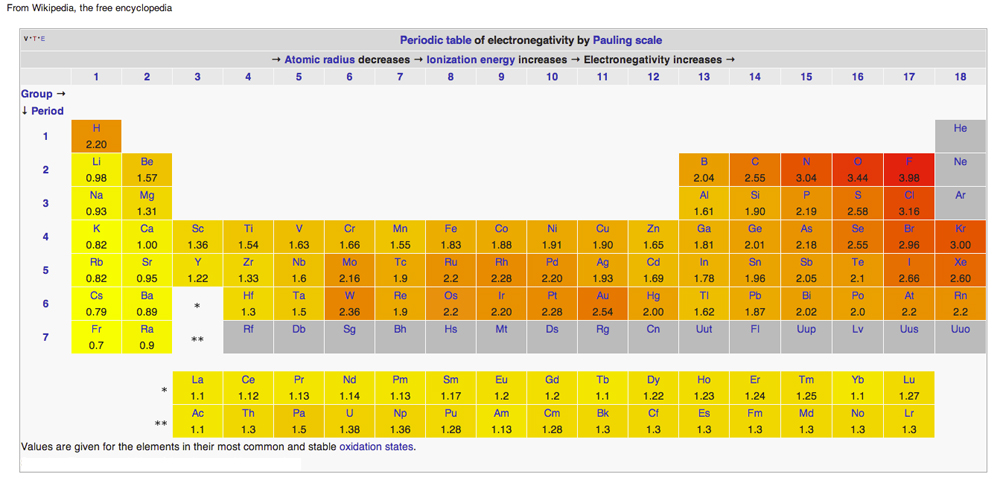 Diagram fra Wikipedia udgivet under Creative Common Licenses
Diagram fra Wikipedia udgivet under Creative Common Licenses
Leave a Reply