Flunixin Meglumine injektion
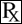 Producent: Vet Tek
Producent: Vet Tek
(flunixin Meglumine)
steril injicerbar opløsning 50 Mg/ml
anada# 200-387, godkendt af Fda
veterinær
til intravenøs eller intramuskulær brug hos heste og til intravenøs brug hos okse- og malkekvæg. Ikke til brug hos tørre malkekøer og kalve.
Flunixin meglumin injektionsvæske Forsigtig
Den føderale lovgivning begrænser dette lægemiddel til brug af eller på anvisning af en autoriseret dyrlæge.
Beskrivelse
På hver milliliter flunixin injicerbar opløsning er der flunixin meglumin svarende til 50 mg flunixin, 0.1 mg edetat-dinatrium, 2,5 mg natriumformaldehydsulfoxylat, 4,0 mg diethanolamin, 207,2 mg propylenglycol, 5,0 mg phenol som konserveringsmiddel, saltsyre, vand til injektionsvæske q.s.
Farmakologi
Funixin meglumin er et potent ikke-narkotisk, ikke-steroidalt, analgetisk middel med antiinflammatorisk og antipyretisk aktivitet. Det er signifikant mere potent end pentazocin, meperidin og kodein som analgetikum i gæretatentesten på rottepoter.
Hest
Flunixin er fire gange så potent på mg-per-mg-basis som phenylbutazon målt ved reduktion af halthed og hævelse hos hesten. Plasmahalveringstiden i hesteserum er 1,6 timer efter en enkelt dosis på 1,1 mg/kg. Målbare mængder kan påvises i hesteplasma 8 timer efter injektion.
Kvæg
Flunixin meglumin er en svag syre (pKa=5,82)1 , som udviser en høj grad af plasmaproteinbinding (ca. 99 %).2 Det frie (ubundne) lægemiddel synes imidlertid let at fordele sig i kropsvæv (Vss-prædiktioner varierer fra 297 til 782 mL/kg.2-5 Det samlede kropsvand er omtrent lig med 570 mL/kg).6 Hos kvæg sker eliminationen primært gennem galdeudskillelse.7 Dette kan, i det mindste delvist, forklare tilstedeværelsen af flere toppe i blodkoncentrationen/tidsprofilen efter IV-administration.2
I sundt kvæg er den samlede kropsclearance blevet rapporteret til at svinge fra 90 til 151 mL/kg/time.2-5 Disse undersøgelser rapporterer også om en stor diskrepans mellem fordelingsvolumen ved steady state (Vss) og fordelingsvolumen forbundet med den terminale eliminationsfase (Vβ). Denne diskrepans synes at kunne tilskrives forlænget lægemiddelelimination fra et dybt kompartment.8 Den terminale halveringstid har vist sig at variere fra 3,14 til 8,12 timer.2-5
Flunixin persisterer i inflammatoriske væv9 og er forbundet med antiinflammatoriske egenskaber, som strækker sig langt ud over den periode, der er forbundet med påviselige plasmakoncentrationer af lægemiddelstoffer.4,9 Disse observationer forklarer den mod uret hysterese, der er forbundet med flunixins farmakokinetiske/farmakodynamiske forhold.10
Derfor vil en forudsigelse af lægemiddelkoncentrationer baseret på den estimerede plasmaterminale eliminationshalveringstid sandsynligvis undervurdere både varigheden af lægemiddelvirkningen og den koncentration af lægemiddel, der forbliver på aktivitetsstedet.
Flunixin Meglumin Injection Indikationer
Flunixin injicerbar opløsning anbefales til lindring af inflammation og smerte i forbindelse med muskuloskeletale lidelser hos hesten. Det anbefales også til lindring af viscerale smerter i forbindelse med kolik hos hesten.
Kvæg
Flunixin injicerbar opløsning er indiceret til kontrol af pyrexi i forbindelse med respiratorisk sygdom hos kvæg, endotoxæmi og akut bovin mastitis. Flunixin injicerbar opløsning er også indiceret til kontrol af inflammation ved endotoksæmi.
Dosis og administration
Den anbefalede dosis til muskel- og skeletsygdomme er 0,5 mg pr. pund (1 mL/100 lbs) kropsvægt en gang dagligt. Behandlingen kan gives ved intravenøs eller intramuskulær injektion og gentages i op til 5 dage. Undersøgelser viser, at aktivitetsdebut er inden for 2 timer. Peak respons opstår mellem 12 og 16 timer og varighed af aktivitet er 24-36 timer.
Den anbefalede dosis til lindring af smerter i forbindelse med kolik hos heste er 0,5 mg pr. pund kropsvægt. Intravenøs administration anbefales for hurtig lindring. Kliniske undersøgelser viser, at smerten lindres på mindre end 15 minutter i mange tilfælde. Behandlingen kan gentages, når tegn på kolik gentager sig. Under kliniske undersøgelser krævede ca. 10 % af hestene en eller to yderligere behandlinger. Årsagen til kolik bør bestemmes og behandles med sideløbende behandling.
Kvæg
Den anbefalede dosis til kontrol af pyrexi i forbindelse med respiratorisk sygdom hos kvæg og endotoxæmi hos kvæg og kontrol af inflammation ved endotoxæmi er 1.1 til 2,2 mg/kg (0,5 til 1,0 mg/lb; 1 til 2 ml pr. 100 lbs) af kropsvægt givet ved langsom intravenøs administration enten én gang om dagen som en enkelt dosis eller opdelt i to doser, der gives med 12 timers mellemrum i op til 3 dage. Den samlede daglige dosis bør ikke overstige 2,2 mg/kg (1,0 mg/lb) af kropsvægt. Undgå hurtig intravenøs administration af lægemidlet.
Den anbefalede dosis ved akut bovin mastitis er 2,2 mg/kg (1 mg/lb: 2 mL pr. 100 lbs) kropsvægt givet én gang ved intravenøs administration.
Kontraindikationer
Der er ingen kendte kontraindikationer for dette lægemiddel, når det anvendes som anvist. Intraarteriel injektion bør undgås. Heste, der utilsigtet injiceres intra-arterielt, kan vise bivirkninger. Tegn kan være ataksi, inkoordination, hyperventilation, hysteri og muskelsvaghed. Tegn er forbigående og forsvinder uden antidoterende medicinering inden for få minutter. Må ikke anvendes til heste, der viser overfølsomhed over for flunixin meglumin.
Kvæg
Der er ingen kendte kontraindikationer for dette lægemiddel til kvæg, når det anvendes som anvist. Må ikke anvendes til dyr, der viser overfølsomhed over for flunixin meglumin. Anvendes med omtanke ved mistanke om nedsat nyrefunktion eller mavesår.
 |
ResidualadvarslerKvæg må ikke slagtes til konsum inden for 4 dage efter den sidste behandling. Mælk, der er blevet indtaget under behandlingen og i 36 timer efter den sidste behandling, må ikke anvendes til fødevarer. Må ikke anvendes til tørre malkekøer. Der er ikke fastsat en ventetid for dette produkt til preruminerende kalve. Må ikke anvendes til kalve, der skal forarbejdes til kalvekød. Må ikke anvendes til heste bestemt til foderbrug. |
 |
Forholdsregler
Som klasse kan cyclo-oxygenasehæmmende NSAID’er være forbundet med gastrointestinal og renal toksicitet. Følsomheden over for lægemiddelassocierede bivirkninger varierer med den enkelte patient. Patienter med størst risiko for nyretoksicitet er patienter, der er dehydrerede, i samtidig diuretikabehandling eller patienter med nyre-, kardiovaskulær og/eller hepatisk dysfunktion.
Da mange NSAID’er har potentiale til at fremkalde gastrointestinale ulcerationer, bør samtidig brug af Flunixin injicerbar opløsning med andre antiinflammatoriske lægemidler, såsom andre NSAID’er og kortikosteroider, undgås eller overvåges nøje.
Heste
Effekten af Flunixin injicerbar opløsning på graviditet er ikke blevet bestemt. Der er ikke foretaget undersøgelser til bestemmelse af aktiviteten af Flunixin injicerbar opløsning ved samtidig indgift med andre lægemidler. Lægemiddelkompatibilitet bør overvåges nøje hos patienter, der kræver supplerende behandling.
Kvæg
Må ikke anvendes til tyre beregnet til avl, da reproduktive virkninger af Flunixin injicerbar opløsning i disse klasser af kvæg ikke er blevet undersøgt. NSAID’er er kendt for at have potentielle virkninger på både fødsel og østruscyklus. Der kan forekomme en forsinkelse i starten af østrus, hvis Flunixin administreres i prostaglandinfasen af østruscyklus. Virkningerne af flunixin på forestående fødsel er ikke blevet evalueret i en kontrolleret undersøgelse. NSAID’er er kendt for at have potentiale til at forsinke fødsel gennem en tocolytisk virkning. Den anbefalede dosis må ikke overskrides.
Sikkerhed
En 3-dobbelt intramuskulær dosis på 1,5 mg/lb kropsvægt dagligt i 10 på hinanden følgende dage var sikker. Der blev ikke observeret nogen ændringer i hæmatologiske, serumkemiske eller urinanalytiske værdier. Intravenøse doser på 0,5 mg/lb dagligt i 15 dage; 1,5 mg/lb dagligt i 10 dage; og 2,5 mg/lb dagligt i 5 dage gav ingen ændringer i blod- eller urinparametre. Der blev ikke observeret nogen irritation af injektionsstedet efter intramuskulær injektion af den anbefalede dosis på 0,5 mg/lb. Der blev observeret en vis irritation efter en 3-dobbelt dosis administreret intramuskulært.
Kvæg
Der blev ikke observeret nogen flunixin-relaterede ændringer (bivirkninger) hos kvæg, der fik en 1X (2,2 mg/kg; 1,0 mg/lb) dosis i 9 dage (tre gange den maksimale kliniske varighed). Minimal toksicitet manifesterede sig ved moderat forhøjede doser (3X og 5X), når flunixin blev administreret dagligt i 9 dage, med lejlighedsvise fund af blod i fæces og/eller urin. Afbryd brugen, hvis der observeres hæmaturi eller blod i afføringen.
Bivirkninger
På heste er der modtaget isolerede rapporter om lokale reaktioner efter intramuskulær injektion, især i nakken. Disse omfatter lokaliseret hævelse, svedtendens, induration og stivhed. I sjældne tilfælde hos heste er der rapporteret om dødelige eller ikke-dødelige clostridieinfektioner eller andre infektioner i forbindelse med intramuskulær brug af flunixin meglumin. Hos heste og kvæg er der rapporteret sjældne tilfælde af anafylaktiske lignende reaktioner, hvoraf nogle har været dødelige, primært efter intravenøs brug.
Sådan leveres
Flunixin injicerbar opløsning, 50mg/mL, fås i 100mL og 250mL flerdosisflasker.
Opbevares mellem 2° Og 30°c (36° Og 86°f).
1. Johansson M, Anler EL. Gaskromatografisk analyse af flunixin i hesteurin efter ekstraktiv methylering. J Chromatogr. 1988; 427:55-66.
2. Odensvik K, Johansson M. Højtydende væskekromatografisk metode til bestemmelse af flunixin i kvægplasma og farmakokinetik efter enkelt- og gentagne doser af lægemidlet. Am J Vet Res. 1995;56:489-495.
3. Anderson KL, Neff-Davis CA, Davis LE, Davis LE, Bass VD. Farmakokinetik af flunixin meglumin hos lakterende kvæg efter enkelt og flere intramuskulære og intravenøse administrationer. Am J Vet Res. 1990;51:1464-1467.
4. Odensvik K. Farmakokinetik af flunixin og dets virkning på prostaglandin F2α-metabolitkoncentrationer efter oral og intravenøs indgift hos kvier. J Vet Pharmacol Ther. 1995;18:254-259.
5. Hardee GE, Smith JA, Smith JA, Harris SJ. Farmakokinetik af flunixin meglumin hos koen. Res Vet Sci. 1985;39;39: 110-112.
6. Ruckebusch Y, Phaneuf LP, Dunlop R. Physiology of Small and Large Animals. Kapitel 2: “Body Fluid Compartments”, Philadelphia, Pa: B.C. Decker; 1991:8-18.
7. Kopcha M, Ahl AS. Eksperimentel anvendelse af flunixin meglumin og phenylbutazon hos fødevareproducerende dyr. J Am Vet Med Assoc. 1989;194:45-49.
8. Wagner JG. Betydningen af forholdet mellem forskellige fordelingsvolumener i farmakokinetik. Biopharm & Drug Dispos. 1983;4:263-270.
9. Lees P, Higgins AJ. Flunixin hæmmer prostaglandin E2-produktion ved inflammation hos heste. Res Vet Sci. 1984;37;37:347-349.
10. Landoni MF, Cunningham FM, Lees P. Bestemmelse af farmakokinetik og farmakodynamik af flunixin hos kalve ved hjælp af farmakokinetisk/farmakodynamisk modellering. Am J Vet Res. 1995;56:786-794.
Produceret af: Bimeda-MTC Animal Health Inc, Cambridge, ON Canada
Fremstillet til VET TEK™, Blue Springs, MO 64014
|
Nettoindhold: |
NDC |
|||
|
100 mL Multiple Dose Vial 50 mg/mL |
8FLUXXX |
ISS.07.09 |
||
|
250 mL hætteglas med flere doser 50 mg/mL |
8FLUXXX |
ISS.07.09 |
Leave a Reply