8.3: Gasser og tryk
Læringsmål
- At beskrive gasfasen.
Gasfasen er unik blandt de tre stoftilstande, fordi der findes nogle enkle modeller, som vi kan bruge til at forudsige den fysiske adfærd for alle gasser – uafhængigt af deres identitet. Det kan vi ikke gøre for de faste og flydende tilstande. Faktisk udgør udviklingen af denne forståelse af gassernes adfærd det historiske skillepunkt mellem alkymien og den moderne kemi. De første fremskridt i forståelsen af gasers adfærd blev gjort i midten af 1600-tallet af Robert Boyle, en engelsk videnskabsmand, der grundlagde Royal Society (en af verdens ældste videnskabelige organisationer).
Hvordan kan vi modellere alle gasser uafhængigt af deres kemiske identitet? Svaret findes i en gruppe udsagn, der kaldes den kinetiske teori om gasser:
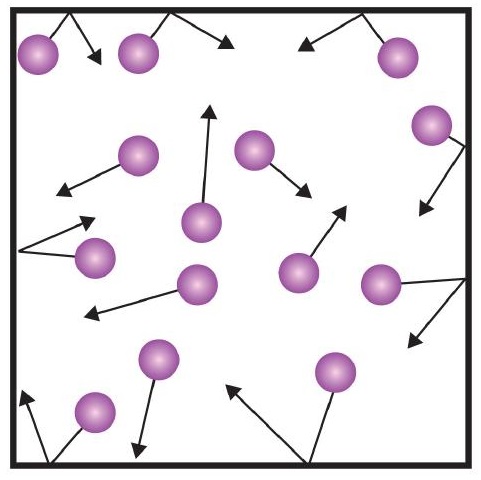
- Gasser består af små partikler, der er adskilt af store afstande.
- Gaspartikler er konstant i bevægelse og oplever kollisioner med andre gaspartikler og væggene i deres beholder.
- Gaspartiklernes hastighed hænger sammen med gassens temperatur.
- Gaspartikler oplever ikke nogen tiltræknings- eller frastødningskraft i forhold til hinanden.
Lagde du mærke til, at ingen af disse udsagn vedrører gassens identitet? Det betyder, at alle gasser burde opføre sig på samme måde. En gas, der følger disse udsagn perfekt, kaldes en idealgas. De fleste gasser viser små afvigelser fra disse udsagn og kaldes reelle gasser. Eksistensen af virkelige gasser mindsker dog ikke betydningen af den kinetiske teori om gasser.
Et af udsagnene i den kinetiske teori nævner kollisioner. Da gaspartikler er i konstant bevægelse, støder de også konstant sammen med hinanden og med væggene i deres beholder. Der er kræfter involveret, når gaspartiklerne preller af på beholderens vægge (figur \(\PageIndex{1}\)). Den kraft, som gaspartiklerne frembringer, divideret med arealet af beholderens vægge, giver trykket. Tryk er en egenskab, som vi kan måle for en gas, men vi tager typisk ikke hensyn til tryk for faste stoffer eller væsker.
Den grundlæggende enhed for tryk er newton pr. kvadratmeter (N/m2). Denne kombinerede enhed er omdefineret til en pascal (Pa). En pascal er ikke en særlig stor mængde tryk. En mere brugbar enhed for tryk er bar, som er 100.000 Pa (1 bar = 100.000 Pa). Andre almindelige trykenheder er atmosfæren (atm), som oprindeligt blev defineret som det gennemsnitlige tryk i Jordens atmosfære på havniveau, og mmHg (millimeter kviksølv), som er det tryk, der genereres af en 1 mm høj kviksølvsøjle. Enheden millimeter kviksølv kaldes også torr, opkaldt efter den italienske videnskabsmand Evangelista Torricelli, som opfandt barometeret i midten af 1600-tallet. En mere præcis definition af atmosfære, udtrykt i torr, er, at der er præcis 760 torr i 1 atm. En bar er lig med 1,01325 atm. I betragtning af alle sammenhængene mellem disse trykenheder er evnen til at konvertere fra en trykenhed til en anden en nyttig færdighed.
Eksempel \(\PageIndex{1}\): Omregning af tryk
Skriv en omregningsfaktor for at bestemme, hvor mange atmosfærer der er i 1.547 mmHg.
Løsning
Da 1 mmHg er lig med 1 torr, er det givne tryk også lig med 1.547 torr. Da der er 760 torr i 1 atm, kan vi bruge denne omregningsfaktor til at foretage den matematiske omregning:
\(\mathrm{1,547\: torr\times \dfrac{1\: atm}{760\: torr}=2.04\: atm}\)
Opmærksomheden henledes på, at torr-enhederne algebraisk set ophæves.
Øvelse \(\(\PageIndex{1}\): Omregning af tryk
Skriv en omregningsfaktor for at bestemme, hvor mange millimeter kviksølv der er i 9,65 atm.
Svar
\(\mathrm{9,65\: atm\times \dfrac{760\: mm Hg}{1\: atm}=7,334 \: mm Hg}\).
Den kinetiske teori siger også, at der ikke er nogen vekselvirkning mellem de enkelte gaspartikler. Selv om vi ved, at der rent faktisk er intermolekylære vekselvirkninger i virkelige gasser, antager den kinetiske teori, at gaspartiklerne er så langt fra hinanden, at de enkelte partikler ikke “mærker” hinanden. Derfor kan vi behandle gaspartikler som små stofstykker, hvis identitet ikke er vigtig for visse fysiske egenskaber.
Konceptgennemgang Øvelse
-
Hvad er tryk, og hvilke enheder bruger vi til at udtrykke det?
Svar
-
Tryk er kraften pr. arealenhed; dets enheder kan være pascal, torr, millimeter kviksølv eller atmosfærer.
Key Takeaway
- Gasfasen har visse generelle egenskaber, der er karakteristiske for denne fase.
Opgaver
-
Hvad er den kinetiske teori om gasser?
-
I henhold til den kinetiske teori om gasser er de enkelte gaspartikler (altid, ofte, aldrig) i bevægelse.
-
Hvorfor udøver en gas et tryk?
-
Hvorfor kan man ifølge den kinetiske teori om gasser antage, at alle gasser vil udvise samme adfærd?
-
Ranger følgende trykmængder i rækkefølge fra den mindste til den største:
-
Hvilken enhed for tryk er størst – torr eller atmosfære?
-
Hvor mange torr er der i 1.56 atm?
-
Omregn 760 torr til pascal.
-
Blodtrykket udtrykkes i millimeter kviksølv. Hvad vil blodtrykket være i atmosfærer, hvis en patients systoliske blodtryk er 120 mmHg, og det diastoliske blodtryk er 82 mmHg? (Inden for lægevidenskaben ville et sådant blodtryk blive rapporteret som “120/82”, hvilket tales som “et hundrede tyve over toogfirs”.)
-
I vejrudsigter udtrykkes det barometriske tryk i tommer kviksølv (in. Hg), hvor der er præcis 25,4 mmHg i hver 1 in. Hg. Hvad er det barometriske tryk i millimeter kviksølv, hvis det barometriske tryk angives til 30,21 in. Hg?
Svar
-
Gasser består af små partikler, der er adskilt af store afstande. Gaspartikler er konstant i bevægelse og oplever sammenstød med andre gaspartikler og væggene i deres beholder. Gaspartiklernes hastighed hænger sammen med gassens temperatur. Gaspartikler oplever ikke nogen tiltræknings- eller frastødningskraft i forhold til hinanden.
-
En gas udøver et tryk, når dens partikler preller af på væggene i dens beholder.
-
1 Pa, 1 mmHg og 1 atm
-
1,190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
Leave a Reply