Sebedestruktivní komáři a sterilizovaní hlodavci: příslib genových pohonů
Austin Burt a Andrea Crisanti se osm let snažili unést genom komára. Chtěli obejít přirozený výběr a zapojit gen, který by v populaci rostl jako houba rychleji než mutace předávaná obvyklým procesem dědičnosti. V pozadí jejich myšlenek byl způsob, jak zabránit malárii rozšířením genu, který by vyřadil populaci komárů, aby nemohli nemoc přenášet.
Crisanti si vzpomíná, že se mu to znovu a znovu nedařilo. Nakonec však v roce 2011 oba genetici z Imperial College London dostali zpět výsledky DNA, v něž doufali: gen, který vložili do genomu komárů, se šířil populací a zasáhl více než 85 % potomků hmyzu1.
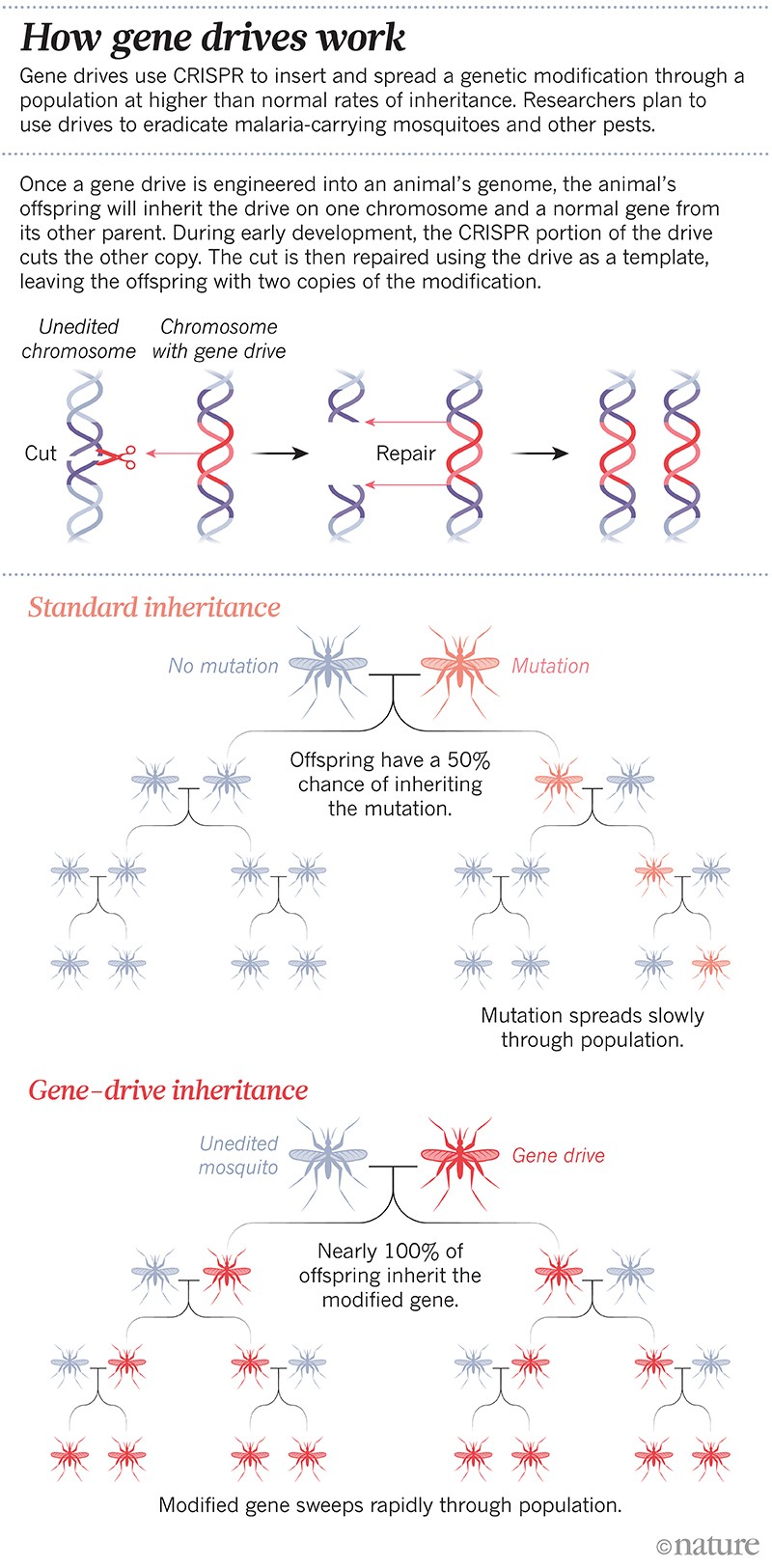
Jednalo se o první uměle vytvořený „gene drive“: genetickou modifikaci navrženou tak, aby se šířila populací s vyšší než normální mírou dědičnosti. Genové pohony se v některých laboratořích rychle staly rutinní technologií; vědci nyní mohou vytvořit pohon během několika měsíců. Tato technika se opírá o nástroj pro úpravu genů CRISPR a některé kousky RNA, které mění nebo umlčují určitý gen nebo vkládají nový gen. V další generaci se celá jednotka zkopíruje na partnerský chromozom, takže v genomu už není přirozená verze vybraného genu, ale dvě kopie jednotky. Tímto způsobem se změna přenese až na 100 % potomků namísto přibližně 50 % (viz „Jak genové pohony fungují“).
Od roku 2014 vědci zkonstruovali systémy genových pohonů na bázi CRISPR u komárů, ovocných mušek a hub a v současné době je vyvíjejí u myší. To je však teprve začátek příběhu. Otázky, zda je genový pohon možný, nahradily další neznámé: jak dobře budou fungovat, jak je testovat a kdo by měl tuto technologii regulovat. Genové pohony byly navrženy jako způsob, jak omezit nebo eliminovat choroby přenášené hmyzem, kontrolovat invazivní druhy a dokonce zvrátit rezistenci škůdců vůči insekticidům. Žádný upravený genový pohon zatím nebyl vypuštěn do volné přírody, ale tato technologie by v zásadě mohla být připravena již za tři roky, říká Crisanti. Spolupracuje s neziskovým mezinárodním výzkumným konsorciem Target Malaria, které se snaží využít komáry s genovým pohonem ke kontrole malárie v Africe. Skupina 1. července vypustila zkušební várku komárů – geneticky upravených, ale zatím nevybavených genovým pohonem – ve vesnici v Burkině Faso.
Genový pohon se nepodobá žádné ekologické nápravě, která byla kdy testována, říká Fredros Okumu, vědecký ředitel Ifakara Health Institute v Dar es Salaamu v Tanzánii. „Genové pohony se budou šířit samy od sebe,“ říká. „Musíme lidi připravit a otevřeně sdílet informace se všemi zeměmi, kterých se to týká.“
Technické výzvy nejsou tak skličující jako ty společenské a diplomatické, říká bioinženýr Kevin Esvelt z mediální laboratoře Massachusettského technologického institutu (MIT) v Cambridge, který jako jeden z prvních sestrojil genový pohon na bázi CRISPR. „Technologie, jako je tato, mají reálné důsledky pro životy lidí, které mohou být téměř okamžité.“
Vzhledem k možným obavám z genových pohonů zkoumá Nature pět klíčových otázek týkajících se této technologie a jejího využití.
Budou genové pohony vůbec fungovat?
Vytvořit genový pohon za účelem manipulace s populací nebo jejího vyhubení je jako pustit se do boje s přírodním výběrem a tento boj nemusí být snadné vyhrát.
Jakmile vědci začali v laboratořích pravidelně vytvářet genové pohony, zvířata si proti nim vytvořila rezistenci – nahromadila mutace, které zabránily jejich šíření. Například při testech dvou drivů vložených do ovocných mušek se často vytvářely genetické varianty propůjčující rezistenci2. Nejčastěji mutace mění sekvenci, kterou je CRISPR nastaven rozpoznávat, a brání tak úpravě genu. Při pokusech s komáry v klecích Crisanti a Tony Nolan, výzkumný pracovník programu Target Malaria, sledovali, jak se frekvence genového disku v průběhu několika generací postupně snižuje v důsledku rezistentních mutací v cílovém genu3. Výsledky otřásly celým oborem. Způsobila by rezistence impotenci genových pohonů?
Ne nutně – pokud výzkumníci zvolí správný cíl. Některé geny jsou vysoce konzervované, což znamená, že jakákoli změna pravděpodobně zabije jejich majitele. Vybrat tyto geny jako cíl pohonu znamená méně mutací a méně rezistence. V září 2018 Crisanti a jeho tým rozbili populaci komárů Anopheles gambiae v klecích se 100% účinností4 tím, že vytvořili pohon, který narušil gen plodnosti zvaný doublesex. Po zavedení pohonu nemohou samičky komárů kousat a nekladou vajíčka; během 8-12 generací populace v klecích neprodukovala vůbec žádná vajíčka. A protože je tento gen klíčový pro rozmnožování, je doublesex odolný vůči mutacím, včetně těch, které by mu propůjčily rezistenci vůči konstrukci pohonu.
Tým provedl devět klecových experimentů s více než milionem vložených pohonů zaměřených na doublesex a nezaznamenal žádnou rezistenci, říká Crisanti. Nyní tým upravuje drive tak, aby vyřízl ne jeden, ale dva lokusy genu doublesex, podobně jako se léčí nemoc kombinací léků. „Chci se ujistit, že pravděpodobnost vzniku rezistence je velmi, velmi malá, než řeknu, že technologie je připravena pro použití v terénu,“ říká Crisanti.
U savců musí vědci řešit mnohem zásadnější problémy než rezistenci. V loňském roce Kim Cooperová a její kolegové z Kalifornské univerzity v San Diegu (UCSD) zkonstruovali počátky genového pohonu u savců – pohonu, který přeruší myší gen Tyr a změní srst zvířat na bílou5. Tento pohon byl pouze 72 % účinný při kopírování do genomu a nefungoval dobře v samčí zárodečné linii, říká Cooperová. Má podezření, že je to proto, že buněčné dělení probíhá v různých časech při tvorbě vajíček a spermií, což zřejmě ovlivňuje schopnost pohonu úspěšně kopírovat z jednoho chromozomu do druhého.
V tomto experimentu se pohon sám nerozmnožoval a Cooperová nesledovala tento znak ve více generacích, takže zdůrazňuje, že technicky vzato jej nelze považovat za genový pohon. „Ještě je třeba udělat spoustu práce, abychom ukázali, že je něco takového vůbec proveditelné,“ dodává.“
K čemu dalšímu jsou genové pohony dobré?
Ačkoli v této oblasti převažují aplikace pro komáry, navrhované využití genových pohonů zahrnuje také ochranu citlivých ekosystémů a urychlení laboratorní práce.
Některé organismy mají genomy, s nimiž je náročné manipulovat, ale jejich studium by vědcům mohlo pomoci. Vezměme si například Candida albicans, lidský plísňový patogen, který je často rezistentní vůči lékům. Rebecca Shapiro jako postdoktorandka na Broad Institute a MIT v Cambridge ve státě Massachusetts vyvinula systém6 , který umožňuje vnášet mutace do této houby s téměř 100% účinností. Nyní může houbu vyšlechtit tak, aby umlčela dva nezávislé geny a tyto mutace předala potomkům. „Funguje to šíleně efektivně,“ říká Shapirová, která nyní působí na Guelphské univerzitě v Kanadě. Na UCSD Cooper používá genové pohony k podobnému účelu, k vytváření a studiu komplexních znaků u myší.
Program Genetic Biocontrol of Invasive Rodents (GBIRd) chce s myšmi s genovými pohony dělat víc než jen studovat je v laboratoři. GBIRd, partnerství univerzit, vlád a nevládních organizací řízené neziskovou skupinou Island Conservation, chce tuto technologii využít k eliminaci invazivních hlodavců z ostrovů, kde působí spoušť na původní divokou přírodu. V současné době se k tomuto účelu používají pesticidy, které jsou však drahé a na větších ostrovech s lidskou populací obtížně použitelné. Jsou proveditelné pouze na 15 % ostrovů, říká Royden Saah, vedoucí programu GBIRd. „Snažíme se hledat technologie, které by se postaraly o zbývajících 85 %.“
Členové GBIRd David Threadgill z Texaské A&M University v College Station a Paul Thomas z University of Adelaide v Austrálii vyvíjejí technologie genového pohonu u myší, i když Saah odhaduje, že bude trvat několik let, než budou tyto pohony úspěšně fungovat.
Někteří výzkumníci komárů mezitím doufají, že jako prostředek prevence nemocí vyzkouší něco rafinovanějšího než úplné vyhubení hmyzí populace. V květnovém preprintu7 Omar Akbari a jeho kolegové z UCSD upravili komáry Aedes aegypti tak, aby exprimovali protilátku, která chrání hmyz proti všem čtyřem hlavním kmenům horečky dengue. Nyní tuto protilátku připojují k pohonu, aby zjistili, zda se bude šířit. Akbari také vytváří univerzální genový pohon, který aktivuje toxin, když A. aegypti infikuje jakýkoli virus, nejen dengue. „Chceme v komárovi vytvořit trojského koně,“ říká Akbari. „Když je komár infikován virem – ať už je to dengue, zika, chikungunya, žlutá zimnice nebo cokoli jiného – aktivuje se náš systém, který komára zabije.“
Dá se genový pohon ovládat?“
Předtím, než Kevin Esvelt sestrojil jediný genový pohon založený na CRISPR, budil se studeným potem při pomyšlení na důsledky. „Uvědomil jsem si, aha, hele, tohle se nebude týkat jen malárie, tohle bude potenciálně něco, co by každý jedinec, který dokáže vyrobit transgenní ovocnou mušku, mohl sestrojit k úpravě všech ovocných mušek.“
Není tedy divu, že když Esvelt a genetik George Church v roce 2014 na Harvard Medical School v Bostonu ve státě Massachusetts sestrojili svůj první genový pohon, současně sestrojili i reverzní pohon, který původní pohon na povel přepíše8.
Zbytek oboru je následoval a vyvinul genové pohony s vestavěným ovládáním, externím přepisem nebo obojím. Většinu tohoto úsilí financuje americká Agentura pro pokročilé obranné výzkumné projekty (DARPA), výzkumná složka amerického ministerstva obrany. V roce 2017 program DARPA Safe Genes (Bezpečné geny) oznámil, že v sedmi amerických výzkumných týmech, které zkoumají, jak kontrolovat, potírat a zvrátit genové pohony, utratí 65 milionů dolarů. „Zmírňujeme možnost zneužití, ať už náhodného, nebo nekalého,“ říká Renee Wegrzynová, vedoucí programu Safe Genes.
Esvelt, financovaný v počáteční fázi programu, vymyslel samočinný pohon známý jako daisy drive. Tento pohon je konstruován tak, aby ztrácel jeden článek po druhém, jako když se z řetězu spojeného hlavou se stonkem utrhne jeden květ, dokud se během několika generací nevyčerpá9.
Akbariho tým na UCSD financovaný agenturou DARPA vyvíjí genové pohony, které by se neměly šířit mimo cílovou populaci komárů nebo much. Jeden takový pohon vyžaduje nepřetržité uvolňování po mnoho generací. Když se toto uvolňování zastaví, naředí se divokými verzemi genu a do čtyř let se sám vyhubí. To může být dostatečně dlouhá doba na to, aby se z populace komárů odstranil virus, jako je Zika nebo dengue, říká Akbari. „Je to něco, co je podle mého názoru o něco bezpečnější a stále docela účinné.“ Tým již vyrobil několik verzí těchto pohonů pro A. aegypti, hlavního přenašeče viru dengue10.
Tým Target Malaria také vyvíjí protiopatření, financované agenturou DARPA, které by zastavilo šíření pohonu doublesex v populaci.
Jak lze genové pohony vyzkoušet?
Místo testování v terénu – které smlouva DARPA o bezpečných genech výslovně zakazuje a na které výzkumníci souhlasí, že technologie není připravena – týmy rozšiřují experimenty v klecích a vytvářejí ekologické modely, aby bezpečně prozkoumaly výhody a rizika vypouštění do volné přírody.
V městečku Terni ve střední Itálii Crisanti a Nolan obohatili své klece s komáry o měnící se podmínky prostředí. „Chceme je rozšířit, abychom je mohli testovat v různých genetických prostředích a za realističtějších scénářů,“ říká Nolan, který nyní vede laboratoř na Liverpool School of Tropical Medicine ve Velké Británii. On a Crisanti chtějí replikovat přirozené chování při páření – například samci vytvářejí hejna, aby přilákali samičky – a zjistit, jak to ovlivňuje šíření genového pohonu.
Dynamika šíření pohonu v těchto klecích je zatím „slibná“, říká Crisanti – pohon se předává účinně bez známek rezistence. Pokud se při rozsáhlejších pokusech v klecích neobjeví žádné obavy, předá tým technologii nezávislým skupinám k testování s cílem získat zhruba za tři roky regulační schválení, říká.
Tým Target Malaria také vytváří ekologické modely potenciálních míst vypouštění, aby vypracoval dynamiku v terénu. Nejnovější studie11 modeluje populace komárů ve více než 40 000 sídlech v Burkině Faso a okolních zemích. Zohledňuje řeky, jezera a srážky a také terénní údaje o pohybu komárů. Výsledky11 ukazují, že ke snížení celkového počtu hmyzu bude zapotřebí opakované zavádění modifikovaných komárů v průběhu několika let napříč vesnicemi, nikoliv jednorázové vypuštění.
„Teorie říká, že v zásadě platí, že pokud jednou vypustíte komáry, rozšíří se po celém kontinentu. Ve skutečnosti by se tak dělo velmi pomalu,“ říká populační biolog Charles Godfray z Oxfordské univerzity ve Velké Británii, který spolupracuje se společností Target Malaria a je hlavním výzkumníkem studie.
Další obavou je, že genové pohony mají potenciál změnit celé populace, a tedy i celé ekosystémy. Teoreticky by také mohly negativně ovlivnit lidské zdraví tím, že by způsobily evoluci parazita malárie, který by byl virulentnější nebo by byl přenášen jiným hostitelem, říká molekulární bioložka a bioetička Natalie Koflerová. Je zakládající ředitelkou skupiny Editing Nature na Yaleově univerzitě v New Havenu ve státě Connecticut, která se zaměřuje na environmentální genetické technologie po celém světě. „Tato technologie má potenciál být nesmírně mocná a změnit běh věcí, který možná nejsme schopni předvídat,“ říká Koflerová.
Kdo rozhoduje o tom, kdy použít genový pohon?
Při zkouškách léků může společnost začít s přípravou na testování v terénu už rok nebo dva předem. Genové pohony budou potřebovat více času, říká Okumu. V loňském roce byl členem patnáctičlenné vědecké pracovní skupiny organizované Nadací Národních institutů zdraví, která předložila řadu doporučení12 pro používání genového pohonu komárů v subsaharské Africe.
Zpráva zdůrazňuje, že vlády, komunity a místní vědci budou potřebovat čas, aby si osvojili vědecké poznatky a byli oprávněni tuto technologii regulovat. „Říkám to s plným přesvědčením – nakonec jsou těmi nejlepšími lidmi, kteří mohou tato rozhodnutí učinit, samotné země,“ říká Okumu.
V roce 2017 Kofler shromáždil skupinu vědců a etiků, aby se zabývali společenskými otázkami souvisejícími s genovými pohony13. „Hlavní otázky se soustřeďují kolem spravedlnosti,“ říká Kofler. V diskusích o vypuštění geneticky modifikovaného organismu do afrického prostředí mají podle ní skupiny, které byly historicky marginalizovány, právo být součástí rozhodovacího procesu.
Okumu chce, aby afričtí vědci vyvíjeli a testovali technologii genových pohonů na místní úrovni, což bude vyžadovat respekt a ochotu sponzorů takové úsilí podporovat. „Lidé se bojí neznámého a neznámé je právě teď prezentováno ze západní perspektivy,“ říká Okumu. „Těším se na den, kdy budeme moci tyto konstrukty vytvořit v našich vlastních laboratořích, a tím si vybudovat místní důvěru.“
V srpnu 2018 povolila Národní agentura pro biologickou bezpečnost Burkiny Faso společnosti Target Malaria uvolnit kmen geneticky modifikovaných sterilních samců komára, první svého druhu na africkém kontinentu. Minulý týden tým vypustil přibližně 6 400 komárů, kteří byli geneticky upraveni, ale neobsahují genové jednotky. Vědci doufají, že toto vypuštění zlepší vnímání výzkumu a také poskytne údaje pro budoucí vypouštění.
a přestože myši s genovým pohonem ještě zdaleka nejsou připraveny k vypuštění, GBIRd již spolupracuje s hodnotiteli rizik, etiky a ekology na vytipování ostrova pro první polní pokus. „Chceme si být jisti, že to uděláme správně,“ říká Saah. „Bez ohledu na to, jak rychle se technologie vyvíjejí, můžeme nyní pokročit ve společenských vědách a etice.“
Leave a Reply