Proč má #“HF „# nižší bod varu než voda, přestože #“F „# je elektronegativnější než #“O „#?
Je zde mnoho složitých faktorů. Tohle jsem našel:
- Voda může vytvářet vyváženější síť vodíkových vazeb (dva akceptory a dva donory namísto jednoho donoru a tří akceptorů), čímž je objemový systém rovnoměrněji interagující, a tedy silnější jako celek.
- Voda vytváří rozsáhlejší síť vodíkových vazeb (trojrozměrné tetraedrické lokální prostředí namísto dvourozměrného klikatého prostředí), čímž se objemový systém hůře odpařuje.
- Voda má obecně optimálnější úhel interakce, protože více odpovídá elektronové geometrii molekuly a vyrovnává interakce podél molekulového dipólu, zatímco #“HF „# by měl silnější vodíkovou vazbu (z hlediska hrubých čísel), kdyby interakce byly lineární.
DISCLAIMER: DLOUHÁ ODPOVĚĎ!
Vodíková vazba je nejsilnější mezimolekulární silou jak v #“HF „#, tak v #“H“_2 „O „#. Síla interakce závisí na interakční vzdálenosti, interakčním úhlu a extenzitě sítě.
Když vytáhneme všechny interakce vodíkové vazby a předpokládáme čistou vodu a čistý #“HF „#, dostaneme (při izolaci vybrané množiny molekul z nekonečné matice)#““^()##““^()#:
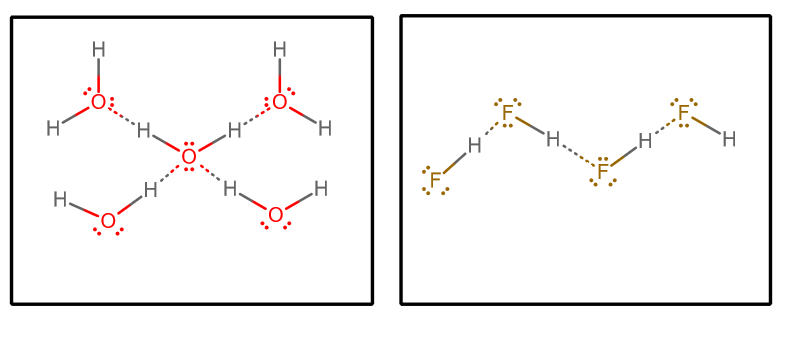
Můžeme pak zvážit několik faktorů:
- Počet donorů a akceptorů vodíkových vazeb
Každá molekula vody může přijmout dvě vodíkové vazebné interakce (prostřednictvím osamělých párů) a darovat dvě vodíkové vazebné interakce (prostřednictvím vodíků).
Na druhé straně každá molekula #“HF „# přijímá tři vodíkové vazebné interakce (prostřednictvím osamělých párů) a daruje pouze jednu (prostřednictvím vodíku).
Dalo by se tedy tvrdit, že voda má vyváženější vodíkovou vazebnou síť, což způsobuje, že se objemový systém celkově méně vypařuje. To by podporovalo vyšší bod varu vody oproti #“HF „#.
- Elektronegativita #bb(„F“)# a #bb(„O“)#
#“F „# je elektronegativnější, takže si snadněji udržuje elektronovou hustotu; proto se očekává, že osamělé páry budou slabšími donory vodíkových vazebných interakcí než osamělé páry na #“O „#.
Z toho by se zdálo, že každá jednotlivá vodíková vazebná interakce je slabší, což by podporovalo vyšší bod varu vody oproti #“HF „#, ALE tomu odporuje následující bod.
- Průměrná síla surové vodíkové vazby v #bb(„HF“)# vs. vodě
#“O“-„H „cdotcdotcdot: „O“-#, #DeltaH_(„H“-„vazba“) ~~ „21 kJ/mol „#
#“F“-„H „cdotcdotcdot: „F“-#, #DeltaH_(„H“-„vazba“) ~~ „161.5 kJ/mol „#
Tento údaj z Wikipedie naznačuje, že #“HF „# má silnější interakce vodíkové vazby mezi molekulami #“HF „# než ve vodě.
To by nepodpořilo experimentální důkaz, že #“HF „# má mnohem nižší bod varu, ale to je také jen hrubé číslo a nebere v úvahu například interakční úhly v objemovém systému.
- Pozorované úhly vodíkových vazeb a rozměry interakcí
#“HF „#, jakožto lineární molekula, má podle pozorování klikaté interakce vodíkových vazeb, ve dvou rozměrech, s úhly #116^@#. Optimálnější úhel by byl #180^@#, protože by tak vznikaly přímější dipólové interakce. To omezuje sílu vodíkové vazby #“HF „#.
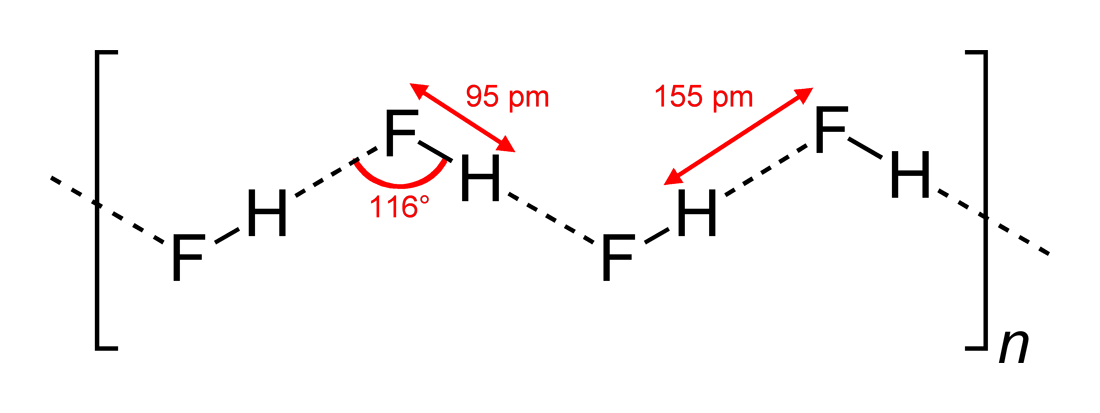
Voda, jakožto ohnutá molekula s tetraedrickou elektronovou geometrií, se může vodíkově vázat ve třech rozměrech.
Tady je příklad tetraedrického klastru, který se nachází v lokálním prostředí interakce vodíkové vazby ve vodě:
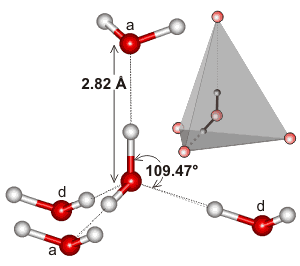
Možná právě díky extenzitě sítě vodíkových vazeb a tomu, jak má tendenci odpovídat elektronové geometrii vody, je teplota varu vody tak vysoká. To by podporovalo vyšší bod varu vody oproti #“HF „#.
Celkově jsou to nejméně problematické faktory, které mě napadly:
- Voda může vytvářet vyváženější síť vodíkových vazeb (dva akceptory a dva donory místo jednoho donoru a tří akceptorů), díky čemuž je objemový systém rovnoměrněji interagující, a tedy silnější jako celek.
- Voda vytváří rozsáhlejší síť vodíkových vazeb (trojrozměrné tetraedrické lokální prostředí namísto dvourozměrného klikatého prostředí), čímž se objemový systém hůře odpařuje.
- Voda má obecně optimálnější úhel interakce, protože více odpovídá elektronové geometrii molekuly a zarovnává interakce podél molekulového dipólu, zatímco #“HF „# by měl silnější vodíkovou vazbu (z hlediska hrubých čísel), pokud by interakce byly lineární.
.
Leave a Reply