Co je elektronegativita?
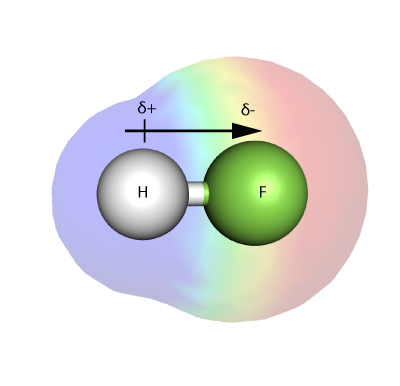
ELEKTRONEGATIVITA
Elektronegativita je míra toho, jak silně je atom – v molekule – schopen přitahovat elektrony ve vazbě k sobě.
Faktory ovlivňující elektronegativitu:
1) Atomové číslo
Atomové číslo je počet protonů v jádře atomu.
Určuje chemické vlastnosti prvku a jeho místo v periodické tabulce.
Čím vyšší je atomové číslo, tím silnější je elektronegativita.
2) Atomový poloměr
Atomový poloměr chemického prvku se obvykle měří vzdáleností od středu jádra k hranici vnější vrstvy elektronů.
Čím větší jsou atomové poloměry, tím slabší je elektronegativita.
Příklad atomového poloměru atomu kyslíku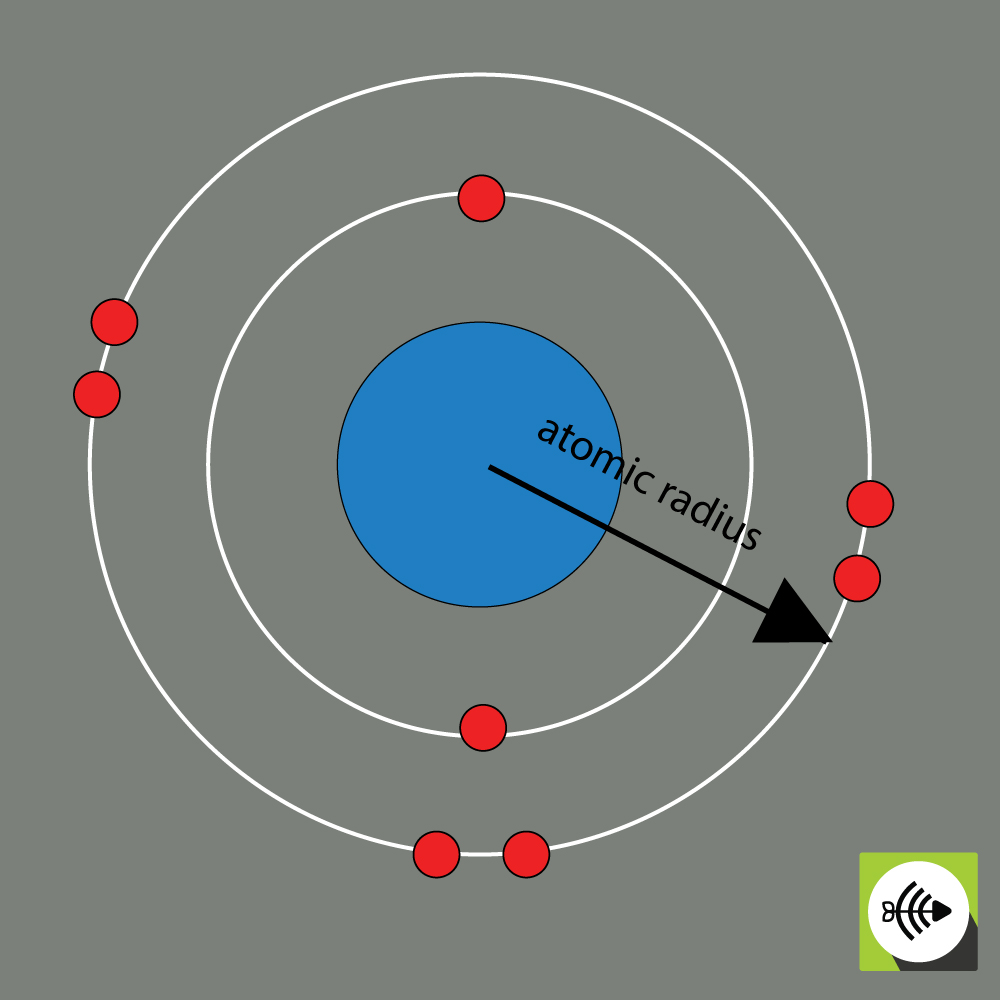
V čem se měří elektronegativita?
Nejběžnějším měřením elektronegativity je Paulingova stupnice, kterou navrhl dvojnásobný nositel Nobelovy ceny Linus Pauling. Stupnice elektronegativity pro prvky říká, jak silně k sobě jednotlivé prvky (vzhledem k sobě navzájem) mohou přitahovat vazebné elektrony. Čím vyšší je číslo elektronegativity, tím více se atom snaží přitáhnout elektrony k sobě.
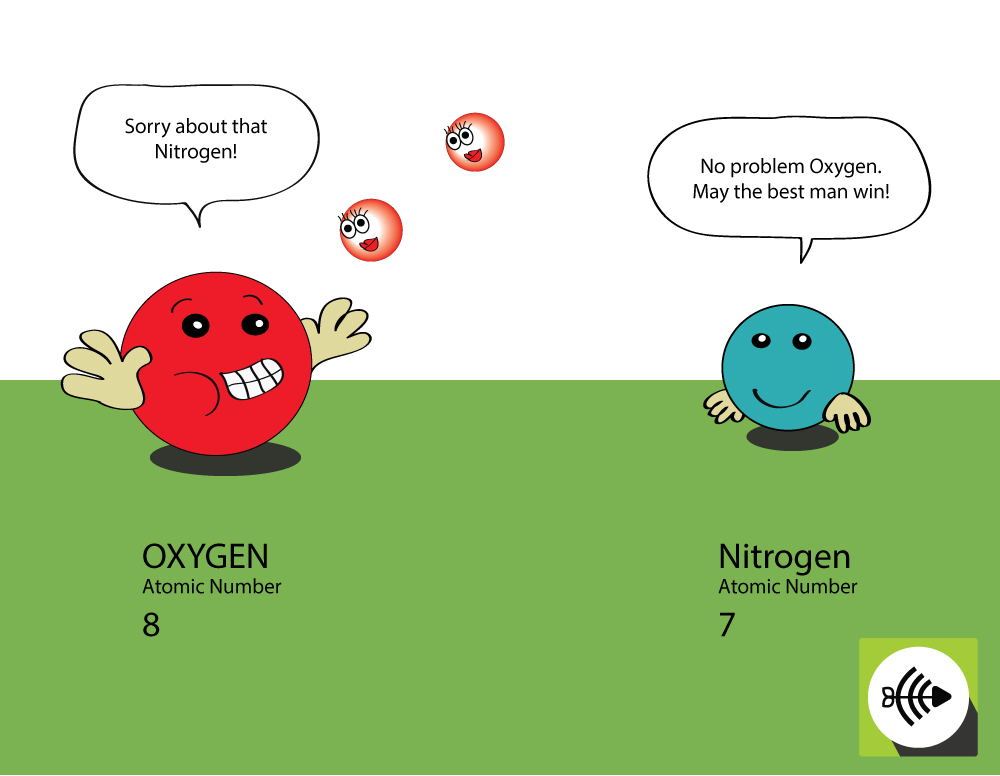
Proč je kyslík elektronegativnější než dusík?
Kyslík má vyšší atomové číslo
- Kyslík má v jádře 8 protonů, kdežto dusík pouze 7 protonů.
- Vazbový pár elektronů bude pociťovat větší přitažlivost od jádra kyslíku než od jádra dusíku, elektronegativita kyslíku je tedy větší.
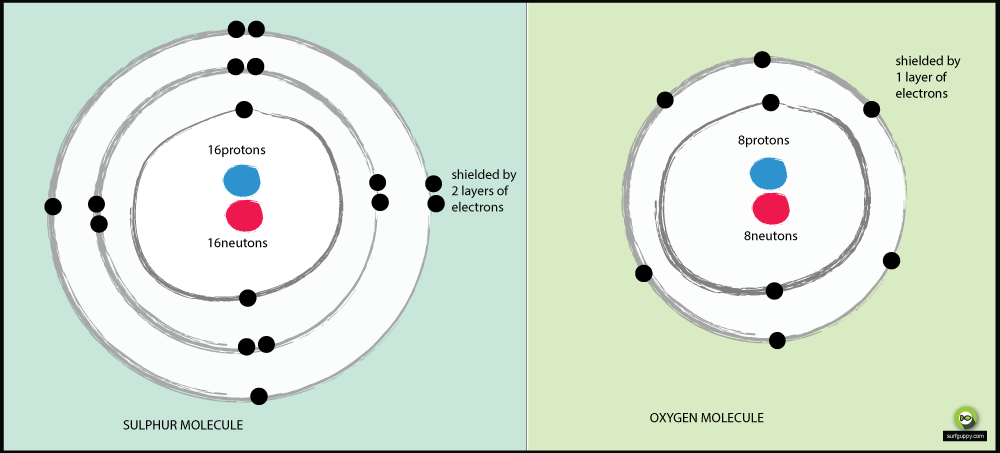
Proč je síra méně elektronegativní než kyslík?
Důvody, proč je kyslík elektronegativnější než síra:
- Kyslík má 2 energetické hladiny, síra 3
- Vazbové elektrony v síře jsou dále od jádra atomu
- Když jsou vazebné elektrony dále od jádra atomu, je přitažlivost od jádra menší
- Vazbový pár elektronů v kyslíku bude pociťovat větší přitažlivost od svého jádra než vazebné elektrony síry
- Kyslík je tedy elektronegativnější atom
Před pokračováním si prosím přečtěte něco o valenčních elektronech. Valenční elektrony

Menší atom má vyšší elektronegativitu
Trendy elektronegativity přítomné v periodické tabulce
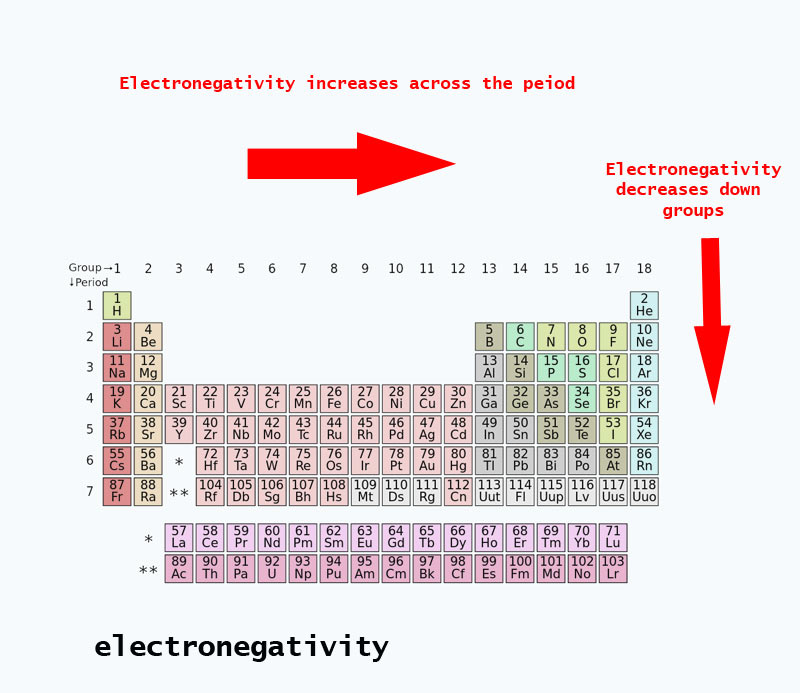
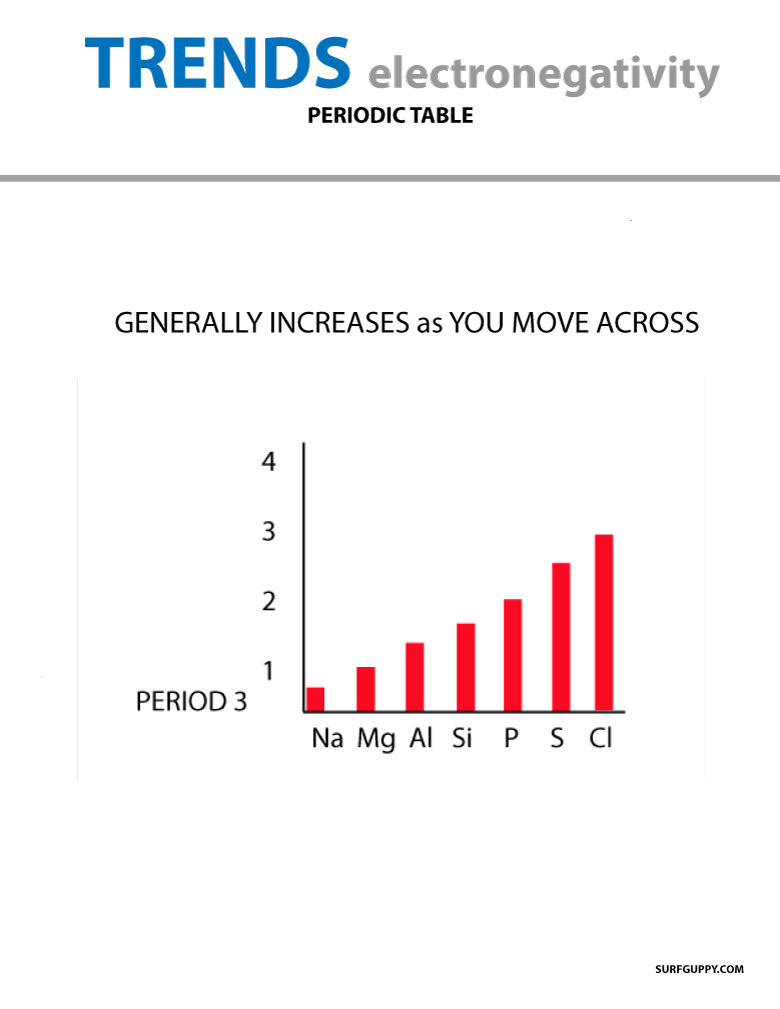
Při pohybu po periodické tabulce se zvyšuje počet protonů v jádře (bez zvýšení energetické hladiny), proto se zvyšuje elektronegativita.
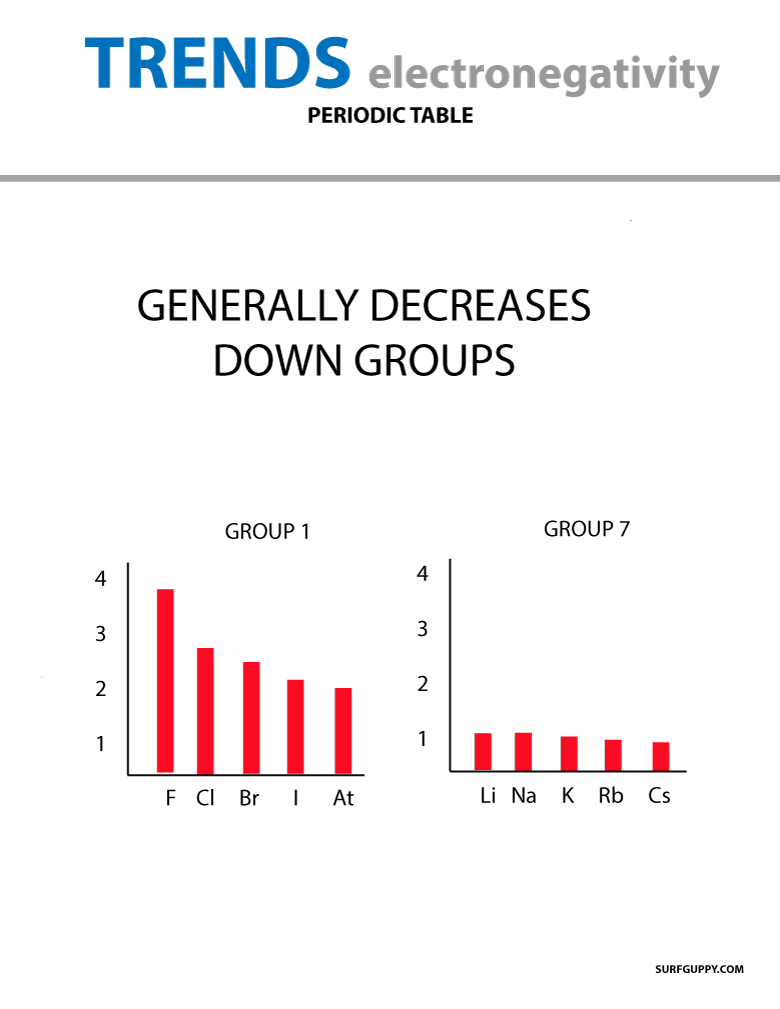
Pokud se atomové číslo zvyšuje směrem dolů po skupině, dochází také ke zvýšení energetických hladin. Atomový poloměr je větší, proto elektronegativita klesá.
PERIODICKÁ TABULKA ELEKTRONEGATIVITY
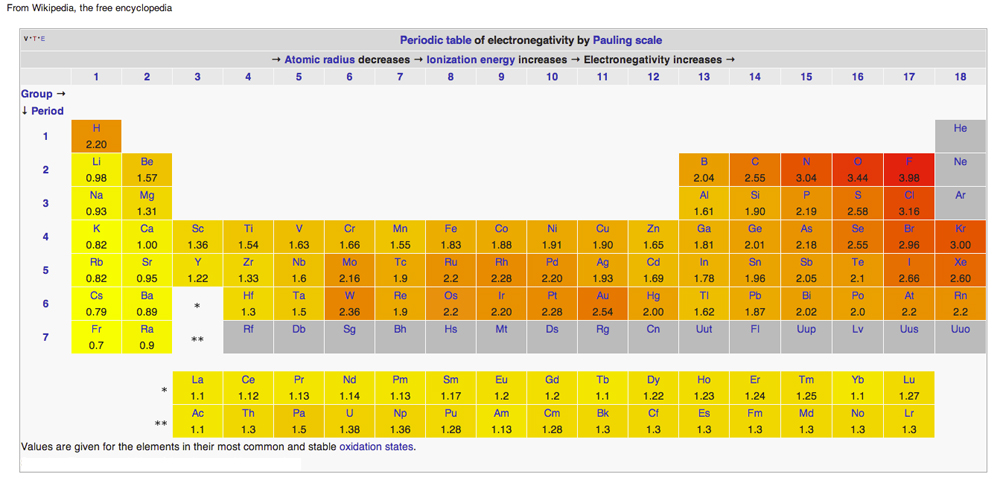 Diagram z Wikipedie vydaný pod licencí Creative Common
Diagram z Wikipedie vydaný pod licencí Creative Common
.
Leave a Reply