8.3: Plyny a tlak
Cíle výuky
- Popsat plynnou fázi.
Plynná fáze je mezi třemi stavy hmoty jedinečná tím, že existují jednoduché modely, které můžeme použít k předpovědi fyzikálního chování všech plynů – nezávisle na jejich identitě. Pro pevné a kapalné skupenství to udělat nemůžeme. Vývoj tohoto chápání chování plynů ve skutečnosti představuje historický předěl mezi alchymií a moderní chemií. První pokroky v chápání chování plynů učinil v polovině 16. století anglický vědec Robert Boyle, který založil Královskou společnost (jednu z nejstarších vědeckých organizací na světě).
Jak je možné, že můžeme modelovat všechny plyny nezávisle na jejich chemické identitě? Odpověď je ve skupině tvrzení, která se nazývá kinetická teorie plynů:
- Plyny se skládají z malých částic, které jsou od sebe vzdáleny velké vzdálenosti.
- Částice plynů se neustále pohybují, zažívají srážky s jinými částicemi plynu a stěnami své nádoby.
- Rychlost částic plynu souvisí s teplotou plynu.
- Částice plynu mezi sebou neprožívají žádnou přitažlivou ani odpudivou sílu.
Všiml sis, že žádné z těchto tvrzení se netýká identity plynu? To znamená, že všechny plyny by se měly chovat podobně. Plyn, který se těmito tvrzeními dokonale řídí, se nazývá ideální plyn. Většina plynů vykazuje mírné odchylky od těchto tvrzení a nazývají se reálné plyny. Existence reálných plynů však nesnižuje význam kinetické teorie plynů.
Jeden z výroků kinetické teorie zmiňuje srážky. Protože se částice plynu neustále pohybují, dochází také k jejich neustálým srážkám mezi sebou a se stěnami jejich nádoby. Při odrazu částic plynu od stěn nádoby dochází k působení sil (obrázek \(\PageIndex{1}\)). Síla vytvořená částicemi plynu vydělená plochou stěn nádoby dává tlak. Tlak je vlastnost, kterou můžeme měřit u plynu, ale obvykle neuvažujeme tlak u pevných látek nebo kapalin.
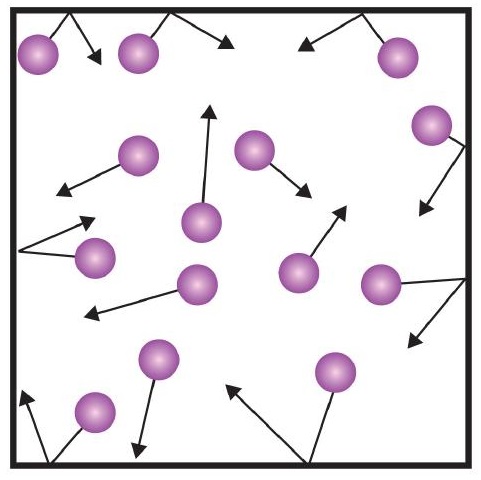
Základní jednotkou tlaku je newton na metr čtvereční (N/m2). Tato kombinovaná jednotka je nově definována jako pascal (Pa). Jeden pascal není příliš velká velikost tlaku. Užitečnější jednotkou tlaku je bar, což je 100 000 Pa (1 bar = 100 000 Pa). Dalšími běžnými jednotkami tlaku jsou atmosféra (atm), která byla původně definována jako průměrný tlak zemské atmosféry na úrovni hladiny moře, a mmHg (milimetry rtuti), což je tlak vytvořený sloupcem rtuti vysokým 1 mm. Jednotka milimetr rtuti se také nazývá torr, pojmenovaná podle italského vědce Evangelisty Torricelliho, který v polovině 16. století vynalezl barometr. Přesnější definice atmosféry v jednotkách torr říká, že v 1 atm je přesně 760 torrů. Jeden bar se rovná 1,01325 atm. Vzhledem ke všem vztahům mezi těmito jednotkami tlaku je schopnost převádět z jedné jednotky tlaku na druhou užitečnou dovedností.
Příklad \(\PageIndex{1}\):
Napište převodní součinitel, který určí, kolik atmosfér je v 1,547 mmHg.
Řešení
Protože 1 mmHg se rovná 1 torru, je daný tlak také roven 1,547 torru. Protože v 1 atm je 760 torrů, můžeme k matematickému převodu použít tento převodní koeficient:
\(\mathrm{1,547\: torr\times \dfrac{1\: atm}{760\: torr}=2.04\: atm}\)
Všimněte si, jak se jednotky torr algebraicky ruší.
Cvičení \(\PageIndex{1}\): Odpověď
\(\mathrm{9,65\: atm\times \dfrac{760\: mm Hg}{1\: atm}=7,334 \: mm Hg}\).
Kinetická teorie také říká, že mezi jednotlivými částicemi plynu neexistuje žádná interakce. Přestože víme, že v reálných plynech ve skutečnosti existují mezimolekulární interakce, kinetická teorie předpokládá, že částice plynu jsou od sebe tak daleko, že se jednotlivé částice navzájem „necítí“. Proto můžeme částice plynu považovat za malé kousky hmoty, jejichž identita není pro určité fyzikální vlastnosti důležitá.
Cvičení na přehled pojmů
-
Co je to tlak a jaké jednotky používáme k jeho vyjádření?
Odpověď
-
Tlak je síla na jednotku plochy; jeho jednotkami mohou být pascaly, torry, milimetry rtuti nebo atmosféry.
Klíčové poznatky
- Plynná fáze má určité obecné vlastnosti charakteristické pro tuto fázi.
Cvičení
-
Co je to kinetická teorie plynů
-
Podle kinetické teorie plynů se jednotlivé částice plynu (vždy, často, nikdy) pohybují.
-
Proč plyn vyvíjí tlak?
-
Proč nám kinetická teorie plynů umožňuje předpokládat, že všechny plyny budou vykazovat podobné chování?
-
Uspořádejte následující tlakové veličiny od nejmenší po největší: 1 mmHg, 1 Pa a 1 atm.
-
Která jednotka tlaku je větší – torr nebo atmosféra?
-
Kolik torrů je v 1 atm?56 atm?
-
Převeďte 760 torrů na pascaly.
-
Tlak v krvi se vyjadřuje v milimetrech rtuti. Jaký bude krevní tlak v atmosférách, jestliže systolický krevní tlak pacienta je 120 mmHg a diastolický krevní tlak je 82 mmHg? (V medicíně by se takový krevní tlak uváděl jako „120/82“, řečeno jako „sto dvacet na osmdesát dva“)
-
V předpovědích počasí se barometrický tlak vyjadřuje v palcích rtuti (in. Hg), přičemž na každý 1 in. Hg připadá přesně 25,4 mmHg. Jaký je barometrický tlak v milimetrech rtuti, jestliže je barometrický tlak hlášen jako 30,21 in. Hg?“
Odpovědi
-
Plyny se skládají z malých částic, které jsou od sebe vzdáleny velké vzdálenosti. Částice plynu se neustále pohybují a zažívají srážky s jinými částicemi plynu a stěnami své nádoby. Rychlost částic plynu souvisí s teplotou plynu. Částice plynu mezi sebou neprojevují žádnou přitažlivou ani odpudivou sílu.
-
Plyn působí tlakem, protože se jeho částice odrážejí od stěn nádoby.
-
1 Pa, 1 mmHg a 1 atm
-
1,190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
.
Leave a Reply