Anatomie der Herzknoten und des spezialisierten atrioventrikulären Reizleitungssystems | Revista Española de Cardiología
EINFÜHRUNG
Die klassischen Studien von Stannius1 aus dem Jahr 1852 waren die ersten, in denen vorgeschlagen wurde, dass die Erregungsleitung des Herzens myogen ist. Vor etwa einem Jahrhundert wurde gezeigt, dass spezialisiertes Muskelgewebe für die Auslösung und Ausbreitung des Herzschlags verantwortlich ist. Im Jahr 1906 bestätigte Sunao Tawara2 die Existenz eines Muskelbündels, das bereits 1893 von His3 beschrieben worden war. Ebenfalls im Jahr 1906 bestätigten Keith und Flack4 die Existenz des His-Tawara-Systems. Ein Jahr später beschrieben sie die Struktur des sinoatrialen (SA) Knotens.5
Obwohl Purkinje6 als erster spezialisierte ventrikuläre Fasern beschrieb, war er sich ihrer Bedeutung für die Struktur des Herzens nicht bewusst, und es war Tawara2, der zeigte, dass das von His beschriebene Muskelbündel mit den ventrikulären Purkinje-Fasern zusammenhängt.6 Tawaras Studien wurden kürzlich ins Englische übersetzt,7 obwohl die erste Übersetzung eines Teils seiner Arbeit in diese Sprache von Robb8 in seinem Lehrbuch von 1965 vorgenommen wurde. Diese Werke sind grundlegende Lektüre für alle Forscher, die das kardiale Reizleitungssystem (CS) untersuchen wollen.
Komponenten des spezifischen atrioventikulären Reizleitungssystems
Das Muskelbündel, das die Vorhöfe mit den Herzkammern verbindet, wurde von His3 als „durchdringendes Bündel“ beschrieben. His beobachtete jedoch nicht die histologische Fortsetzung dieses Bündels im rechten Vorhof mit dem atrioventrikulären (AV) Knoten, den Ventrikeln oder den ventrikulären Purkinje-Zellen. Es war Tawara2, der diese Verbindung während seiner Doktorarbeit unter der Leitung von Aschoff erkannte. Zuvor, im Jahr 1893, hatten sowohl Kent9 als auch His3 muskuläre AV-Verbindungen beschrieben, die viele Jahre lang für Verwirrung sorgten.10 Später stellte man fest, dass diese Verbindungen nicht in gesunden, sondern in kranken Herzen zu finden waren.
Anknüpfend an die Erkenntnisse von Kent und His suchten sowohl klinische Kardiologen als auch Physiologen nach der Struktur, die für die Erzeugung des Herzimpulses verantwortlich war. Man vermutete, dass sich diese im Bereich der Verbindung zwischen der oberen Hohlvene und dem rechten Vorhof befindet; unter experimentellen Bedingungen ist dies der letzte Teil des Herzens, der aufhört zu schlagen (das sogenannte ultimum moriens). Im Jahr 1907 unterschieden Keith und Flack5 den SA- oder Sinusknoten bei allen von ihnen untersuchten Säugetieren, einschließlich des Menschen. Die Zellen, aus denen er sich zusammensetzt, wurden als Ursprungsort des Herzimpulses angesehen.
Der CS entsteht im SA-Knoten, der sich im oberen vorderen rechten Vorhof befindet (Abbildung 1). Der AV-Knoten befindet sich in einer tieferen, hinteren Position im Vorhof. Der CS erstreckt sich vom AV-Knoten bis zum durchdringenden His-Bündel und teilt sich dann in den linken und den rechten Bündelast, die durch die Herzscheidewand absteigen und von einer Bindegewebshülle umgeben sind, die sie vom umgebenden Muskelgewebe isoliert. Innerhalb des Herzmuskels sind sie mit dem Purkinje-Netzwerk verbunden (Abbildung 1).
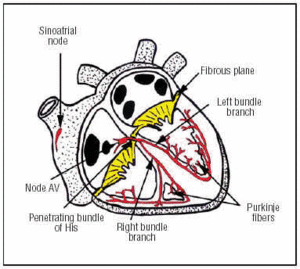
Abb. 1. Schematische Darstellung des kardialen Reizleitungssystems (rot). Das durchdringende His-Bündel perforiert die faserige atrioventrikuläre (AV) Ebene.
Morphologisch-makroskopische Bereiche von Interesse
Mehrere makroskopische Bereiche von Interesse helfen bei der Lokalisierung des kardialen CS. Der SA-Knoten, der subepikardial liegt (Abbildung 2a), ist in die Verbindung zwischen der Muskulatur der Vena cava superior und der des Vorhofanhangs eingekeilt. Seine Basis liegt dem terminalen Kamm gegenüber. Der Abstand zwischen dem SA-Knoten und dem Epikard beträgt 0,3±0,1 mm.11 Bei etwa 10 % der Personen erstreckt sich der Knoten nicht in Richtung der Vena cava inferior, sondern liegt hufeisenförmig um den unteren Teil der Mündung der Vena cava superior.12 Der AV-Knoten befindet sich an der Basis der Vorhofscheidewand an der Spitze eines dreieckigen Bereichs, der erstmals von Koch dargestellt wurde.13 Dieses Dreieck befindet sich auf der endokardialen Oberfläche des rechten Vorhofs (Abbildungen 2b und c), wird anterior durch den Ansatz des Septumblättchens der Trikuspidalklappe und posterior durch eine Fasersehne begrenzt, die als Todaro-Sehne bekannt ist. Diese Sehne ist die faserige subendokardiale Fortsetzung der Eustachischen Klappe und setzt in der Vorhofmuskulatur an, die die Öffnung des Sinus coronarius von der Fossa ovale trennt. Die Spitze dieses Dreiecks wird durch die Verbindung der oben erwähnten vorderen und hinteren Begrenzung gebildet und entspricht dem zentralen Faserkörper (CFB) des Herzens. Die Basis des Dreiecks wird durch die Öffnung des Sinus coronarius und den Vorhof des rechten Vorhofs gebildet, der das Septumblatt der Trikuspidalklappe trägt. Diese Basis ist den Elektrophysiologen als septaler Isthmus bekannt, und hier wird die Radiofrequenzablation der langsamen Bahn bei Patienten mit AV-Knoten-Reentrant-Tachykardie durchgeführt.14
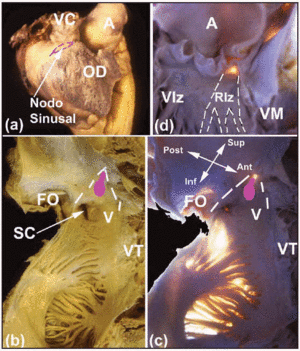
Abb. 2. A: Seitliche epikardiale Ansicht des rechten Vorhofs mit der Lage des SA-Knotens, dargestellt durch die gestrichelte rosa Linie. B und C: Endokardiale Ansichten (normal und mit Transillumination) der hinteren und septalen Wände des rechten Vorhofs, um die ovale Fossa (OF) und die Grenzen des Koch’schen Dreiecks (gestrichelte weiße Linien), die Todazo-Sehne (TT) und den Ansatz des septalen Höckers der Trikuspidalklappe (TV) zu zeigen. Das Vestibulum (V) des rechten Vorhofs und die Mündung des Koronarsinus (CS) bilden die untere Grenze. Die Lage des AV-Knotens ist durch ein ovales Knötchen (rosa) dargestellt. D: Ansicht des linken Ventrikels zur Darstellung des membranösen Septums (Transillumination). Dies ist der Austrittspunkt des His-Bündels und seine Kontinuität mit den rechten und linken Bündelästen. Der linke Bündelast (LBB) ist mit gestrichelten weißen Linien markiert. A bedeutet Aorta; AA, Vorhofanhang; VC, Vena cava superior; RV, rechter Ventrikel; LV, linker Ventrikel; MV, Mitralklappe.
Die Fortsetzung der AV-Leitung erfolgt über das penetrierende His-Bündel, den einzigen Teil der Leitungsachse, der die CFB durchdringt. Das CFB wird durch die Verbindung des Bindegewebes der Aorten- und Mitralklappe mit dem Septumblatt der Trikuspidalklappe – dem so genannten rechten Fasertrigon – und dem membranösen Teil des Interventrikelseptums gebildet. Bei vielen Säugetierherzen ist das Trigon faserig, aber Rinderherzen haben eine zentrale Knochen- oder Knorpelmasse (das Os cordis). Im Gegensatz dazu ist das faserige Gewebe der CFB des Pottwals sehr locker. Der membranöse Teil oder das Septum, das unterschiedlich lang sein kann, ist ein guter Anhaltspunkt für die Lokalisierung des AV-Bündels von His. Dieses erscheint oberhalb des membranösen Teils, nachdem es das rechte Fasertrigon gekreuzt hat (Abbildung 2d), und teilt sich dann in den linken und rechten Bündelast. Der rechte Ast verläuft durch die Septummuskulatur an der Basis des medialen Papillarmuskels des rechten Ventrikels. Anschließend wird er zu einem dünnen Strang, der tief in die septomarginale Trabekel oder das Moderatorenband eindringt, das die medialen und vorderen Papillarmuskeln verbindet. Der Ursprung des linken Astes liegt unterhalb der Kommissur zwischen dem rechten und dem nicht-koronaren Höcker der Aortenklappe; anschließend verläuft er durch das Subendokard des Interventrikelseptums (Abbildung 2d). Ihr Verlauf ist manchmal aufgrund der glänzenden fibrösen Lamina, die sie umhüllt, sichtbar. Der proximale Teil des linken Astes ist viel länger als der des rechten. Gelegentlich ist bei fetalen oder Säuglingsherzen ein dritter Ast zu sehen, der „dead-end tract „15 genannt wird und das His-Bündel in anterio-superiorer Richtung zur Aortenwurzel fortsetzt.
Struktur der Knoten und des atrioventrikulären Erregungsleitungssystems
Studien, bei denen ähnliche histologische Techniken wie die von Tawara2 und späteren Forschern wie Davies16 und Truex et al17 (um nur einige zu nennen) angewandt wurden, haben gezeigt, dass das ZNS des Menschen ganz ähnlich wie das anderer Säugetiere aufgebaut ist (mit leichten Abweichungen zwischen den Arten und zwischen den Herzen). Tawara2 berichtete über die Abgrenzung der spezialisierten Myozyten von den normalen oder arbeitenden Myozyten durch eine dünne Bindegewebsschicht, die unter dem Lichtmikroskop sichtbar ist, und darauf beruhen die von Aschoff18 und Mönckeberg19 vorgeschlagenen Kriterien für die histologische Identifizierung des spezialisierten Myokards. Einfach ausgedrückt, heben sich spezialisierte Myozyten bei der Betrachtung unter dem Lichtmikroskop von den Arbeitsmyozyten ab und können von einem histologischen Schnitt zum nächsten „verfolgt“ werden. In seiner Monographie zog es Robb8 vor, das leitende Gewebe mit dem Begriff „verbindendes“ statt „leitendes“ System zu definieren, da histologische Präparate die Zellmorphologie besser definieren als die Funktion. Er beobachtete auch Unterschiede in der Beschaffenheit des spezialisierten Myokards in Abhängigkeit von der Frische des Autopsiematerials und den verwendeten Fixierungs- und Färbemethoden. Tawara2 war sich dessen bewusst und wies auf die Heterogenität der Morphologie der spezialisierten Myozyten selbst in histologischen Schnitten des Herzens hin. Innerhalb einer bestimmten Spezies hängen die deutlichsten Unterschiede mit dem Alter der untersuchten Individuen zusammen.20 In den letzten Jahren wurden verschiedene molekulare und immunhistochemische Marker verwendet, um das leitfähige Gewebe in embryonalen Herzen von Menschen und anderen Säugetieren zu lokalisieren. Es wurde jedoch kein spezifischer Marker gefunden, der dieses Gewebe bei erwachsenen Menschen hervorheben kann.
Im normalen menschlichen Herzen erfüllen die SA- und AV-Knoten nicht die Kriterien von Aschoff und Mönckeberg18,19 , da sie nicht durch Binde- oder Fettgewebe vom umgebenden Myokard elektrisch isoliert sind. Vielmehr treten sie nach einem kleinen Bereich, der aus Übergangszellen besteht, in Kontakt mit den Arbeitsfasern des Vorhofs. Im SA-Knoten unterschieden Keith und Flack5 zwischen Sinus- und Arbeitszellen. Tawara2 wies jedoch auf die Schwierigkeiten hin, die er bei der Unterscheidung der Zellen des AV-Knotens von denen des His-Bündels hatte. Er schlug daher vor, dass der Unterschied zwischen ihnen rein anatomisch ist. Auf der Grundlage dieser Definition wird der Teil des CS, der vollständig vom CFB umhüllt ist, als penetrierendes Bündel oder His-Bündel bezeichnet (Abbildung 3a). Der atriale Anteil vom proximalen Reizleitungssystem bis zum His-Bündel wird als AV-Knoten bezeichnet (Abbildung 3b). Diese anatomische Unterscheidung ist logisch, da die Isolierung des penetrierenden His-Bündels verhindert, dass es in direkten Kontakt mit der elektrischen Aktivität des afferenten Vorhofs kommt. Jegliche Vorhofaktivität muss daher zuvor durch den AV-Knoten geleitet werden.
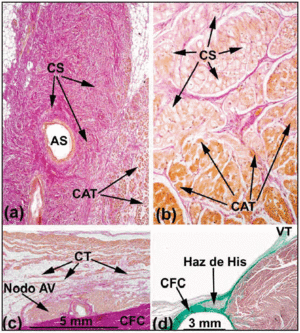
Abb. 3. Sagittale histologische Schnitte des sinoatrialen (SA) Knotens des menschlichen (a;x10) und des Schweineherzens (b;x40), gefärbt mit der van Gieson Methode. Man beachte den Kontakt zwischen Sinuszellen (SC) und Arbeitsvorhofzellen (WAC). Sinuszellen zeichnen sich dadurch aus, dass sie klarer sind und in eine größere Menge Bindegewebe (rot) eingebettet sind. c: van Gieson gefärbter Schnitt durch die mittlere Zone des Kochschen Dreiecks. Man beachte die Form des kompakten AV-Knotens und die Übergangszellen (TC) in Kontakt mit der konvexen Oberfläche des kompakten Knotens. d: Masson’s Trichrom gefärbter Schnitt, der das durchdringende His-Bündel zeigt, das von fibrösem Gewebe (grün) aus dem CFB umgeben ist. SNA bedeutet Sinusknotenarterie; CFB, zentraler Faserkörper; TV, Trikuspidalklappe.
Die eigentliche Funktion des SA-Knotens besteht darin, die Quelle für den Herzimpuls zu sein. Der SA-Knoten beim Menschen ist eine bogenförmige oder fusiforme Struktur. Histologisch besteht er aus Zellen, die etwas kleiner sind als normale Arbeitszellen und in Bündeln angeordnet sind. Diese vermischen sich ohne räumliche Ordnung, färben nur schwach und sind in eine dichte Bindegewebsmatrix eingebettet (Abbildungen 3 a und b). Mit zunehmendem Alter nimmt die Menge des Bindegewebes in Bezug auf die von den Knotenzellen eingenommene Fläche zu.21 An der Peripherie des Knotens sind spezialisierte Zellen mit denen des arbeitenden Myokards vermischt (Abbildungen 3a und b). Darüber hinaus wurden mehrere Ausstrahlungen oder Fortsätze beschrieben, die mit dem arbeitenden Vorhofmyokard interdigitieren. Diese dringen intramyokardial in den terminalen Kamm sowie in die obere und untere Hohlvene ein. Der SA-Knoten ist um eine Arterie angeordnet, die als Sinusknotenarterie bezeichnet wird und zentral oder exzentrisch innerhalb des Knotens verlaufen kann. In 29 % der menschlichen Herzen verzweigt sich diese Arterie innerhalb des Knotens.11 Der SA-Knoten ist auch eng mit dem autonomen Nervensystem verbunden. Es wurde vermutet, dass die meisten dieser Nervenfasern parasympathisch sind, während die sympathischen Fasern um die Blutgefäße des Knotens konzentriert sind.23
Die eigentliche Funktion des AV-Knotens ist die Verzögerung des Herzimpulses. Beim Menschen besteht dieser Knoten aus einem kompakten Teil und einem Bereich mit Übergangszellen. Ersterer ist halboval und liegt über dem CFB (Abbildung 3c). In den Abschnitten nahe der Basis des Koch’schen Dreiecks teilt sich der kompakte Teil des Knotens in zwei Erweiterungen oder Verlängerungen. Die Arterie, die den AV-Knoten vaskularisiert, befindet sich in der Regel zwischen diesen. Die Länge dieser Verlängerungen variiert von Herz zu Herz.24 Die Größe der Übergangszellen liegt zwischen der des AV-Knotens und der der Vorhof-Arbeitszellen. Sie sind von einer größeren Menge an Bindegewebszellen umgeben als die Arbeitszellen, aber sie sind nicht vom angrenzenden Myokard isoliert. Vielmehr bilden sie eine Art Brücke zwischen dem Arbeits- und dem Knotenmyokard, sammeln elektrische Informationen von den Vorhofwänden und leiten sie an den AV-Knoten weiter.
Wie der Impuls vom SA-Knoten den AV-Knoten erreicht, ist umstritten. Einige Autoren haben die Existenz spezialisierter Bahnen zwischen ihnen vorgeschlagen.25 Unsere Studien unterstützen diese Idee nicht, sondern favorisieren die Hypothese, dass die arbeitenden Muskelfasern selbst (und ihre geometrische Anordnung in den Vorhofwänden) dafür verantwortlich sind, dass die Reizleitung in einigen Bereichen des Vorhofs schneller ist als in anderen.26
Der AV-Knoten setzt sich distal mit dem durchdringenden His-Bündel fort (Abbildung 3d), obwohl es leichte Unterschiede in Bezug auf die zelluläre Anordnung zwischen diesen beiden Strukturen gibt, einschließlich der Anordnung der His-Bündel-Zellen in einer eher parallelen Weise. Die Erklärung dafür könnte morphologischer Natur sein: Das His-Bündel wird allmählich vom Bindegewebe des CFB umgeben und wird so zu einer Leitungsbahn, die Informationen an die Ventrikel weiterleitet.
Der AV-Knoten des Hundes ist kleiner als der des Menschen, hat aber ein längeres durchdringendes His-Bündel.27 Einige Autoren28 interpretieren dies so, dass ein Teil des AV-Knotens des Hundes innerhalb des CFB liegt. Beim Kaninchen beschreiben andere Autoren29 einen Teil des His-Bündels so, als ob es einen Teil des AV-Knotens bilden würde, was jedoch ein Fehler ist (Abbildungen 4a-d). Der auffälligste morphologische Unterschied zwischen dem AV-Knoten des Hundes und denen des Kaninchens und des Menschen besteht darin, dass der AV-Knoten des Hundes nicht von Übergangszellen bedeckt ist. Bei Ratten (mit einer 10-mal höheren Ruheherzfrequenz als bei Hunden oder Menschen) ist der AV-Knoten proportional mit dem des Hundes vergleichbar, aber der CFB ist kleiner.
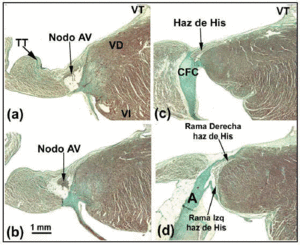
Abb. 4. Diese zusammengesetzte Abbildung zeigt den atrioventrikulären (AV) Knoten sowie das His-Bündel und seine rechten und linken Bündeläste beim Kaninchen. Der horizontale Balken in b entspricht 1 mm (für alle Bilder gleich). Masson’s Trichrom-Färbung. A bezeichnet die Aorta; TT, Todaro-Sehne; RV, rechter Ventrikel; LV, linker Ventrikel; TV, Trikuspidalklappe.
Verfolgt man den histologischen Verlauf des Reizleitungssystems in Richtung des eindringenden His-Bündels, so stellt man fest, dass dieses in vielen menschlichen Herzen nach links abbiegt und am Muskelkamm der Herzscheidewand austritt. Das von Bindegewebe aus dem CFB umgebene His-Bündel kann unterschiedlich lang sein, bevor es sich in den linken und rechten Bündelast aufspaltet. Der erste Zweig verläuft über die linke Seite des Septum interventricularis (Abbildungen 5a und c). Die Teilung des His-Bündels ähnelt einem Jockey, der über dem Muskelkamm des Interventrikelseptums hockt (Abbildung 5a). Gelegentlich ist sie jedoch nach links abgewichen (Abbildung 5c). In diesem Fall tritt der rechte Ast in das Innere der Septummuskulatur ein (Abbildung 5b) und erscheint im rechten Ventrikel in Verbindung mit dem Ansatz des medialen Papillarmuskels.
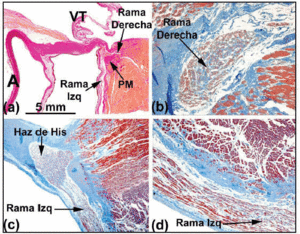
Abb. 5. a: van Gieson-gefärbter Schnitt, der das His-Bündel (menschliches Herz) über dem membranösen Teil (MP) des Interventrikelseptums zeigt. b: Der rechte Ast dieses Herzens liegt an seinem Ursprung intramyokardial und ist von Bindegewebe umgeben (blau) (Jones’sche Trichromfärbung, x20). c: Die Teilung des His-Bündels ist in diesem Herzen über die linke Seite des Muskelkamms der Herzscheidewand verlagert und verläuft in Längsrichtung unter dem Endokard des linken Ventrikels (Jones’sches Trichrom, x5). d: Beachten Sie die Bindegewebshülle (blau) des linken Astes (Jones’sches Trichrom, x10). A: Aorta; E: Endokard; TV: Trikuspidalklappe.
Entlang ihres proximalen Verlaufs sind der rechte und der linke Bündelast von einer faserigen Lamina bedeckt (Abbildungen 5b und d). Wie Tawara2 gezeigt hat (Abbildung 6a), ist der linke Ast beim Menschen typischerweise in drei Faszikel unterteilt, die miteinander in Verbindung stehen. Diese Faszikel verzweigen sich in der Ventrikelspitze und erstrecken sich bis ins Innere der beiden Papillarmuskeln der Mitralklappe, aber auch entlang der Ventrikelwände zurück zur Herzbasis. Weiter distal, im Apex der Ventrikel des menschlichen Herzens, wird es fast unmöglich, die Verästelungen der Purkinje-Fasern zu verfolgen, da diese ihren Fasermantel verlieren und dem arbeitenden Myokard sehr ähnlich sehen.
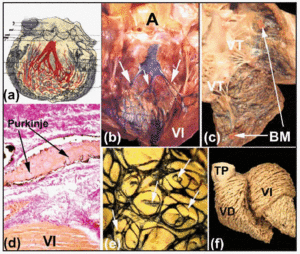
Abb. 6. a: Diagramm von Tawara, das die trifaszikuläre Anordnung des linken Bündelastes beim Menschen zeigt. b und c: ein frisches Kalbsherz, bei dem die rechte und die linke Herzkammer geöffnet wurden. Durch subendokardiale Injektionen von Tusche werden die rechten und linken Bündeläste und das Purkinje-Netzwerk sichtbar. Beachten Sie in B die drei Faszikel des linken Bündelastes (Pfeile) und in C das Moderatorenband (MB). d: Schnitt durch ein Kalbsherz (van Gieson-Färbung, x100) nach Injektion von Tusche in das Purkinje-Netzwerk, das an seinem Ursprung von Bindegewebe (rot) umhüllt ist. e: subendokardiale Anordnung des Purkinje-Netzwerks in der linken Herzkammer eines Kalbs. Man beachte die elliptische Anordnung des Netzwerks und die Ausläufer an den Rändern, die das Myokard durchdringen (Pfeile). f: Präparat der ventrikulären Muskelfasern eines erwachsenen menschlichen Herzens. Man beachte die unterschiedliche Anordnung der medialen und tiefen Schichten des linken Ventrikels. A: Aorta; PT, Pulmonalstamm; LV, linker Ventrikel; LV, linke Herzkammer; TV, Trikuspidalklappe.
Die subendotheliale Injektion von Tusche ist eine der Methoden zur Beobachtung dieser Faserbahnen und zur Darstellung des subendokardialen Verlaufs der rechten und linken Bündeläste und ihrer Verzweigungen in Huftierherzen (Abbildungen 6b und d). Unsere Untersuchungen an Schaf- und Kälberherzen zeigen, dass diese sich etwas von menschlichen Herzen unterscheiden. Kälberherzen sind dem menschlichen Herzen insofern ähnlicher, als die Faszikel des linken Schenkelbündelastes in der Regel aus drei Faszikeln bestehen und ihren Ursprung im oberen Teil des Septum interventriculare haben (Abbildung 6b). Schafherzen weisen jedoch nur zwei Faszikel auf, die auf halber Länge der Septumwand entspringen. Sowohl im Schaf- als auch im Kalbsherz durchqueren kleine Muskeltrabekel die Ventrikelhöhle – die so genannte „falsche Sehne“ -, die in ihrem Inneren distale Verzweigungen der His-Aste zu den Papillarmuskeln und den angrenzenden Ventrikelwänden führen. Auf der rechten Seite des Herzens ist das Moderatorenband sowohl beim Schaf als auch beim Kalb schlanker als beim Menschen, enthält aber im Inneren immer einen Ableger des rechten Bündelastes (Abbildung 6c).
Im Huftierherz ist das subendokardiale Purkinje-Netzwerk sowohl im linken als auch im rechten Ventrikel elliptisch angeordnet (Abbildung 6e). Außerdem entstehen aus seiner Kontur Äste, die die Ventrikelwände durchdringen und zu neuen Ästen oder Anastamosen mit anderen Ästen führen (Abbildung 6e). Intramurale Verzweigungen des Purkinje-Netzes wurden im menschlichen Herzen jedoch nicht nachgewiesen.30
Ein umstrittener Punkt in Bezug auf das Purkinje-Netz ist das Vorhandensein von Übergangszellen zwischen dem arbeitenden ventrikulären Myokard und den Purkinje-Fasern.31 Die anatomischen und immunhistochemischen Untersuchungen von Oosthoek et al.30 zeigen, dass es im Rinderherz eine sehr kleine Zone von Übergangszellen gibt, in der die Purkinje-Fasern ihre bindegewebige Hülle verlieren. Im Schafherz wurden solche Zellen jedoch nicht beobachtet.32 Wenn die Purkinje-Fasern ihre bindegewebige Umhüllung verlieren, werden elektrische Impulse vom CS an die Arbeitsmyozyten der Herzkammern weitergeleitet. Die räumliche Ausrichtung der Arbeitsmyofibrillen in den Ventrikelwänden bestimmt die anisotrope Natur der ventrikulären Erregungsleitung (Abbildung 6f).
ZUSAMMENFASSUNGEN
Obwohl es Unterschiede zwischen den Spezies gibt, ähnelt die Struktur der Knoten sowie des übrigen AV-Leitungssystems des Menschen derjenigen der üblicherweise verwendeten Labortiere. Der SA-Knoten, die Struktur, die den Herzimpuls erzeugt, befindet sich an einem Ende des rechten Vorhofs. Die von ihm ausgehenden Impulse wandern in den Vorhofwänden nach hinten durch eine komplizierte, aber präzise räumliche Anordnung der arbeitenden Vorhoffasern, bis sie das Ende des Vorhofs erreichen. An diesem Ende empfangen die Übergangszellen des AV-Knotens den Impuls und verzögern ihn vor der Weiterleitung über das His-Bündel. Dieses durchquert die isolierende Faserebene zwischen den Vorhöfen und den Herzkammern und leitet den Impuls über zwei Äste (den rechten und den linken Bündelast) an die entsprechenden Herzkammern weiter. Jeder dieser Äste ist durch eine konnektive Hülle aus arbeitenden Ventrikelmyozyten isoliert. Diese Anordnung ermöglicht den Kontakt zwischen den spezialisierten und den arbeitenden Myozyten nur an den distalen Verzweigungen des His-Bündels. Auf diese Weise ist das AV-Leitungssystem, das weitgehend von Tawara2 vor fast 100 Jahren beschrieben wurde, so strukturiert, dass es der Übertragung von Herzimpulsen Ordnung verleiht. Die Kenntnis der Struktur und der Lage des spezifischen leitenden Gewebes innerhalb des Herzens könnte dazu beitragen, Lösungen für verschiedene Herzrhythmusstörungen zu finden.
Leave a Reply