8.3: Gase und Druck
Lernziele
- Die Gasphase beschreiben.
Die Gasphase ist einzigartig unter den drei Aggregatzuständen der Materie, da es einige einfache Modelle gibt, mit denen wir das physikalische Verhalten aller Gase vorhersagen können – unabhängig von ihrer Identität. Für den festen und flüssigen Zustand ist dies nicht möglich. Tatsächlich stellt die Entwicklung dieses Verständnisses des Verhaltens von Gasen den historischen Trennungspunkt zwischen Alchemie und moderner Chemie dar. Die ersten Fortschritte im Verständnis des Verhaltens von Gasen wurden Mitte des 16. Jahrhunderts von Robert Boyle gemacht, einem englischen Wissenschaftler, der die Royal Society (eine der ältesten wissenschaftlichen Organisationen der Welt) gründete.
Wie kommt es, dass wir alle Gase unabhängig von ihrer chemischen Identität modellieren können? Die Antwort liegt in einer Gruppe von Aussagen, die als kinetische Theorie der Gase bezeichnet wird:
- Gase bestehen aus winzigen Teilchen, die durch große Abstände voneinander getrennt sind.
- Gasteilchen sind ständig in Bewegung und stoßen mit anderen Gasteilchen und den Wänden ihres Behälters zusammen.
- Die Geschwindigkeit von Gasteilchen hängt mit der Temperatur eines Gases zusammen.
- Gasteilchen erfahren keine Anziehungs- oder Abstoßungskraft untereinander.
Haben Sie bemerkt, dass sich keine dieser Aussagen auf die Identität des Gases bezieht? Das bedeutet, dass sich alle Gase ähnlich verhalten sollten. Ein Gas, das diese Aussagen perfekt einhält, nennt man ein ideales Gas. Die meisten Gase weisen leichte Abweichungen von diesen Aussagen auf und werden als reale Gase bezeichnet. Die Existenz von realen Gasen schmälert jedoch nicht die Bedeutung der kinetischen Theorie der Gase.
Eine der Aussagen der kinetischen Theorie erwähnt Zusammenstöße. Da die Gasteilchen ständig in Bewegung sind, stoßen sie auch ständig miteinander und mit den Wänden ihres Behälters zusammen. Beim Abprallen der Gasteilchen an den Behälterwänden treten Kräfte auf (Abbildung \(\PageIndex{1}\)). Die von den Gasteilchen erzeugte Kraft, geteilt durch die Fläche der Behälterwände, ergibt den Druck. Druck ist eine Eigenschaft, die wir bei Gasen messen können, aber bei Feststoffen oder Flüssigkeiten berücksichtigen wir den Druck normalerweise nicht.
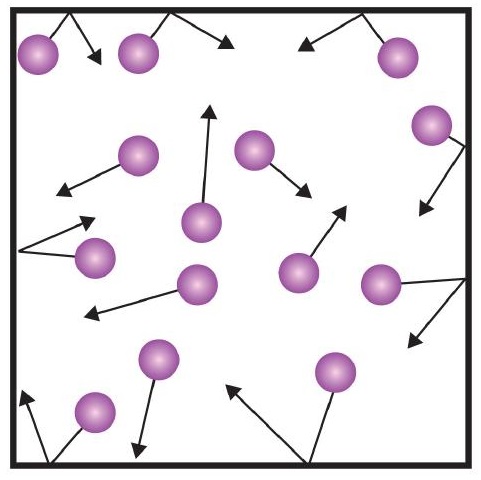
Die Grundeinheit des Drucks ist das Newton pro Quadratmeter (N/m2). Diese kombinierte Einheit wird als Pascal (Pa) neu definiert. Ein Pascal ist keine sehr große Druckmenge. Eine nützlichere Druckeinheit ist das Bar, das 100.000 Pa entspricht (1 Bar = 100.000 Pa). Weitere gebräuchliche Druckeinheiten sind die Atmosphäre (atm), die ursprünglich als der durchschnittliche Druck der Erdatmosphäre auf Meereshöhe definiert war, und mmHg (Millimeter Quecksilber), der Druck, der von einer 1 mm hohen Quecksilbersäule erzeugt wird. Die Einheit Millimeter Quecksilber wird auch Torr genannt, benannt nach dem italienischen Wissenschaftler Evangelista Torricelli, der Mitte des 16. Eine genauere Definition der Atmosphäre in Form von Torr besagt, dass 1 atm genau 760 Torr enthält. Ein Bar entspricht 1,01325 atm. Angesichts all der Beziehungen zwischen diesen Druckeinheiten ist die Fähigkeit, von einer Druckeinheit in eine andere umzurechnen, eine nützliche Fähigkeit.
Beispiel \(\PageIndex{1}\): Umrechnung von Drücken
Schreiben Sie einen Umrechnungsfaktor, um zu bestimmen, wie viele Atmosphären in 1.547 mmHg enthalten sind.
Lösung
Da 1 mmHg gleich 1 Torr ist, ist der angegebene Druck auch gleich 1.547 Torr. Da in 1 atm 760 torr enthalten sind, können wir diesen Umrechnungsfaktor verwenden, um die mathematische Umrechnung durchzuführen:
\(\mathrm{1,547\: torr\mal \dfrac{1\: atm}{760\: torr}=2.04\: atm}\)
Beachte, wie sich die torr-Einheiten algebraisch aufheben.
Übung \(\PageIndex{1}\): Umrechnen von Drücken
Schreiben Sie einen Umrechnungsfaktor, um zu bestimmen, wie viele Millimeter Quecksilber in 9,65 atm stecken.
Antwort
\(\mathrm{9,65\: atm\times \dfrac{760\: mm Hg}{1\: atm}=7,334 \: mm Hg}\).
Die kinetische Theorie besagt auch, dass es keine Wechselwirkung zwischen einzelnen Gasteilchen gibt. Obwohl wir wissen, dass es in realen Gasen tatsächlich intermolekulare Wechselwirkungen gibt, geht die kinetische Theorie davon aus, dass die Gasteilchen so weit voneinander entfernt sind, dass sich die einzelnen Teilchen nicht „spüren“. Daher können wir die Gasteilchen als winzige Materieteilchen betrachten, deren Identität für bestimmte physikalische Eigenschaften nicht wichtig ist.
Übung zur Wiederholung des Konzepts
-
Was ist Druck, und welche Einheiten verwenden wir, um ihn auszudrücken?
Antwort
-
Druck ist die Kraft pro Flächeneinheit; seine Einheiten können Pascal, Torr, Millimeter Quecksilber oder Atmosphären sein.
Key Takeaway
- Die Gasphase hat bestimmte allgemeine Eigenschaften, die für diese Phase charakteristisch sind.
Übungen
-
Was ist die kinetische Theorie der Gase?
-
Nach der kinetischen Theorie der Gase sind die einzelnen Gasteilchen (immer, häufig, nie) in Bewegung.
-
Warum übt ein Gas Druck aus?
-
Warum lässt die kinetische Theorie der Gase vermuten, dass alle Gase ein ähnliches Verhalten zeigen?
-
Reihen Sie die folgenden Druckgrößen in der Reihenfolge vom kleinsten zum größten Wert: 1 mmHg, 1 Pa und 1 atm.
-
Welche Einheit des Drucks ist größer – das Torr oder die Atmosphäre?
-
Wie viele Torr sind in 1.56 atm?
-
Wie viele Torr sind in 1. 56 atm?
-
Der Blutdruck wird in Millimeter Quecksilber angegeben. Wie hoch wäre der Blutdruck in Atmosphären, wenn der systolische Blutdruck eines Patienten 120 mmHg und der diastolische Blutdruck 82 mmHg beträgt? (In der Medizin würde ein solcher Blutdruck als „120/82“ angegeben, also als „einhundertzwanzig über zweiundachtzig“.)
-
In der Wettervorhersage wird der barometrische Druck in Zoll Quecksilber (in. Hg) ausgedrückt, wobei 1 Zoll Hg genau 25,4 mmHg entspricht. Wie hoch ist der Luftdruck in Millimeter Quecksilber, wenn der Luftdruck mit 30,21 Zoll Hg angegeben wird?
Antworten
-
Gase bestehen aus winzigen Teilchen, die durch große Entfernungen getrennt sind. Die Gasteilchen sind ständig in Bewegung und stoßen mit anderen Gasteilchen und den Wänden ihres Behälters zusammen. Die Geschwindigkeit der Gasteilchen hängt mit der Temperatur des Gases zusammen. Gasteilchen erfahren keine Anziehungs- oder Abstoßungskraft untereinander.
-
Ein Gas übt Druck aus, wenn seine Teilchen an den Wänden seines Behälters abprallen.
-
1 Pa, 1 mmHg und 1 atm
-
1.190 Torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
Leave a Reply