Perché #”HF “# ha un punto di ebollizione più basso dell’acqua anche se #”F “# è più elettronegativo di #”O “#?
Ci sono molti fattori complicati. Questo è quello che ho potuto trovare:
- L’acqua può formare una rete di legami a idrogeno più equilibrata (due accettori e due donatori, invece di un donatore e tre accettori), rendendo il sistema bulk più uniformemente interagente e quindi più forte nel suo complesso.
- L’acqua forma una rete di legami a idrogeno più estesa (un ambiente locale tetraedrico tridimensionale, piuttosto che un ambiente bidimensionale a zig zag), rendendo il sistema bulk meno facilmente vaporizzabile.
- L’acqua ha generalmente un angolo di interazione più ottimale, in quanto corrisponde più strettamente alla geometria elettronica della molecola e allinea le interazioni lungo il dipolo molecolare, mentre #”HF “# avrebbe un legame a idrogeno più forte (in termini di numeri grezzi) se le interazioni fossero lineari.
DISCLAIMER: RISPOSTA LUNGA! Anche molto visiva.
Il legame a idrogeno è la forza intermolecolare più forte sia in #”HF “# che in #”H”_2 “O “#. La forza di interazione dipende dalla distanza di interazione, dall’angolo di interazione e dall’estensività della rete.
Quando estraiamo tutte le interazioni di legame a idrogeno, e assumiamo acqua pura e #”HF “# puro, otteniamo (isolando un set selezionato di molecole da una matrice infinita) #””^()##””^()#:
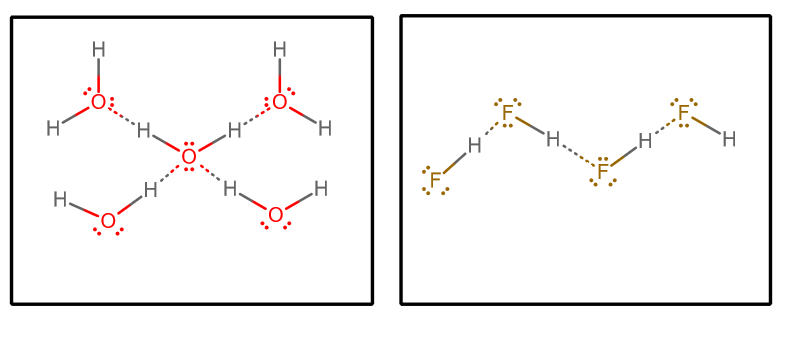
Possiamo quindi considerare alcuni fattori:
- Numero di donatori e accettatori di legami a idrogeno
Ogni molecola d’acqua può accettare due interazioni di legame a idrogeno (attraverso le coppie solitarie) e donare due interazioni di legame a idrogeno (attraverso gli idrogeni).
D’altra parte, ogni molecola #”HF “# accetta tre interazioni di legame a idrogeno (tramite le coppie solitarie) e ne dona solo una (tramite l’idrogeno).
Si potrebbe quindi sostenere che l’acqua ha una rete di legami a idrogeno più equilibrata, che rende il sistema bulk meno capace di vaporizzare nel complesso. Questo sosterrebbe il più alto punto di ebollizione dell’acqua rispetto a #”HF “#.
- Elettronegatività di #bb(“F”)# e #bb(“O”)#
#”F “# è più elettronegativa, quindi mantiene la sua densità di elettroni più facilmente; quindi, le coppie solitarie dovrebbero essere donatori più deboli di interazioni di legame a idrogeno rispetto alle coppie solitarie su #”O “#.
Questo sembrerebbe prevedere che ogni singola interazione di legame a idrogeno sia più debole, il che sosterrebbe il più alto punto di ebollizione dell’acqua rispetto a #”HF “#, MA questo è contraddetto dal punto seguente.
- Forza media dei legami a idrogeno grezzi in #bb(“HF”)# vs. acqua
#”O”-“H “cdotcdotcdot: “O”-#, #DeltaH_(“H”-“bond”) ~~ “21 kJ/mol “#
#”F”-“H “cdotcdotcdot: “F”-#, #DeltaH_(“H”-“bond”) ~~ “161.5 kJ/mol “#
Questi dati da Wikipedia suggeriscono che #”HF “# ha interazioni di legame a idrogeno più forti tra le molecole #”HF “# che in acqua.
Questo non supporterebbe la prova sperimentale che #”HF “# ha un punto di ebollizione molto più basso, ma anche questo è solo un numero grezzo e non considera, diciamo, gli angoli di interazione nel sistema bulk.
- Angoli di legame a idrogeno osservati e dimensioni di interazione
#”HF “#, essendo una molecola lineare, è stato visto avere interazioni di legame a idrogeno a zig zag, in due dimensioni, con angoli di #116^@#. Un angolo più ottimale sarebbe a #180^@#, poiché questo darebbe interazioni di dipolo più dirette. Questo limita la forza di legame a idrogeno di #”HF “#.
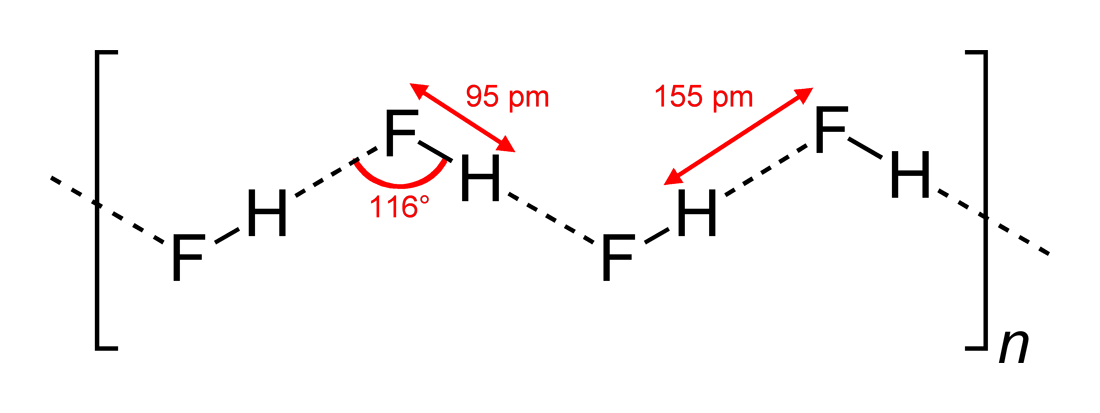
L’acqua, essendo una molecola piegata con una geometria elettronica tetraedrica, può legarsi a idrogeno in tre dimensioni.
Ecco un esempio del cluster tetraedrico che si trova nell’ambiente locale di un’interazione di legame a idrogeno nell’acqua:
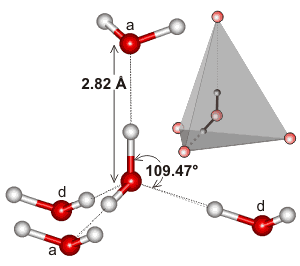
Può essere che l’estensività della rete di legame a idrogeno, e come tende a corrispondere alla geometria elettronica dell’acqua, è ciò che rende il punto di ebollizione dell’acqua così alto. Questo sosterrebbe il più alto punto di ebollizione dell’acqua rispetto all’ #”HF”.
In generale, questi sono i fattori che mi sembrano meno problematici:
- L’acqua può creare una rete di legami a idrogeno più bilanciata (due accettori e due donatori, invece di un donatore e tre accettori), rendendo il sistema più uniformemente interagente e quindi più forte nel suo insieme.
- L’acqua forma una rete di legami a idrogeno più estesa (un ambiente locale tetraedrico tridimensionale, piuttosto che un ambiente bidimensionale a zigzag), rendendo il sistema bulk meno facilmente vaporizzabile.
- L’acqua ha generalmente un angolo di interazione più ottimale, in quanto corrisponde più strettamente alla geometria elettronica della molecola e allinea le interazioni lungo il dipolo molecolare, mentre #”HF “# avrebbe un legame a idrogeno più forte (in termini di numeri grezzi) se le interazioni fossero lineari.
Leave a Reply